痛风性关节炎患者NETs表达水平与骨破坏、炎症因子的相关性分析
2021-10-15田晓玲陈莉刘满华王雅洁汪甜何瑶
田晓玲,陈莉,刘满华,王雅洁,汪甜,何瑶
(1.咸宁市中心医院·湖北科技学院附属第一医院全科医学科,2.老年科,湖北 咸宁 437100)
痛风为长期的高尿酸血症导致单钠尿酸盐(monosodium urate,MSU)晶体在关节、肾脏及其他软组织沉积所引发的一组异质性疾病[1]。随着生活习惯的改变,我国人群中出现高尿酸血症和痛风的比例上升,痛风性关节炎急性发作期间,患者往往难以忍受疼痛,严重影响生活工作。但因痛风性关节炎急性发作具有自限性且病程较短,患者常在疼痛缓解后忽视了正规的降尿酸治疗,从而导致关节炎反复发作,关节内尿酸钠晶体逐渐累积成为痛风石,进而发展为慢性痛风石性关节炎[2]。痛风石不仅因其本身的占位效应造成关节功能障碍,更能引起慢性关节炎、关节内骨破坏、关节毁损甚至致畸、致残,既是患者及家庭的不幸,也给社会带来沉重的负担[3]。因此,探索痛风石引起骨破坏的发生机制,并在此基础上研究有效的治疗策略至关重要。
中性粒细胞经坏死性凋亡(NETosis)后,释放解聚后的丝状DNA结构及各种水解酶类形成胶水状的网状结构即为中性粒细胞胞外诱捕网(neutrophil extracellular traps,NETs),NETs包裹病原体或刺激物,并产生相应的生物学效应[4]。NETosis和 NETs的发现为我们理解中性粒细胞在痛风发病中的作用开辟了全新的视角,但近年来NETs相关研究鲜有报道。因此,为进一步探讨NETs表达水平在急性痛风性关节炎中的相关性,本研究选取2019年1月至2020年2月在我院进行治疗的痛风性关节炎急性发作期患者63例作为研究对象,对此类患者血清NETs表达水平与骨破坏、炎症因子的相关性进行研究分析,现报告如下。
1 资料与方法
1.1 一般资料
1.1.1纳入标准:(1)痛风诊断标准为既往至少有一次双手或双脚的外周关节/滑囊疼痛、肿胀或压痛,在外周关节或者滑囊中检查发现尿酸盐结晶或者典型的痛风石;(2)本次入院就诊因急性痛风性关节炎;(3)年龄18~80岁;(4)意识神志清醒可配合完成本次研究;(5)患者及其家属均知情同意。
1.1.2排除标准 (1)合并骨质疏松、类风湿性关节炎、骨肿瘤患者;(2)患有血液系统疾病的患者;(3)患有较为严重的肝、肾等功能缺损的患者;(4)患有免疫系统疾病患者;(5)其他炎症性关节炎。
选择2019年1月至2020年2月在我院进行治疗的痛风性关节炎急性发作期患者63例作为观察组,其中男39例,女24例;年龄33~77岁,平均年龄(48.46±8.57)岁;选择同期在我院进行体检的50名健康人员作为对照组,其中男33例,女17例;年龄35~75岁,平均年龄(46.46±8.19)岁。两组一般资料比较,差异无统计学意义(P>0.05),具有可比性。
1.2 方法
观察组治疗前抽取空腹5 mL外周静脉血,对照组体检过程中抽取空腹5 mL外周静脉血,离心速度3 000 r/min,10 min后取上清,-80 ℃保存待检。
全自动酶标分析仪购自北京普朗新技术有限公司(型号为NDM-9602G);所用试剂购自美国R&D 公司。采用ELISA法检测血清NETs、RANKL、抗酒石酸酸性磷酸酶-5b(TRACP5b)、β胶联降解产物(β-CTX)、C-反应蛋白(CRP)、白细胞介素-6(IL-6)、肿瘤坏死因子α(TNF-α)、前列腺素E2(PGE2)、可溶性细胞间粘附分子-1(sICAM-1)和血管细胞间粘附分子-1(sVCAM-1)表达水平,严格依据说明书进行操作。
1.3 统计学方法

2 结 果
2.1 两组血清NETs水平比较结果
观察组血清NETs水平为(1.613±0.215)ng/mL,较对照组的(0.549±0.114)ng/mL升高(t=8.958,P=0.013)。
2.2 两组血清CRP及炎症因子水平比较结果
观察组血清中CRP、IL-6、TNF-α、PGE2、sICAM-1和sVCAM-1水平较对照组升高(P<0.05),见表1。

2.3 两组血清中骨破坏指标水平比较结果
观察组血清中骨破坏因子RANKL、TRACP5b、β-CTX水平高于对照组(P<0.05),见表2。
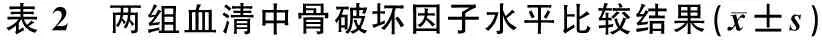
2.4 观察组NETs水平与骨破坏和炎症因子相关性分析
观察组血清中NETs水平与CRP的相关性无统计学意义(P>0.05),与RANKL、TRACP5b、β-CTX、IL-6、TNF-α、PGE2、sICAM-1和sVCAM-1均呈正相关(P<0.05),见表3。

表3 NETs水平与骨破坏和炎症因子相关性
3 讨 论
痛风是由于患者体内发生异常的嘌呤代谢,导致血尿酸长时间上升引起的关节性疾病,长时间的高水平血尿酸会造成MSU析出增多,产生大量尿酸结晶,聚集在关节滑膜、关节腔、关节软骨等位置造成无菌性的炎症,若治疗不及时,可进一步发展为慢性痛风石性关节炎[3]。痛风石的形成不仅会引起关节内骨破坏和疼痛,更严重者可引起关节毁损甚至致畸、致残,给患者个人、家庭和社会带来沉重的负担。痛风性关节炎不仅存在无菌性炎症,还存在关节骨质破坏的持续进行性,但具体机制仍尚未明确。目前有研究表明,关节内MSU晶体持续沉积会引发急性炎症反应,其中血清炎性因子可能参与发病过程。局部免疫细胞(包括巨噬细胞、树突状细胞和滑膜细胞)激活后,中性粒细胞大量涌入受累关节的滑膜[5]。在炎症区,中性粒细胞摄取MSU晶体后导致炎症介质释放,包括肿瘤坏死因子TNF-α、IL-6、前列腺素类(PGE)等,从而引起疼痛和全身反应。血清C反应蛋白(CRP)、IL-6等促炎性细胞因子在痛风性关节炎患者血清中的含量显著升高,尤其在关节部位呈高表达聚集[6]。此外,当细胞内尿酸水平过高时,细胞间粘附分子sICAM-1和sVCAM-1会诱导机体发生氧化应激,促进血管收缩物质分泌及促炎因子生成,加重炎症细胞在关节局部浸润和炎症反应的激活放大[7]。这些细胞产生的趋化因子则加剧了中性粒细胞的招募。为避免细胞激活和介质释放的正反馈循环,以上炎症过程需要被严格控制。在此基础上,痛风石的形成是干扰痛风炎症自我增强回路的一个机制,能停止急性发作以防止炎症导致的明显的组织损伤和骨重塑[8]。
痛风石的基本结构包括中心的MSU晶体核及其外周包绕的细胞层和纤维层,细胞层包含 CD68+巨噬细胞、浆细胞及少量的肥大细胞,T细胞及B细胞数量较少,几乎无中性粒细胞[9]。既往认为,在急性痛风缓解阶段,巨噬细胞吞噬凋亡或坏死的中性粒细胞并释放TGF-β介导炎症缓解,其可能为慢性痛风石结构中中性粒细胞数量较少的原因之一[10]。但据相关研究报道,NETosis为中性粒细胞在病原体或其他刺激物存在的条件下,有别于传统的细胞“凋亡”或“坏死”的一种细胞死亡形式,髓过氧化物酶(MPO)以及弹性蛋白酶(NE)转移至核内,和组蛋白产生相互作用,诱发染色质解聚,然后在精氨酸脱亚氨酶4(PAD4)的催化作用下,三类核心的组蛋白精氨酸残基出现瓜氨酸化;同时核包膜裂解,胞核与胞质内物质混合,内膜和细胞器消失,整个过程未见坏死出现[8]。而中性粒细胞经坏死性凋亡后,释放解聚后的丝状DNA结构及各种水解酶类形成胶水状的网状结构即为NETs,NETs可包裹病原体或刺激物并产生相应的生物学效应。本研究结果显示,观察组血清NETs水平较对照组明显升高,说明NETs参与了痛风的急性炎症过程。
痛风急性发作期,IL-6、PGE2等促炎介质在受累滑膜腔中最先出现,随后才是中性粒细胞的聚集和NETs的释放。本研究中,观察组血清CRP、IL-6、TNF-α、PGE2、sICAM-1和sVCAM-1水平较对照组明显升高,除CRP外,其他均与NETs浓度呈正相关,这与既往的研究结果类似。由于早期炎症介质的释放促进NETs的形成,NETs的形成也反之加重炎症反应,故二者呈现显著的相关性。随着大量中性粒细胞被趋化至炎症部位,大量NETs聚集形成agg NETs(aggravate NETs)包绕MSU晶体,agg NETs可通过多种水解酶降解包括TNF-α、IL-6在内的炎症因子,这也是急性痛风自限性缓解的重要机制之一。由于aggNETs存在于受累关节中,外周血中无法检测到,其在痛风发作晚期和缓解期中的作用仍有待进一步阐明。
痛风石和痛风患者的滑膜组织可见共存的胞外DNA及中性粒细胞颗粒内含物,有痛风石存在的骨组织局部骨破坏明显加重,且存在大量表达RANKL、TRACP5b和β-CTX。TRACP5b与RANKL作为破骨细胞分泌的一类活性分子,参与骨基质的降解;β-CTX亦作为能够反映破骨细胞活性一种骨基质内胶原降解产物。本研究中观察组血清中骨破坏因子RANKL、TRACP5b、β-CTX显著高于对照组,说明早期痛风关节炎的发展过程中MSU晶体诱导的 NETs 可促进破骨细胞分化。费雅楠等[11]报道,不同超声表现下的痛风性关节炎患者的血尿酸水平并无差异,且RANKL浓度也与血尿酸水平无相关性,说明血尿酸并不能代表骨损害的程度。本研究中,我们进一步对NETs与破骨相关炎症因子的相关性进行分析,结果显示,观察组血清NETs水平与骨破坏相关炎症因子均呈正相关。
综上所述,痛风性关节炎患者急性发作期血清中NETs水平异常升高,其与炎症反应和骨质破坏有较强相关性,是反映痛风性关节炎急性发作期的炎症水平和骨质破坏程度的良好指标,除NETs外,也需要考虑其他参与痛风骨破坏的影响因素。
