基于球形金-银纳米笼比色法检测谷胱甘肽和谷胱甘肽转移酶
2021-10-14肖传豪穆之琳陈郑博
肖传豪,穆之琳,陈郑博
(1. 濮阳职业技术学院,河南大学 濮阳工学院,河南 濮阳 457000;2. 首都师范大学 化学系,北京 100048)
谷胱甘肽(GSH)是细胞内最丰富的巯基化合物,细胞GSH 浓度的变化与衰老、心脏病、癌症、白细胞减少、肝损伤、HIV 和神经退化性疾病有关[1-2]. 谷胱甘肽转移酶(GST)在肝细胞液中含量较高,通过催化GSH 与活性代谢产物结合,在降低毒性和促进尿排泄方面发挥重要作用[3]. GST 已被证明是肺癌、卵巢癌、乳腺癌和胃癌等肿瘤的重要标志物[4].
目前已发展了多种分析方法检测GSH,如色谱法[5-6]、光度法[7]、质谱法[8]和免疫发光法[9]等.对于GST 检测,目前已发展了一些检测方法,包括比色法、生物发光探针法、荧光微板法、金属有机抑制剂和光学方法[10-14]. 然而,这些方法由于存在成本高、灵敏度低、预处理繁琐等缺点[15],限制了它们在生化分析中的应用. 而比色法因其可简单地用肉眼读出而备受关注[16-17].
本文以制备的具有过氧化物酶活性的球形Ag-Au 纳米笼作为催化剂,催化3,3′,5,5-四甲基联苯胺(TMB)和过氧化氢(H2O2)反应,生成蓝色的TMB 氧化产物(oxTMB)并在652 nm 出现紫外吸收峰. 不同浓度GSH 的加入造成oxTMB 被还原,从而引起溶液由蓝色变浅,652 nm 处的吸光强度减小. GST 和GSH 的特异性作用使得GSH 对TMB和H2O2的反应抑制程度减弱,颜色由浅变成深蓝色,652 nm 处的吸光度增强. 从而实现了一种简单、快速、灵敏、专一检测GSH 和GST 的比色方法,并用于人血清样品中的GSH 和GST 的测定,获得了满意的结果.
1 实验部分
1.1 主要仪器与试剂UV-2550 型紫外可见(UVvis)吸收光谱仪(苏州生产);H-7560 型透射电子显微镜(日本日立公司);SU-8000 型透射电子显微镜(日本日立公司).
硝酸银(99.7%)、氯金酸(99.9%)、柠檬酸钠(99%)、醋酸(98%)、醋酸钠(99.5%)、过氧化氢、3,3′,5,5-四甲基联苯胺(TMB)(99%)、谷胱甘肽(GSH)(98%)、谷胱甘肽转移酶(GST)(阿拉丁试剂(上海)有限公司), 试剂均为分析纯,无任何纯化步骤.
1.2 球形纳米Ag 的制备基于AgNO3还原法[18],将油浴锅加热至95 ℃,向油浴加热的烧瓶中加入50 mL 甘油-水混合物(10 mL 甘油+40 mL 水),在1 200 r/min 的 剧 烈 搅 拌 下,向 溶 液 中 添 加9 mg AgNO3. 然后迅速向溶液中加入1 mL 3%柠檬酸钠溶液,在95 ℃下反应1 h 后,自然冷却到室温,得到粒径为40 nm 球形银溶液.
1.3 球形Ag-Au 纳米笼的制备取1.2 mL 上述制备好的纳米银溶液和3.6 mL 蒸馏水于10 mL 离心管中. 将0.1 mol/L 的氯金酸溶液稀释至3.75 mmol/L,然后移取1.2 mL 氯金酸(3.75 mmol/L)分5 次加入到上述溶液中,每次240 μL,每隔10 min 加一次,直至加完. 由此得到HAuCl4刻蚀纳米银形成的球形Ag-Au 纳米笼溶液,放置在4 ℃条件下备用.
1.4 实验方法对于GSH 的检测,通常将100 μL Ag-Au 溶液、300 μL 5 mmol/L TMB、300 μL 5 mmol/L H2O2、300 μL HAc-NaAc(pH 3.6)混合均匀,并在室温下孵化30 min. 然后加入100 μL 不同浓度的GSH溶液并在常温下反应5 min,在室温下记录 400~800 nm 处的紫外吸收光谱,记录652 nm 波长处的oxTMB 的吸光度值. 以该值为纵坐标(y),GSH 浓度c为横坐标(x)绘制标准曲线,用以测定样品GSH含量.
对于GST 的检测,分别将100 μL 900 μmol/L GSH 溶液和100 μL 不同浓度的GST 溶液混合,在37 °C 下孵化3 h. 然后向上述溶液再加入300 μL HAc-NaAc(pH 3.6)、300 μL 5 mmol·L-1TMB、300 μL 5 mmol/L H2O2、100 μL Ag-Au 溶液. 充分混合后反应10 min,记录 400~800 nm 处的紫外吸收光谱,记录652 nm 波长处的oxTMB 的吸光度值. 以该值为纵坐标(y),GST 质量浓度ρ为横坐标(x)绘制标准曲线,以此测定样品GST 含量.
2 结果与讨论
2.1 实验原理如图1,具有大表面积的球形Ag-Au 纳米笼作为催化剂,催化TMB 和H2O2反应,无色的TMB 被氧化成蓝色的oxTMB,并在652 nm处观察到清晰的紫外吸收峰. 在Ag-Au 纳米笼-TMB-H2O2体系中加入GSH 后,652 nm 处的吸光度降低,溶液颜色从蓝色变为浅蓝色,最后到无色.这种现象是由于oxTMB 被GSH 还原所致[19]. 对于GST,它能够特异性结合GSH,因此,GST 的加入将有效地抑制oxTMB 被GSH 还原,导致652 nm处的吸光度增加,溶液颜色从无色变为蓝色. 因此,可以通过652 nm 处的oxTMB 的吸光度和颜色的变化来测定GSH 和GST 的含量.

图1 利用Ag-Au 纳米笼催化TMB-H2O2 反应比色检测GSH 和GST 示意图Fig. 1 Schematic of colorimetric detection of GSH and GST based on TMB-H2O2 reaction catalyzed by Ag-Au nanocage
2.2 Ag-Au 纳米粒子表征如图2,TEM(图2(a))和SEM(图2(c))图像显示了Ag-Au 空心笼的纳米结构. HRTEM 图像也清楚地显示了Au-Ag 纳米笼的形成(图2(b)). 加入氯金酸前后形成的纳米Ag和Ag-Au 纳米笼的UV-vis 吸收光谱如图2(d)所示,随着氯金酸的加入,溶液的吸收峰从427 nm 处红移到544 nm. 这些结果都证实了球形纳米银成功被氯金酸刻蚀,同时氯金酸还原后生成的纳米金沉积在刻蚀的纳米银表面形成Ag-Au 纳米笼.

图2 Ag-Au 纳米笼的纳米粒子表征Fig. 2 Characterization of nanoparticles in Ag-Au nanocages
2.3 反应条件的优化考察了不同浓度(0.25,0.5,0.75,1 mmol/L)氯金酸对Ag-Au 纳米笼的吸光度的影响(图3). 实验结果表明,随着氯金酸浓度的增加,溶液的吸光度先增大后减小. 当氯金酸浓度为0.75 mmol/L 时,此时544 nm 处的溶液吸光度达到最大,表明此浓度下的Ag-Au 纳米粒子催化能力最强. 所以,0.75 mmol/L 为氯金酸的最佳反应浓度. 考察了不同c(TMB)/c(H2O)(1∶1,1∶2,1∶10,1∶20,5∶1,10∶1)对溶液吸光度的影响. 如图4,当TMB 为10 mmol/L,H2O2浓度为10 mmol/L 时,652 nm 处的吸光度接近最大,又鉴于如果H2O2过剩,过剩的H2O2将和GSH 反应,故选用10 mmol/L TMB 和10 mmol/L H2O2用 于 后 续 实 验. 根 据 文献[20],当pH 高于4 时,Ag 纳米粒子的催化效果会使H2O2会分解为H2O 和O2,而不是OH 自由基,故将pH 控制在3.6 左右. 因此,本实验选择pH 3.6的HAc-NaAc 缓冲溶液.
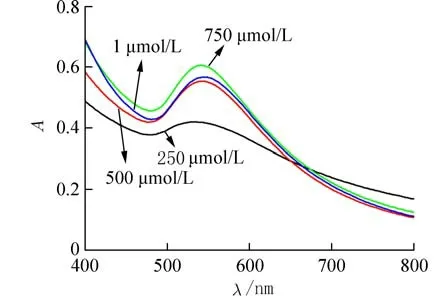
图3 不同浓度氯金酸对Ag-Au 纳米笼吸光度的影响Fig. 3 Effect of different concentrations of chloroauric acid on the absorbance of Ag-Au nanocages

图4 TMB/H2O2 浓度比对oxTMB 溶液吸光度的影响Fig. 4 Effect of TMB/H2O2 concentrations on the absorbance of oxTMB
2.4 灵敏度与线性范围在最佳反应条件下,对不同浓度的GSH(终浓度:0,0.5,0.6,0.7,0.8,1.0,2.0 μmol/L)进行了定量检测,结果如图5 所示. 无GSH 存在时,Ag-Au 纳米笼很容易催化TMB 和H2O2反应,生成蓝色的oxTMB 溶液,且在652 nm处存在出现很强的吸收峰;随着GSH 浓度的增加,652 nm 处的吸光度逐渐降低,相应地,溶液颜色从蓝色逐渐变为浅蓝,最终为无色(图5(a)内插图),表明oxTMB 能被GSH 还原. 而且,652 nm 处的吸光度值随着GSH 浓度的对数值增加而增加,在0.5~1.0 μmol/L 范围内线性减小,其线性方程为y=-0.122-5.231x,相关系数R2为0.986(图5(b)),相对标准偏差(RSD)小于3.1%(n=3),表明此方法可用于定量检测GSH. 当GST 被加入到Ag-Au 纳米笼-TMB- H2O2-GSH 溶液时,由于GST 和GSH 能特异性结合,导致652 nm 处吸光度增加,溶液颜色由无色变成蓝色(图6(a)). GST 在1~50 mg/L 范围内时,GST 溶液的质量浓度(x)对数值与其吸光度值(y)呈良好的线性关系,其线性方程为y=0.855+0.01x,相关系数R2为0.999(图6(b)),RSD 小于2.8%(n=3),方法的检出限(3 倍信噪比)为1 nmol/L.以上说明该方法对GSH 和GST 检测具有较高的灵敏度和稳定性.

图5 最佳反应条件下不同浓度GSH 溶液紫外检测光谱曲线Fig. 5 The UV detection spectra of GSH solutions with different concentrations under the optimal reaction conditions
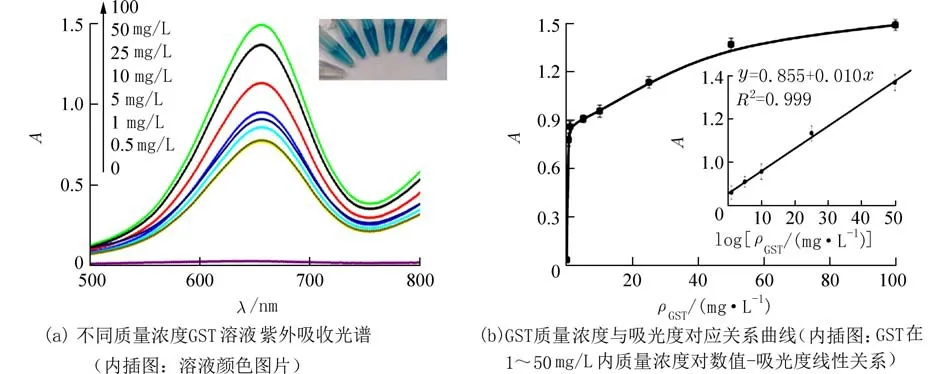
图6 GST 紫外检测光谱曲线Fig. 6 The UV detection spectra of GSH solutions
2.5 选择性选择5 种常见物质(谷氨酸、半胱氨酸、组氨酸、葡萄糖和甘氨酸)作为干扰物质,并以2 μmol/L 的浓度于上述最优反应条件下检测. 结果表明,除了GSH 引起652 nm 处吸光度值的明显改变,其它3 种干扰物均不会出现响应. 然后分别在这5 种干扰物-Ag-Au 纳米笼-TMB-H2O2体系中加入1 mg/L GST,几乎未引起任何吸光度的变化. 这些结果表明该方法对GSH 和GST 有足够的特异性,这归因于GSH 与oxTMB 以及GSH 和GST 之间的特异性相互作用.
2.6 实际样品分析通过检测新鲜人血清中的GSH 和GST,研究了本文方法在生物环境中的传感性能. 将新鲜人血清稀释100 倍,使GSH 浓度在本实验的线性范围内. 为了测量回收率,分别添加不同含量的GSH 和GST 进行加标回收实验,结果见表1. 样品的平均回收率为95%~103.37%,RSD不大于5.6%,说明本方法可用于真实临床样本中的GSH 和GST 的检测.
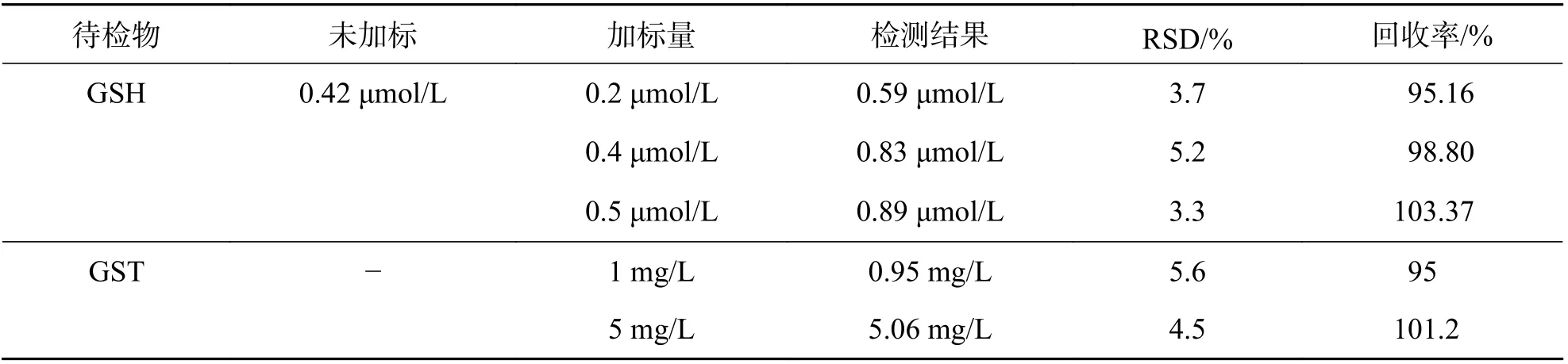
表1 血清样品中GSH 和GST 回收结果(n=3)Tab. 1 Recovery results of GSH and GST in serum samples (n=3)
3 结论
建立了一种高灵敏和选择性的比色法用于GSH 和GST 的检测. Ag-Au 纳米笼表现出类似过氧化物酶的活性,催化TMB 和H2O2反应,伴随着蓝色oxTMB 及652 nm 处紫外吸收峰的形成. 为了提高检测体系的灵敏度,优化了TMB 浓度、H2O2浓度、溶液pH 值检测条件. 研究表明,当 TMB 浓度为 5 mmol/L,H2O2浓度为 10 mmol/L,在pH 3.6的HAc-NaAc 溶液里取得最优检测结果,且具有优异的选择性. 随着GSH 浓度的增加,Ag-Au 纳米笼的吸光度在0.5~1.0 μmol/L 范围内呈线性减小;随着GST 质量浓度的增加,Ag-Au 纳米笼的吸光度在1~50 mg/L 范围内呈线性增加.
