过表达RkHMGCR 基因对红冬孢酵母类胡萝卜素合成的影响
2021-10-14和美霞张晓庆季秀玲魏云林
和美霞,陈 波,胡 丽,张晓庆,季秀玲,魏云林,张 琦
(昆明理工大学 生命科学与技术学院,云南 昆明 650500)
类胡萝卜素(carotenoid)是一类重要脂溶性色素的总称,是由异戊二烯骨架构成的C40 或C30萜类化合物,其广泛存在于植物、细菌、真菌和藻类中. 类胡萝卜素是人体内维生素A 的前体,但人和动物不能自身合成,摄入类胡萝卜素可提高人体免疫力[1]. 此外,类胡萝卜素还具有着色、抗氧化、抗凋亡和抗癌作用[2-5]. 类胡萝卜素是以乙酰CoA作为底物,经甲羟戊酸(mevalonate,MVA)途径合成焦磷酸异戊烯基(isopentenylpyrophosphate,IPP)和二甲基烯丙基焦磷酸(dimethylallyl diphosphate,DMAPP),二者经浓缩并经不同反应过程进一步转化为番茄红素、β-胡萝卜素等不同类胡萝卜素[6]. 3-羟基-3-甲基戊二酸单酰辅酶A 还原酶(3-hydroxy-3-methylglutaryl-CoA reductase,HMGCR)催化3-羟基-3-甲基戊二酸单酰辅酶A(HMG-CoA)生成MVA,是MVA 合成途径中的限速酶,也是异戊二烯生物合成途径的第一个关键酶,对于类胡萝卜素和麦角固醇等异戊二烯衍生物的生物合成有着重要作用[7-8].
HMGCR 广泛存在真核生物、原核生物和古细菌中,是一种高度保守的膜结合酶[9]. 根据氨基酸序列的差异,HMGCR 可以分为Ⅰ类和Ⅱ类,真核生物和古菌的HMGCR 属于Ⅰ类,其利用NADPH作为电子供体,而细菌的HMGCR 属于Ⅱ类并利用NADH 作为电子供体[10-12]. 真核生物HMGCRs在氨基酸序列上存在很大差异,但一些关键位点如底物结合位点TTEGALVA 和ENVIGX3I/LP,NADPH 结 合 位 点DAMGMNMIS 和GTVGGGT,以及与催化活性相关的4 个关键氨基酸残基Glu、Lys、Asp 和His 却高度保守[13-14]. 研究还表明,Ⅰ类HMGCR 的N 末端具有参与甾醇感应、蛋白泛素化降解调节和催化反应的多种跨膜结构域,且该结构域在每种物种中种类和个数不同,而且序列变化很大[9,13-14].
目前,商业化的类胡萝卜素来源主要是通过化学合成获得,少量是从植物提取和微生物发酵生产的天然类胡萝卜素. 化学合成的类胡萝卜素虽然具有天然类胡萝卜素类似的分子结构,但天然类胡萝卜素更有利于健康,因此人们对其需求也日益增加[1].近年来通过代谢工程研究使微生物高效益、低成本生产类胡萝卜素逐渐成为有希望的替代途径[15],而且产油红酵母由于保持产油酵母发酵上的优势并能持续提供乙酰CoA 合成类胡萝卜素和油脂等各种衍生物的优点逐渐成为研究热点[16]. 红冬孢酵 母(Rhodosporidium kratochvilovae)YM25235 是一株分离自云南程海的产油红酵母菌株[17],和很多红酵母一样,YM25235 菌株也主要合成圆酵母素(torulene)、红酵母红素(torularhodin)、γ-胡萝卜素(γ-carotene)、β-胡萝卜素(β-carotene)等4 种类胡萝卜素[18-19]. 因此,本研究拟从YM25235 菌株中克隆HMGCR基因RkHMGCR,并将其转回YM25235菌株中进行过表达,以提高YM25235 菌株产类胡萝卜素的水平,为进一步筛选类胡萝卜素高产菌株和工艺化生产类胡萝卜素的研究与应用打下基础.
1 材料与方法
1.1 质 粒 和 菌 株红 冬 孢 酵 母(Rhodosporidium kratochvilovae)YM25235 菌株由云南大学微生物研究所李绍兰研究员惠赠,大肠杆菌(Escherichia coli)DH5α 由本研究室保存,质粒pMD-18T 购自宝生物工程(大连)有限公司,表达载体pRH2034 购自新加坡民族大学.
1.2 试剂和试剂盒DNA 纯化回收试剂盒购自北京百泰克生物有限公司,质粒提取试剂盒购自Omega 公司,酵母基因组DNA 和RNA 提取试剂盒购自上海生工生物工程股份有限公司,限制性内切酶购自Thermo 公司,高保真DNA 聚合酶购自南京诺维赞生物有限公司,高效液相所用试剂为色谱纯,其他试剂均为国产分析纯.
1.3 RkHMGCR 基因的克隆与序列分析根据转录组测序获得的RkHMGCR基因的蛋白质编码序列设计并合成引物对:上游引物RkHMGCR-F:5′-TTCGGATCCTTATGGTCCTCTCGCCGTC-3′和下游引物RkHMGCR-R:5′-GCAGATATCTTACT CTTTGGCGAACCCG-3′(下划线分别为BamH Ⅰ和EcoR Ⅴ位点),以提取自YM25235 菌株的总RNA 反转录的cDNA 作为模板进行PCR 扩增. 扩增条件为:94 ℃预变性5 min,94 ℃变性30 s、63 ℃退火30 s、72 ℃延伸4 min,进行30 个循环,最后72 ℃延伸10 min. 扩增的PCR 产物经纯化回收后与pMD-18T 载体连接,经蓝白斑筛选和菌落PCR验证后,挑取阳性克隆送出测序. 进一步根据测序所得的目的序列,利用NCBI 网站的BLASTp 程序进行同源序列比对,同时参考已报道的HMGCR 序列分析结果,利用NCBI 上Conserved Domain 程序进行蛋白质序列结构域预测.
1.4 重组表达质粒pRHRkHMGCR 的构 建用BamH Ⅰ和EcoR Ⅴ对连接有基因RkHMGCR的pMD-18T 载体和表达载体pRH2034 进行双酶切,电泳回收目的片段后用T4 连接酶连接,并将连接产物转化至大肠杆菌DH5α 中. 通过菌落PCR 和提取质粒进行双酶切鉴定来筛选阳性克隆,然后进一步将重组质粒送出进行测序验证,所构建的重组表达质粒命名为pRHRkHMGCR.
1.5 重 组 质 粒pRHRkHMGCR 的 转 化 与 筛 选将重组质粒pRHRkHMGCR 通过电击转化法[20]转入YM25235 中,通过含150 μg/mL 潮霉素B 的YPD固体培养基筛选得到抗性转化子. 利用酵母基因组提取试剂盒提取抗性转化子的基因组DNA,以此为模板通过PCR 进行阳性克隆验证获得HMGCR基因转化成功的转化子. 将PCR 验证正确的阳性克隆于50 mL YPD 液体培养基中培养至192 h,离心收集菌体,冷冻干燥后磨成粉. 取0.4 g 干菌体使用丙酮进行多次提取后,合并提取液. 然后参考文献[21]的方法,利用紫外分光光度计在450 nm 处测定吸光度并计算总类胡萝卜素含量. 经多次筛选后得到高产类胡萝卜素的转化子,命名为YM25235/pRHRkHMGCR.
1.6 总类胡萝卜素及其组分质量比变化分析以YM25235 菌株为对照,按上述方法分别提取YM25235 菌株和转基因菌株YM25235/pRHRkHMGCR 的总类胡萝卜素,分析YM25235/pRHRkHMGCR 菌株中总类胡萝卜素的质量比变化情况.进一步通过高效液相色谱法(HPLC)对总类胡萝卜素的4 种主要成分的质量比变化进行检测分析,HPLC 分析条件参照魏娜等[22]的方法,液相色谱柱为Agilent ZORBAX SB-C18(ϕ4.6 mm×250 mm,5 μm).


1.8 脂肪酸含量的测定分析参考文献[23]检测YM25235 和YM25235/pRHRkHMGCR 菌株中脂肪酸的含量变化. 称取上述干菌粉0.1 g,加入2.5 mL 10% KOH 甲醇溶液和2.5 mL 0.6 mg/mL C17 内标物提取脂肪酸,并与70 ℃下皂化4.5 h. 然后用浓盐酸将样品的pH 调至2.0,加入4 mL 14%三氟化硼乙醚,继续在70 ℃水浴1.5 h,使脂肪酸甲酯化.最后用正己烷萃取脂肪酸甲酯,并用气相色谱-质谱(GC-MS)进行分析.
1.9 类胡萝卜素合成和油脂代谢相关基因的转录水平分析取发酵培养96 h 的酵母细胞,提取总RNA 并反转录合成cDNA,以YM25235 菌株样品作为对照,通过实时荧光定量PCR 方法检测RkHMGCR基因过表达对类胡萝卜素合成和油脂代谢相关基因转录水平的变化. 以小亚基rRNA(SSU rRNA)基因作为内参,通过 2-△△CT法[24]分析不同基因的相对转录水平. 实时荧光定量PCR分析所用引物如表1 所示.

表1 YM25235 菌株中不同基因的mRNA 转录水平分析所用的引物Tab. 1 Primers used for the analysis of mRNA levels in YM25235 strain
2 结果与分析
2.1 RkHMGCR 基 因 的 克 隆以 红 冬 孢 酵 母YM25235 的 cDNA 为模板,通过PCR 扩增,获得一个大小约为4 000 bp 的片段(图1),将其命名为RkHMGCR. 回收获得该片段,进一步将其连接到PMD-18T 载体上并送出测序. 测序结果显示RkHMGCR基因片段长为3 981 bp,编码1 326 个氨基酸,预测其编码的蛋白质相对分子质量(Mr)为145.68 ku.
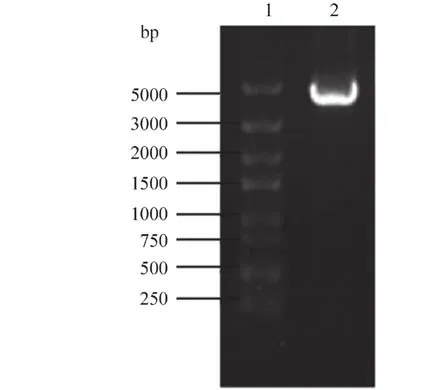
图1 RkHMGCR 基因的PCR 扩增Fig. 1 PCR Amplification of the gene RkHMGCR
2.2 序列的分析相似性搜索表明,RkHMGCR编码的氨基酸序列(GenBank 登录号:MW448479)与酵母来源的HMGCR 的氨基酸序列相似性最大,其中与圆红冬孢酵母(Rhodosporidium toruloides)NP11 来源 RtHMGCR(GenBank 登录号:XP_01627-0872)、红法夫酵母(Xanthophyllomyces dendrorhous)XdHMGCR 酶(GenBank 登录号:CED85502)和酿酒酵母(Saccharomyces cerevisiae)S288C 的ScHMGCR 酶(GeneBank 登录号:NP_013636)的相似性分别为81.94%、35.63%和23.61%. 序列比对分析结果还表明,所编码的氨基酸序列和已知的HMGCR 酶类似,具有特异性的4 个氨基酸保守区[14,25]:2 个底物结合位点TTEGALVA(氨基酸位点为970~977)和ENVVGYMPLP(氨基酸位点为941~950),2 个NADP(H)结合位点DAMGMNMIS(氨基酸位点为1 065~1 073)和GTVGGGT(氨基酸位点1 214~1 220),以及4 个催化活性中心关键的氨基酸残基 Glu、Lys、Asp、His(其氨基酸位点分别为 972、1 105、1 181、1 279)(图2). 此外,氨基酸序列比对分析也显示,除了具有4 个结合位点和关键氨基酸残基的氨基酸序列保守性高外,其余氨基酸序列在不同来源HMGCS 中变化较大(N 端序列长,结果未提供),与已报道分析结果[13-14]一致. 这些结果表明所获得的cDNA 序列是一个新的潜在HMGCR基因编码序列.

图2 RkHMGCR 与同源RkHMGCRs 氨基酸序列比对Fig. 2 Alignment of amino acid sequence of RkHMGCR and homologous HMGCRs
2.3 重组质粒pRHRkHMGCR 的构建首 先通过双酶切连接将RkHMGCR从PMD18-T 切下并插入到表达载体pRH2034 的BamH Ⅰ和EcoR Ⅴ 位点之间构建重组质粒pRHRkHMGCR(图3(a)). 然后对其重组质粒进行双酶切验证分析,结果如图3(b)所示,结果表明重组质粒pRHRkHMGCR酶切产生4 kb 和10.7 kb 两条带(图 3(b) 第 4 泳道),这两个条带分别与目的基因RkHMGCR扩增片段(图 3(b) 第 5 泳道)和空载体 pRH2034 双酶切后(图3(b) 第 3 泳道)的大小一致. 同时,测序结果也表明所获得片段与目的序列一致,证明重组质粒构建成功.
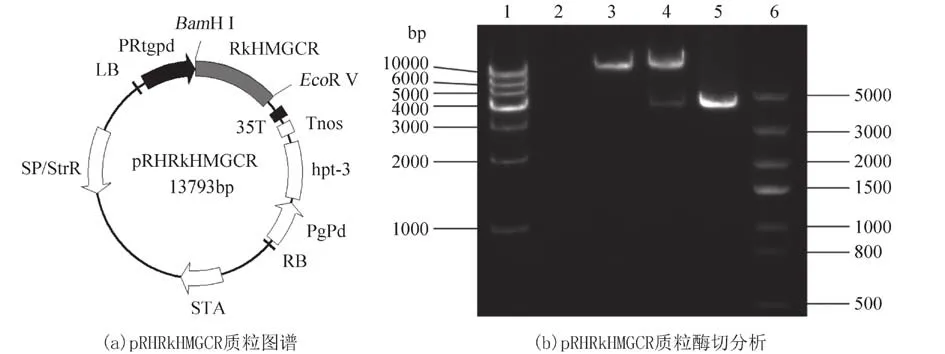
图3 重组表达质粒pRHRkHMGCR 的构建Fig. 3 Construction of recombination plasmid pRHRkHMGCR
2.4 过表达RkHMGCR 基因对YM25235 菌株总类胡萝卜素和各组分含量的影响总类胡萝卜素含量分析结果表明,过表达菌株YM25235/pRHRkHMGCR 中的总类胡萝卜素质量比为8.12 mg/g,相较于对照菌株YM25235(5.71 mg/g)提高了42.21%(表2). 进一步通过HPLC 分析总类胡萝卜素中4种不同组分含量变化,结果显示,过表达菌株YM25235/pRHRkHMGCR 中圆酵母素、红酵母红素、β-胡萝卜素的均显著提高,但γ-胡萝卜素含量反而下降. 其中β-胡萝卜素含量提高最为显著,达4.58 mg/g DCW,占总类胡萝卜素含量的56.40%,相较于对照(48.86%)β-胡萝卜素含量在总类胡萝卜素含量中明显提高. 这些结果表明,过表达RkHMGCR基因能显著提高YM25235 菌株中总类胡萝卜素及β-胡萝卜素含量.
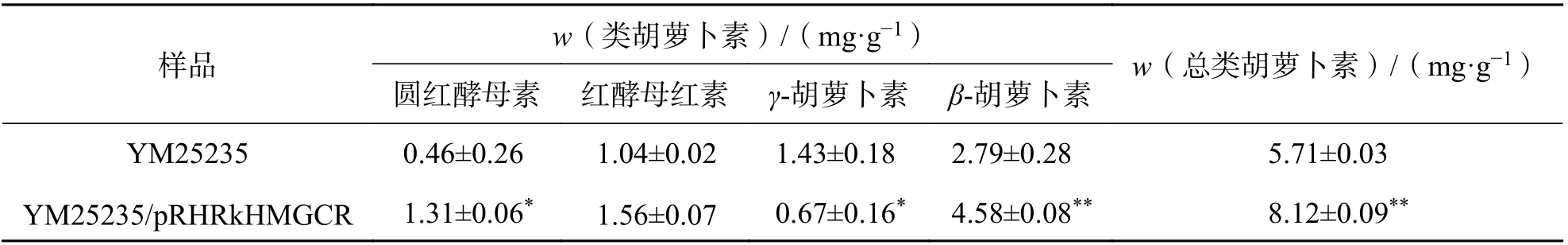
表2 过表达RkHMGCR 基因对YM25235 菌株中类总胡萝卜素质量比及其组分质量比的影响Tab. 2 Effect of RkHMGCR overexpression on the content of total carotenoid and its compositions in YM25235
2.5 过表达RkHMGCR 基因对YM25235 菌株油脂积累的影响类胡萝卜素合成与油脂合成都是以乙酰CoA 作为共同前体. 在本研究中,过表达RkHMGCR基因提高了YM25235 中类胡萝卜素的质量比,在此基础上,我们进一步测定对照菌株YM25235 和过表达菌株YM25235/pRHRkHMGCR的油脂质量比. 结果如表3 所示,过表达菌株YM25235/pRHRkHMGCR 中油脂质量比约为3.44%,较对照菌株YM25235(4.84% DCW)降低了28.93%.表明过表达RkHMGCR基因会减少YM25235 中油脂的积累.

表3 RkHMGCR 基因过表达对YM25235 菌株油脂质量分数的影响Tab. 3 Effect of RkHMGCR overexpression on the lipid content in YM25235
2.6 过表达RkHMGCR 基因对YM25235 菌株脂肪酸质量分数的影响为探究过表达RkHMGCR基因对YM25235 中脂肪酸含量的影响,我们提取对照菌株YM25235 和过表达菌株YM25235/pRHRkHMGCR 的总脂肪酸并进行GC-MS 分析. 结果如表4 所示,过表达菌株YM25235/pRHRkHMGCR中总脂肪酸质量分数下降约20.31%,其中棕榈酸(C16∶0)、硬脂酸(C18∶0)和亚油酸(oleic acid,OA,C18∶1)的质量分数略有下降,而多不饱和脂肪酸亚油酸(linoleic acid,LA,C18∶2)和α-亚麻酸(α-linolenic acid,ALA,C18∶3)的含量却有所增加.该结果表明,RkHMGCR基因过表达促进YM25235中脂肪酸的降解,可能提供了更多的乙酰CoA 进入类胡萝卜素合成途径,促进类胡萝卜素合成,同时上述油脂累积的降低也证明了这一观点.

表4 RkHMGCR 基因过表达对YM25235 菌株脂肪酸组分质量分数的影响Tab. 4 Effect of RkHMGCR overexpression on the content of fatty acid compositions in YM25235
2.7 过表达RkHMGCR 基因对YM25235 菌株类胡萝卜素合成和油脂代谢相关基因转录水平的影响为进一步探究过表达RkHMGCR基因促进YM25235 类胡萝卜素合成的调节机制,我们分析了类胡萝卜素合成和油脂代谢相关基因转录水平变化. 结果如图4 所示,过表达RkHMGCR基因能促进MVA 途径中基因RkAcat2、RkHMGCS、自身RkHMGCR转录水平的明显提高,分别为对照的1.76、1.58 和4.14 倍,而类胡萝卜素合成途径中基因RkCrtYB、RkCrtI的转录水平略有提高,但不显著. 此外,与油脂合成相关基因RkFAS1和RkACCS转录水平分别下降了59.31%和40.23%,而与脂肪酸β-氧化相关基因RkACOX2转录水平则也有显著提高,达2.18 倍. 这些结果与类胡萝卜素的合成水平和油脂含量的积累趋势一致,只是不同基因转录水平的变化有所差异.
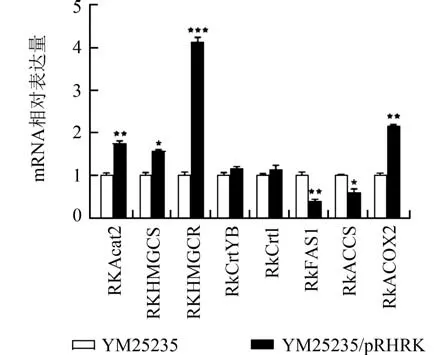
图4 RkHMGCR 基因过表达对YM25235 菌株中类胡萝卜素合成和油脂代谢相关基因转录水平的影响Fig. 4 Effect of RkHMGCR overexpression on the transcription levels of genes involved with carotenoid biosynthesis and lipid metabolism
3 讨论
HMGCR 广泛存在真核生物、原核生物和古细菌中,是一种高度保守的膜结合酶[9]. 氨基酸序列相似性搜索结果显示,红冬孢酵母RkHMGCR 与酵母来源的HMGCR 具有最大的同源性. 氨基酸序列分析结果也显示,红冬孢酵母RkHMGCR 同样具有HMGCR 保守的2 个底物结合位点ENVVGYMPLP 和TTEGALVA、2 个NADP(H)结合位点DAMGMNMIS 和GTVGGGT,以及4 个催化活性中心关键的氨基酸残基 Glu、Lys、Asp、His,而且序列比对分析结果还显示,所分析的4 种HMGCR的C 端氨基酸序列同源性虽然高于N 端,但是总体同源性均很低,这些均与之前的研究结果一致[13-14]. 这些结果表明,我们获得的RkHMGCR基因是一个新的潜在的HMGCR基因.
由于HMGCR 在MVA 途径以及包括类胡萝卜素等异戊二烯衍生物合成中的重要调节作用,可以推测出提高HMGCR 的表达水平可显著提高类胡萝卜素等异戊二烯衍生物的合成水平. 这在许多通过代谢工程手段将HMGCR基因过表达提高宿主细胞中类胡萝卜素的合成的研究中获得证实,比如,Yan 等[8]通过产β-胡萝卜素的重组酿酒酵母工程菌株中过表达HMGCR基因,β-胡萝卜素产量提高了35.1%,如果同时抑制麦角固醇合成则提高了106.8%. 还有一些研究将截短的外源HMGCR基因在不同重组酵母宿主中过表达,都能显著提高目的类胡萝卜素的产量[26-28]. 本研究将RkHMGCR基因转化回YM25235 菌株中进行过表达分析,与上述报道类似,RkHMGCR基因过表达显著提高了YM25235 菌株中类胡萝卜素的合成水平,相较于对照提高了42.21%,其合成相关基因的转录水平分析也证明了这一点. 相较于类似的研究[27-28],RkHMGCR基因过表达的YM25235 菌株类胡萝卜素产量的增加不是最高,这可能是培养条件和表达系统存在差异的原因,并且细胞内甲羟戊酸供应的瓶颈不仅仅是HMGCR 催化的反应,还涉及AcaT和HMGCS 的催化作用[29]. 然而,本研究结果证明了提高MVA 途径限速酶HMGCR 的表达水平可显著提高类胡萝卜素的产量.
红法夫酵母类胡萝卜素合成调节机制的研究表明,葡萄糖不足或饥饿条件下菌株中类胡萝卜素合成与氧化胁迫有关,还涉及脂代谢和糖代谢等生物学过程[30-31]. 乙酰CoA 是油脂(脂肪酸)和类胡萝卜素合成的共同前体,有研究表明,粘红酵母(Rhodotorula glutinis)在葡萄糖不足或饥饿条件下通过选择性降解棕榈酸和油酸,产生乙酰CoA 促进类胡萝卜素的合成,导致油脂累积减少[32-33]. 我们前期的研究也显示,葡萄糖饥饿条件下YM-25235 菌株中油脂累积水平明显下降(结果未发表),而过表达RkHMGCR基因脂肪酸含量也明显下降(表3 和表4),导致油脂累积下降更加明显与脂肪酸降解相关基因的转录水平显著增加也证明这一点. 而且,RkHMGCR基因过表达的YM25235菌株中类胡萝卜素合成增加的底物乙酰CoA 可能主要来自棕榈酸和硬脂酸的降解,而油酸含量下降可能是由于其进一步脱饱和形成亚油酸和α-亚麻酸所致,多不饱和脂肪增加的具体原因还有待于进一步研究.
由于类胡萝卜素良好的生物活性和生理功能,近年来被广泛应用在食品、医药、营养保健等行业,促进了人类对其需求. 目前,商业化的类胡萝卜素来源主要通过化学合成获得,少量从植物提取和微生物发酵生产的天然类胡萝卜素,虽然具有类似的分子结构,但天然类胡萝卜素更有利于健康[1]. 通过传统微生物发酵技术生产类胡萝卜素显示出巨大潜力,成本低、生产过程易于处理、产品安全而且环保[34]. 但是,目前由于成本效益、产量和分离提取等方面的限制,工业化规模发酵生产方面仍缺乏相应的策略[35]. 近年来,结合经典遗传学和现代分子生物学方法以及发酵工艺技术,优化菌株原有的代谢途径和调节网络或者组装异源代谢途径使微生物高效益、低成本生产类胡萝卜素的代谢工程提供了一种有希望的替代途径[15]. 因此,本研究为进一步筛选类胡萝卜素高产菌株和工艺化生产类胡萝卜素的研究与应用打下基础,也为利用产油红酵母进行相关的代谢工程研究提供参考. 目前,这方面的研究鲜有报道.
