会诊组织在免疫组化检测中的质量分析
2021-10-12申敬伟董芳莉杨海军
申敬伟,董芳莉,马 卓,杨海军
病理会诊是病理科的常规工作之一,随着我国各地区医院医疗技术操作规范细则的实施,临床病理工作中会诊病理越来越多,主要包括疑难性病理会诊、依懒性病理会诊和确认性病理会诊[1]。免疫组化技术是会诊工作的重要手段,其有利于提高病理会诊的质量,减少病理会诊带来的医疗风险。然而,送检的会诊蜡块或切片常常组织处理欠佳,这给病理会诊工作增加了一定难度,同时严重影响了免疫组化检测结果的稳定性和准确性。如何把控会诊组织在免疫组化检测中的染色质量,本文结合我院会诊组织免疫组化检测情况进行分析,总结如下。
1 材料与方法
1.1 材料选取2019年1月~2019年12月安阳市肿瘤医院接收的行免疫组化检测的会诊组织706例。其中会诊蜡块601例,处理不佳的101例;会诊白片105例,质量不合格的10例。通过制定会诊组织在免疫组化检测中的规范化流程,对外院会诊蜡块、切片和白片进行改善。
1.2 仪器Roche Ventana XT全自动免疫组化仪和Leica Bond Max全自动免疫组化仪。
1.3 试剂ER、PR、HER-2和Ki-67为Roche即用型一抗,其余常规试剂均为迈新即用型一抗,二抗检测系统为Roche和Leica两家公司的配套封闭试剂。
1.4 方法不同抗体设立相应的阳性对照组织,3 μm厚连续切片,65 ℃烤片1 h后进行分片,按Roche Ventana XT和Leica Bond Max免疫组化自动化染色平台的SOP操作。
2 结果
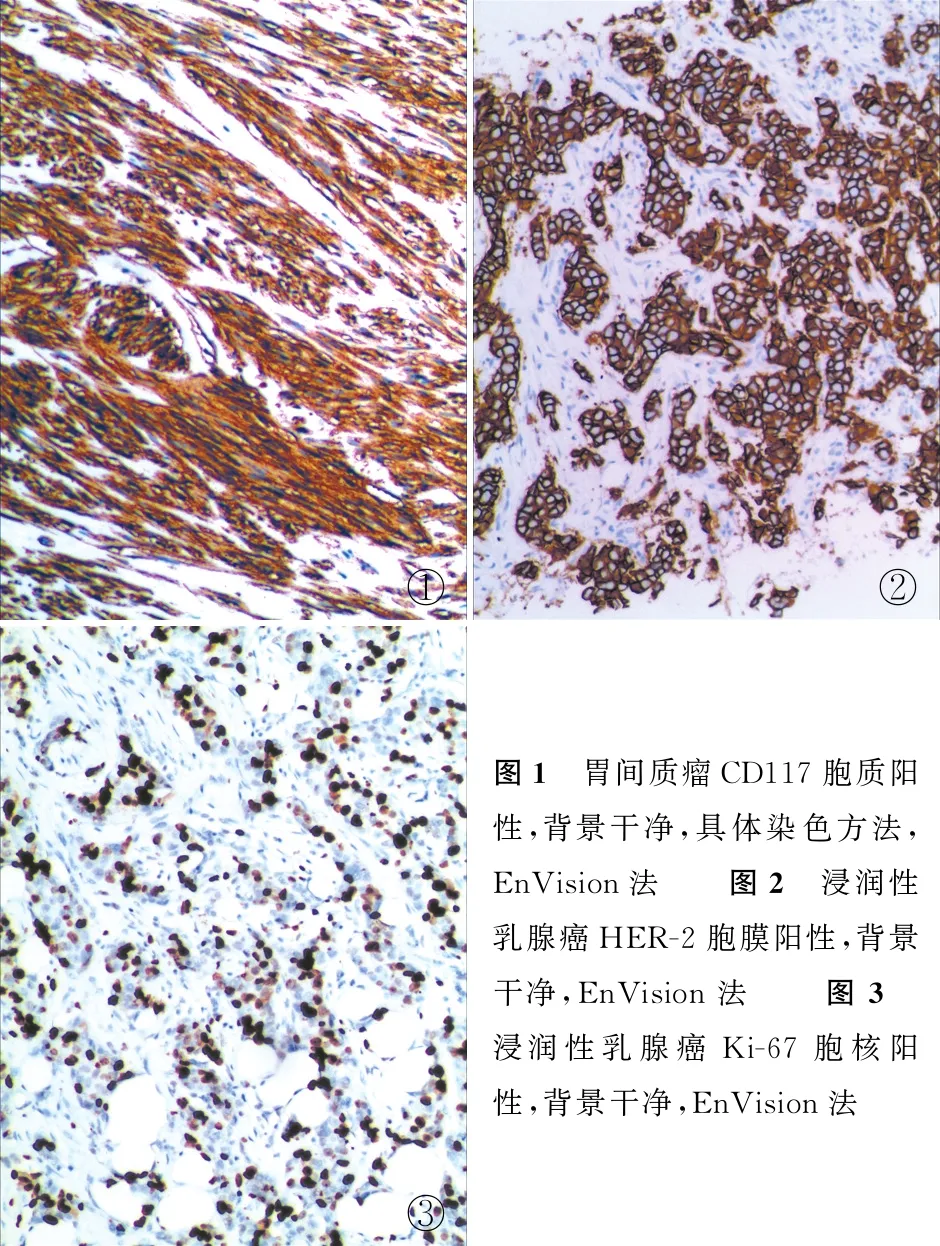
按照本实验室会诊组织在免疫组化检测中的规范化流程和操作方案,会诊蜡块切片完整,厚薄均匀;会诊白片更换黏附载玻片,添加阳性对照。免疫组化染色定位准确,背景干净,核复染适度,阳性对照正确(图1~3),质量控制分析4例染色合格,其余均为优良,优良率96.4%。
3 讨论
免疫组化是用已知抗体与抗原发生特异性结合,并通过化学反应使标记在与抗原结合后的特异性抗体上的显色剂显色,以确定组织细胞内抗原的存在,对其进行定位、定性及半定量分析。免疫组化是一个多步骤、多条件的复杂过程,其规范化和标准化涉及整个免疫组化检测的全流程,包括组织前处理、检测步骤、结果判读、质量控制等各个环节。随着病理会诊免疫组化检测数量的增多,本实验室制定了一套会诊组织从蜡块或白片质量评估开始,切片、烤片、抗原修复、抗体浓度、检测系统、阳性对照等全方面的规范化操作方案,推进免疫组化技术在会诊组织中的规范化和标准化检测,提高检测的准确性,具体实施措施如下。
3.1 评估会诊蜡块会诊蜡块多来自基层单位,组织处理欠佳的情况较为普遍。通常表现为组织内陷、硬脆、韧等。组织内陷主要是组织固定不佳,导致脱水剂难以进入组织,大量水分残留在组织内。对于这些会诊蜡块本科室采用黏片法[2],即把载玻片盒子里的隔离纸撕成和蜡块一样的大小,沾冰水贴在已修好片的蜡块上再切,切片就黏在纸片上,直接拿出纸片反向放入漂片机内,同时严格控制水温不宜太高。在病理会诊工作中,蜡块硬,跳刀,颤痕严重,蜡块易崩裂;蜡块脆,组织易破碎,出现粉末状等,这些情况常是由于固定不足和脱水不良引起,对于这类会诊蜡块在切片时将厚度调薄一点,蜡块不可太冰,可以在冰水里浸泡1~2 min,或者边切边用嘴向蜡片吹气,使蜡块切面保持湿润,利于制片。越来越多的研究表明,不标准的组织固定是导致免疫组化结果不准确的主要因素,常导致不同的染色结果[3]。固定的意义是保存组织或细胞的抗原性,防止抗原丢失或弥散,因此标本应尽可能保持新鲜并及时进行固定。常用的固定液为10%中性福尔马林缓冲液(pH 7.2~7.4),组织离体后尽可能在30~60 min内固定。延迟固定可引起蛋白质降解,导致背景非特异性着色增加,减弱免疫组化的染色强度。固定时间6~48 h[4],对于活检小组织固定时间亦不应少于6 h。标准化的组织脱水、透明、浸蜡流程及试剂更换程序是获得优质免疫组化制片的前提,脱水、透明等过程应在室温下进行,尽量减少组织抗原的损失。组织块大小控制在2 cm×1.5 cm×0.3 cm为宜。浸蜡或包埋的石蜡应控制在65 ℃或65 ℃以下。组织处理的任何过程中,标本干涸组织形态和抗原都会受到损害,组织处理应严格按照科室相关SOP文件的要求进行。
3.2 评估会诊白片外院会诊白片部分存在玻片黏附质量差或非黏附性玻片,组织固定处理不佳,切面有气泡、皱褶等质量问题,易出现脱片和非特异性染色。如果是非黏附性玻片,直接退回玻片,换用黏附性玻片或重新调取蜡块重新制片。目前本实验室有Roche Ventana XT和Leica Bond Max两种免疫组化自动化染色平台,Roche Ventana XT采用喷射式清洗技术均匀而彻底地清洗,降低背景染色,同时也是造成染色会诊白片脱片率偏高的主要原因;Leica Bond Max最大特点是试剂侧面滴加,最大限度减少对组织的伤害,脱片率低[5]。因此,为减少脱片率,本实验室偏向应用会诊组织在Leica Bond Max上检测。会诊白片多为非亲水性,质量参差不一,本实验室ER和HER-2试剂采用Roche即用型,Roche Ventana XT需要玻片为亲水性,因此会诊白片在检测前需在脱脂牛奶中浸泡30 min,以改善切片的亲水性,保证试剂均一地分布,避免假阴性的产生和“阶梯效应”。同时,免疫组化检测应尽量使用新鲜切片(1周以内的切片视为新鲜切片),切片长久放置后免疫稳定性的丢失会导致染色强度降低、阳性细胞数量减少。切片厚度为3~5 μm,推荐烤片温度为63~65 ℃,1~2 h,忌高温长时间烤片。
3.3 建立阳性对照体系设置阳性对照体系是免疫组化染色质量控制的重要措施之一[6]。阳性对照应按照国内检测指南/专家共识设置,对于与肿瘤靶向药物治疗相关的检测项目必须设置阳性对照。阳性对照是验证操作步骤是否正确及染色结果是否准确的关键,根据对照染色结果可以判断操作的准确性和试剂的有效性,本实验室使用已被证明含有靶抗原成分的组织作为外部阳性对照,如ER、PR阳性对照选用ER、PR阳性的乳腺癌、子宫颈癌或子宫内膜癌标本,HER-2阳性对照选用HER-2 2+及3+的乳腺癌标本,同时外部阳性对照组织选择低表达的检测组织,低表达的外部阳性对照可以明确由于检测体系的微弱变化而导致的免疫组化染色不稳定,强阳性对照可能导致弱阳性组织出现假阴性结果。因此,对于外院会诊蜡块组织,在切片的同时加上阳性对照;对于外院会诊白片,在黏附载玻片的空白区再加上阳性对照组织。为确保抗原活性,阳性对照片现用现切,且不可长时间保存。本实验室一般备1周阳性对照的切片量,-20 ℃保存备用。
3.4 仪器设备的质控严格遵照全自动免疫组化染色机的操作流程,制定每种仪器的保养计划,包括日保养、周保养和月保养;记录每种试剂的克隆号、批号、有效期;更换抗体后,用阳性和阴性组织进行有效性验证。建立每种抗体的SOP文件严格执行,并及时更新。最少的背景以及标记目标抗体的强表达是理想的结合[7]。
3.5 参加室间质控积极参与国际及国内免疫组化染色质量评估,动态评价本实验室免疫组化染色质量,不断改正不足。本科室2014年参加国家卫建委病理质控中心(PQCC)的免疫组化室间质控,2013年开始每年参加河南省病理质控中心组织的免疫组化室间质评,均顺利通过。
总之,病理会诊已成为病理科的日常工作,免疫组化技术已成为病理会诊中重要的检测手段,因此需要建立病理会诊在免疫组化检测中的规范化和标准化流程,以确保病理会诊工作高效优质完成。
