低氧刺激通过HIF-1α直接调节Myocardin表达促进骨髓间充质干细胞向心肌样细胞分化
2021-10-12哈艳平刘晓晓邵钟铭伍彩霞郭峻莉申志华
哈艳平,刘晓晓,邵钟铭,邹 园,伍彩霞,郭峻莉,3,申志华,揭 伟,,3
骨髓间充质干细胞(bone marrow mesenchymal stem cells, BMSC)是属于多潜能分化干细胞,在再生医学研究领域被广泛应用[1-2]。尽管BMSC体外培养过程中可被诱导多向分化,但体内实验发现其定向分化效果不佳。BMSC移植参与组织损伤获益的机制可能与其旁分泌有关[3]。BMSC所处的骨髓微环境为低氧状态。低氧可以有效的刺激移植的BMSC表现出适应性反应,参与靶组织的定向转运和归巢,从而提高组织损伤的干细胞治疗效果[4]。低氧诱导因子-1α(hypoxia-inducible factor-1α, HIF-1α)通过与低氧反应元件结合而调节下游靶基因的表达,是介导低氧反应的核心因子,在心肌损伤保护中发挥关键作用[5]。本课题组前期也证实低氧刺激可以通过上调ROCK信号促进BMSC的增殖和旁分泌[6]。心肌素(Myocardin)是心肌细胞和平滑肌细胞分化过程中的特异性转录共激活因子[7],也是维持心脏结构完整性,心肌细胞存活和心脏功能所必需的关键转录因子[8-9]。有研究显示低氧可以通过RhoA/Rho和ERK信号而诱导未成熟心肌细胞中Myocardin表达增加[10],但低氧刺激在干细胞生物学中的机制仍不明确。本实验旨在以c-Kit+BMSC为对象,分析低氧诱导BMSC向心肌细胞分化过程中对Myocardin表达的影响、作用及调节机制。
1 材料与方法
1.1 材料
1.1.1主要试剂 Sprague Dawley大鼠间充质干细胞专用培养基(广州赛业公司);胎牛血清(Gibco公司);Myocardin启动子过表达质粒(-1 243 bp~+217 bp)及阴性对照启动子质粒、突变型HIF-1α过表达慢病毒颗粒及阴性对照过表达病毒颗粒(广州复能公司);LIF因子(Prospec公司);Myocardin shRNA慢病毒(靶序列,GATGCATTTGCCTTT GAAGAT)及阴性对照病毒颗粒[11](上海吉凯公司);Myocardin抗体(Sigma公司);cTnT抗体(Cell signaling公司);Trizol(Ambion公司);逆转录试剂盒(TaKaRa公司);Real-time PCR试剂盒(GeneStar公司);PCR引物(上海生工公司);Lipofectamine 3000(ThermoFisher公司);Secrete-PairTM双荧光素酶活性检测试剂盒(广州复能公司)。
1.1.2实验动物 雄性SPF级Sprague Dawley大鼠5只,鼠龄6周,由广东医科大学动物实验中心提供,动物合格证号:SYXK(粤)2013-0002。大鼠饲养于25 ℃、湿度50%、12 h明暗交替光照环境中。实验过程对动物的处置符合动物伦理学规定。
1.2 方法
1.2.1Sprague Dawley大鼠c-Kit+BMSC的分选、鉴定及培养 参考本课题组前期方法进行[12]。应用密度梯度离心法从Sprague Dawley大鼠股骨全骨髓细胞中获得单个核细胞,采用免疫磁珠分选法获得c-Kit+细胞亚群,流式细胞术鉴定c-Kit+细胞的纯度。获得的细胞用大鼠BMSC专用培养基培养(含15%胎牛血清、100 U/mL LIF、100 U/mL青霉素、0.1 μg/mL链霉素)重悬,置于37 ℃、饱和湿度、5% CO2的培养箱中培养,第3代细胞用于成脂和成骨分化的功能验证,取第4~5代细胞用于相关实验。
1.2.2慢病毒感染c-Kit+BMSC 实验分为4组:过表达阴性对照慢病毒组(NC-lent)、突变型HIF-1α过表达慢病毒组(HIF-1α-ov-lent)、阴性对照干扰慢病毒组(NC-shRNA-lent)和Myocardin干扰慢病毒组(Myocardin-shRNA-lent)。c-Kit+BMSC以1×105个/孔接种于6孔板中,培养24 h贴壁后,细胞汇合度达70%时,0.5 mL polybrene(5.0 μg/mL)病毒工作液稀释各组病毒,以感染复数为100感染细胞,2 h后每孔加入含10%胎牛血清的培养液2 mL,继续培养24 h后换液,每3天换液1次。感染第3天荧光显微镜下观察增强型绿色荧光蛋白的表达以判断感染效率,至预定时间点收获细胞用于相关实验。
1.2.3低氧处理c-Kit+BMSC c-Kit+BMSC以1×105个/孔接种于6孔板中,培养24 h贴壁后将细胞置于三通低氧培养箱中(2%O2、5%CO2、93% N2)连续培养,每3天换液1次,至预定时间点收获细胞分析目的基因表达。以细胞置于常氧培养箱中培养作为对照(20%O2,5%CO2)。
1.2.4定量RT-PCR 用Trizol提取细胞总RNA,取1.0 μg总RNA反转录为cDNA,所得cDNA稀释5倍后进行定量PCR检测。PCR反应体系20.0 μL,含2×RealStar Green Fast Mixture with ROX 10.0 μL,引物(上游、下游)0.4 μL,cDNA 2.0 μL和DEPC水7.2 μL。PCR程序:95 ℃预变性2 min;95 ℃ 15 s,60 ℃ 20 s,72 ℃ 30 s,合计40个循环。以β-actin为内参照,分析HIF-1α、Myocardin、心肌分化标记Nkx2.5和cTnT的表达,结果以2-ΔΔCt表示。PCR使用的引物见表1。
1.2.5免疫荧光染色 细胞爬片经固定、PBS洗涤后滴加0.5%胎牛血清白蛋白,室温封闭30 min,滴加抗Myocardin和cTnT一抗(均按1 ∶100稀释),4 ℃孵育过夜,PBS冲洗3次,滴加TRITC-或FITC-标记荧光二抗(1 ∶100稀释,武汉三鹰公司),37 ℃避光孵育40 min,PBS冲洗3次,DAPI复染细胞核,37 ℃避光10 min,PBS洗涤后用抗荧光淬灭封片剂封固,激光共聚焦显微镜(Leica,TCS SP5Ⅱ)下观察并拍照。
1.2.6双荧光素酶报告基因法检测HIF-1α对Myocardin启动子活性的影响 实验分为3组:空白质粒对照组(空白启动子质粒PG04组)、HIF-1α过表达慢病毒和阴性对照启动子质粒共转染组(HIF-1α+NC-Promoter)、HIF-1α过表达慢病毒和Myocardin启动子过表达质粒共转染组(HIF-1α+Myocardin-Promoter)。将293T细胞(本实验室保存)接种于24孔板中,过夜孵育后按感染复数20感染HIF-1α过表达慢病毒颗粒,3天后再以Lipofectamine 3000转染启动子质粒(每孔2.5 μg),分别于转染质粒后24、48 h收集细胞培养液上清,采用Secrete-Pair双荧光素酶活性检测试剂盒分析Gluc与SEAP荧光素酶活性数据,以Gluc/SEAP比值代表Myocardin启动子活性。每组重复3孔。
1.3 统计学分析采用GraphPad 8.0软件进行统计学分析,数据以均数±标准差(Mean±SD)表示。组间比较采用非配对t检验,P<0.05为差异有统计学意义。
2 结果
2.1 过表达HIF-1α诱导Myocardin和心肌细胞谱系分化基因表达慢病毒颗粒以感染复数为100感染c-Kit+BMSC,3天后在荧光显微镜下观察到90%以上的细胞有GFP荧光信号(图1A)。感染7天后收获细胞,定量RT-PCR结果显示,与NC-lent组相比,HIF-1α-ov-lent组HIF-1α和Myocardin的mRNA水平均明显升高,同时心肌细胞谱系分化基因Nkx2.5和cTnT的mRNA表达也显著升高(P均<0.001,图1B)。
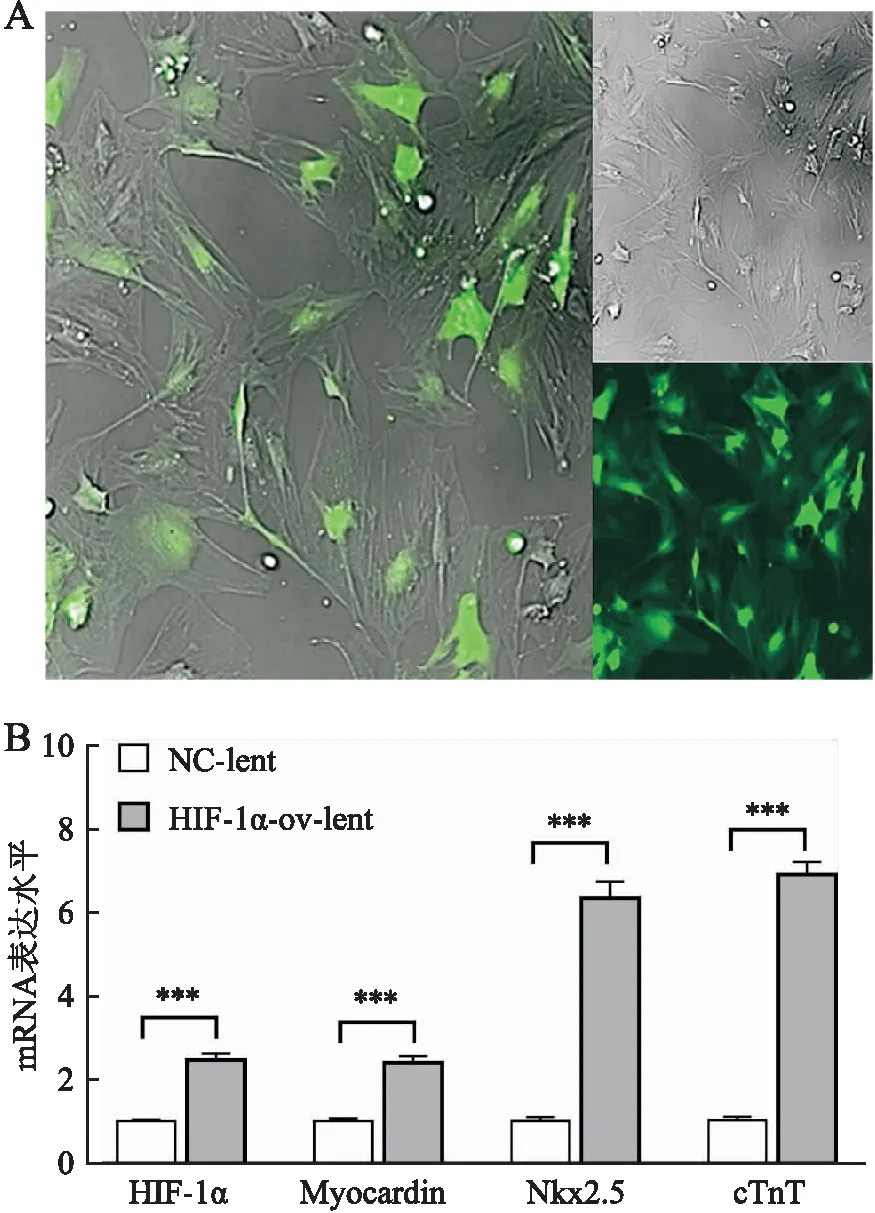
图1 过表达外源性HIF-1α诱导Myocardin和心肌谱系分化基因表达:A.c-Kit+ BMSC感染外源性HIF-1α过表达慢病毒效果,标尺=100 μm;B.c-Kit+BMSC感染外源性HIF-1α过表达慢病毒7天后定量RT-PCR检测HIF-1α、Myocardin和心肌谱系分化基因Nkx2.5和cTnT mRNA的表达,***P<0.001
2.2 物理性低氧刺激诱导HIF-1α和Myocardin表达物理低氧处理c-Kit+BMSC 0、1、7、14天后,采用定量RT-PCR检测HIF-1α和Myocardin mRNA,发现与常氧组相比,低氧组HIF-1α和Myocardin表达1天、7天均显著升高(P均<0.05),14天时虽然较常氧组水平升高但差异无统计学意义(图2A)。进一步应用免疫荧光检查7天组细胞中Myocardin蛋白的表达,发现BMSC中Myocardin明显表达并主要定位于胞核(图2B)。
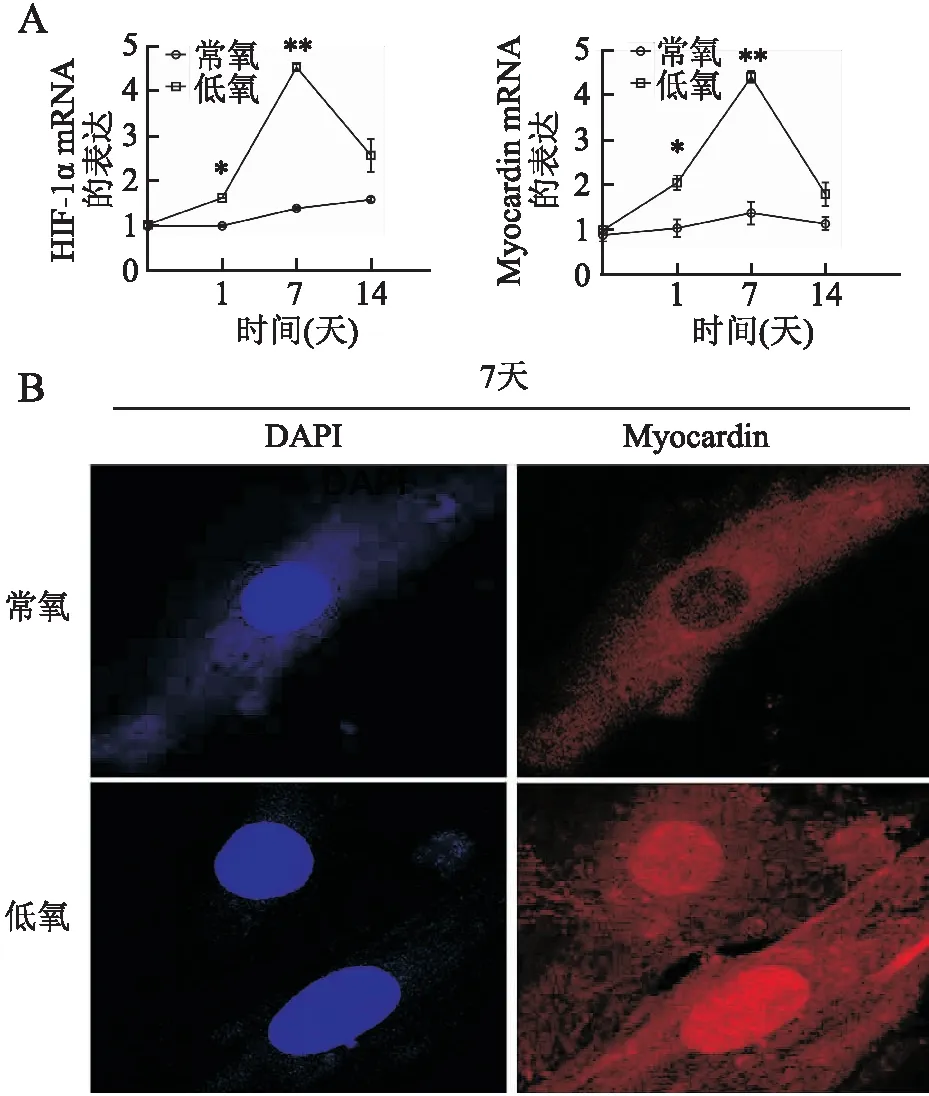
图2 物理性低氧诱导HIF-1α和Myocardin表达:A.定量RT-PCR检测HIF-1α和Myocardin mRNA的表达;与对应常氧组相比,*P<0.05,**P<0.01;B.免疫荧光染色检测低氧刺激7天后c-Kit+ BMSC中Myocardin蛋白的表达
2.3 体外低氧刺激有效诱导c-Kit+BMSC心肌细胞样分化c-Kit+BMSC经物理性低氧和常氧刺激后,以0天为对照,发现低氧组心肌细胞谱系分化标志基因Nkx2.5、cTnT在7天时均较常氧组显著升高(P均<0.01)。免疫荧光结果也证实低氧7天后c-Kit+BMSC明显表达cTnT蛋白,阳性信号定位于胞质(图3)。
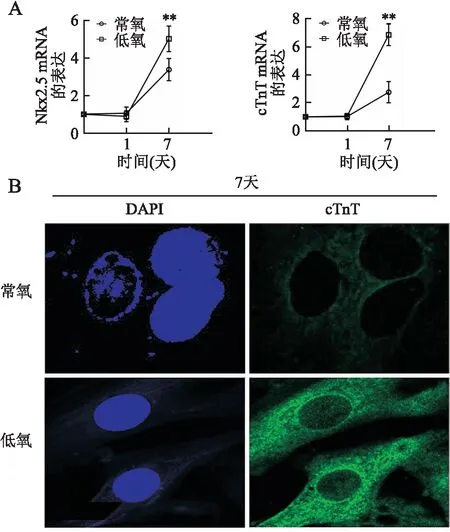
图3 物理性低氧刺激诱导c-Kit+ BMSC心肌细胞分化基因表达:定量RT-PCR检测心肌细胞分化相关基因Nkx2.5和cTnT mRNA的表达;与对应常氧组相比,**P<0.01;B.免疫荧光染色检测低氧刺激7天后c-Kit+ BMSC中cTnT蛋白的表达
2.4 干扰Myocardin后减弱低氧诱导的心肌细胞样分化c-Kit+BMSC以感染复数为100感染Myocardin-shRNA-lent,病毒感染细胞3天后再继续低氧刺激7天后发现,干扰慢病毒感染后能有效下调Myocardin水平(P<0.001),同时伴随心肌细胞谱系分化基因Nkx2.5(P<0.01)和cTnT(P<0.05)表达下调(图4)。
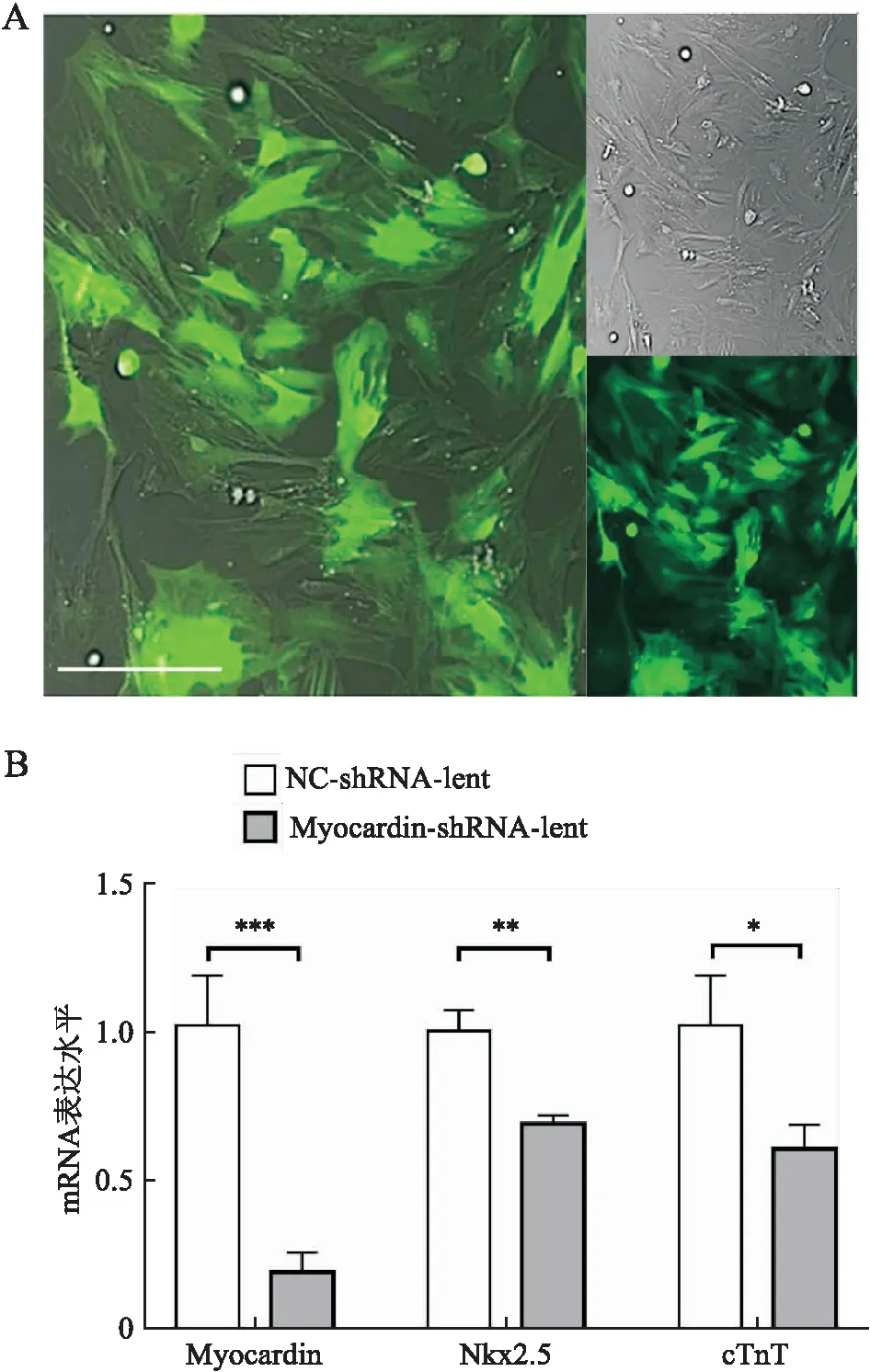
图4 干扰Myocardin后抑制低氧诱导的c-Kit+ BMSC心肌细胞分化基因表达:A.Myocardin特异性shRNA慢病毒感染c-Kit+ BMSC效果;B.定量RT-PCR检测Myocardin和心肌细胞分化相关基因Nkx2.5和cTnT mRNA的表达;*P<0.05,**P<0.01,***P<0.001
2.5 HIF-1α直接上调Myocardin启动子活性293T细胞转染各组质粒后,以常氧状态下PG04组为对照,24 h和48 h的HIF-1α+Myocardin-Promoter组荧光素酶比值较HIF-1α+NC-Promoter组均明显增高,倍数分别可达3.65±0.6及5.55±0.84(P均<0.01);48 h后的Myocardin启动子活性强于转染24 h组(P<0.05,图5)。
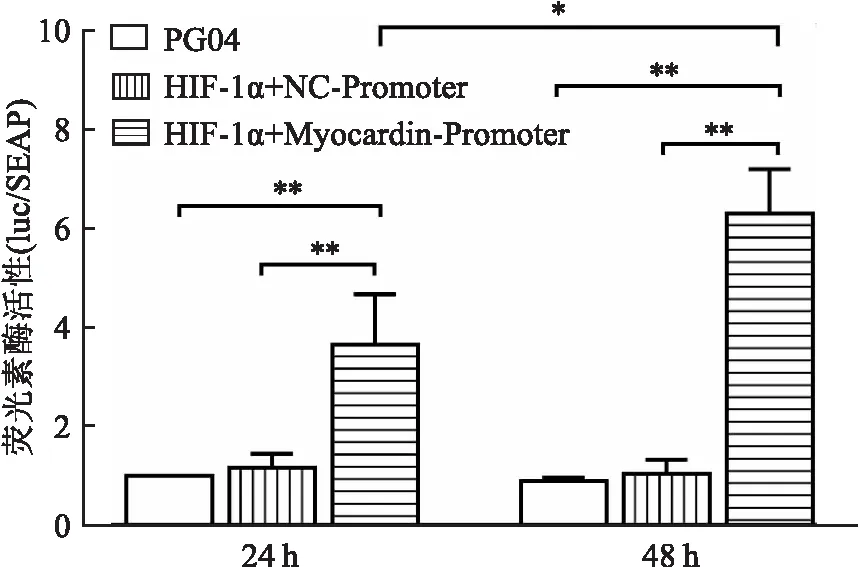
图5 双荧光素酶报道基因法检测HIF-1α对Myocardin启动子的激活效应:*P<0.05,**P<0.01
3 讨论
组织损伤后局部处于低氧微环境,如心肌梗死后梗死灶与正常心肌组织相比,其局部氧分压浓度显著下降。移植的BMSC由常氧状态下转为低氧状态下,其分化潜能的变化是本组分析的重点。为阐明低氧对BMSC心肌细胞谱系分化的影响及机制,本组从体外实验角度进行探索。
本实验在有效获得c-Kit+BMSC的基础上,发现HIF-1α过表达慢病毒感染c-Kit+BMSC时观察到明显的GFP信号伴随HIF-1α mRNA升高,提示慢病毒感染成功。在外源性HIF-1α表达升高的同时也检测到Myocardin表达升高,初步提示HIF-1α对Myocardin表达具有正向的表达调控作用。本实验感染的慢病毒携带HIF-1α基因为突变型,具体为HIF-1α蛋白编码区第402和564位脯氨酸(P)均突变为丙氨酸(A),该突变型HIF-1α可保证在常氧条件下的稳定性同时又保留其功能活性[13]。随后在物理性低氧条件下,本组同样观察到HIF-1α表达增加,在低氧处理1天内HIF-1α水平迅速上升,至7天时仍维持较高水平,进一步证实了HIF-1α是低氧刺激的反应因子。伴随HIF-1α表达上升,本组观察到Myocardin蛋白表达和细胞内定位情况。
本组和其他前期实验证实,BMSC在合适的诱导条件下可向心肌细胞谱系分化[14-16]。为证实低氧可刺激c-Kit+BMSC向心肌细胞谱系分化,本组选择了多个心肌细胞谱系分化标记基因进行检测。Nkx2.5为心肌细胞分化、发育早期转录因子,而肌钙蛋白cTnT为成熟心肌细胞的标志物,综合检测这些因子的表达为判断干细胞的心肌细胞谱系分化提供了参考[17-18]。本组证实,无论是过表达外源性HIF-1α还是物理性低氧刺激,均可有效诱导心肌细胞分化相关基因的表达。本组还注意到,在处理7天时低氧组较常氧组上述心肌细胞谱系分化标志基因均显著表达,但常氧组在一定程度上表达也上调,提示常氧条件下BMSC可能存在一定程度的自我分化可能,提示干细胞体外培养过程中需要常规添加抑制分化的因子如LIF。这种自我分化的原因很可能与高密度培养时干细胞旁分泌导致的某些信号活化有关[19]。免疫荧光染色进一步发现cTnT在低氧诱导7天组显著表达,提示了低氧刺激对BMSC心肌细胞样分化是有效的。
Myocardin在心肌细胞分化过程中起重要作用。本实验通过过表达HIF-1α和物理性低氧刺激均观察到Myocardin表达升高。有趣的是,当应用Myocardin特异性干扰慢病毒稳定感染c-Kit+BMSC后再次进行低氧刺激,心肌细胞谱系分化基因的表达得到一定程度的抑制。这一结果证实了Myocardin在BMSC向心肌细胞分化过程中的重要作用。有关Myocardin与心肌细胞分化的关系已有较多文献报道[7-8]。Myocardin主要与血清反应因子组成转录复合物,介导启动子上具有CArG序列的下游基因的转录激活,而具有CArG序列的基因主要是心肌细胞和平滑肌细胞分化相关基因[7,20]。本组注意到,干扰Myocardin后并不能完全抑制心肌细胞分化相关因子Nkx2.5和cTnT的表达,提示还存在其他调节机制的可能。事实上,Myocardin转录因子相关家族包括了Myocardin及其相关转录因子A(MRTF-A)和B(MRTF-B),该家族与心血管疾病的关系已有较多报道[21]。进一步阐明介导干细胞向心肌细胞分化的调节机制具有重要的生物学意义。
在乳鼠心肌细胞中,低氧刺激主要通过ERK信号和Angiotensin Ⅱ信号上调Myocardin表达[22]。本组及多个实验室证实,在低氧刺激的肺动脉平滑肌细胞中Myocardin表达下降[11,23],而在脑动脉平滑肌细胞中低氧刺激Mycoardin却表达上调[24]。上述结果提示低氧刺激对Myocardin表达的影响可能有细胞和环境的依赖性。本实验采用双荧光素酶报道基因活性实验,证实HIF-1α可直接上调Myocardin启动子活性。这一结果对低氧调节Myocardin的分子机制作了新的补充。
关于c-Kit是否可作为干细胞的标志物已有相关的报道[25]。c-Kit与干细胞因子(SCF)结合后,活化的SCF/c-Kit信号具有重要的生物学功能[26]。本实验分离的c-Kit+BMSC作为表型相对“单一”的细胞群,相对于整体表型不均一的BMSC而言可能在细胞生物学方面具有一定的优势,这在前期研究中已经进行了讨论[6]。
总之,本实验发现低氧刺激可有效诱导c-Kit+BMSC向心肌细胞谱系分化,其机制与低氧通过HIF-1α直接调控Myocardin表达上调有关。尽管BMSC移植治疗心肌梗死等缺血性心肌病当前还有很多问题需要解决[27],但本实验拓展了BMSC分化的相关理论基础,为后期基于BMSC移植治疗心肌损伤等缺血性心脏病提供了实验依据。
