非小细胞肺癌中EGFR、ALK、KRAS基因突变及PD-L1表达的关系
2021-10-12伍锦凤
李 洁,伍锦凤,叶 庆,汪 静
随着分子生物学的发展以及基因测序技术的革新,肺癌的治疗已经步入基因分子分型靶向精准治疗和免疫治疗时代。有学者提出非小细胞肺癌(non-small cell lung cancer, NSCLC)患者基因突变状态可以反映PD-L1表达水平,且与免疫检查点抑制剂(ICIs)疗效相关。已有报道指出,NSCLC组织中PD-L1的表达模式可以随着基因突变、癌细胞蛋白表达或肿瘤浸润免疫细胞数量的变化而发生改变[1-4]。另有研究表明,ALK融合的肺腺癌细胞可通过HIF-1a和(或)STAT3增加PD-L1的表达,为ALK融合型肺腺癌患者免疫治疗提供了理论依据[5]。此外,KRAS突变可经MEK/ERK信号通路上调PD-L1的表达,提示活化的KRAS在NSCLC免疫微环境中发挥重要作用[6]。PD-L1可影响肺癌免疫治疗中的多条关键信号通路,探讨PD-L1表达水平与肺癌常见驱动基因突变状态的相关性,将有助于深入了解影响免疫治疗的关键因素。本实验运用二代测序(next generation sequencing, NGS)技术检测128例NSCLC中与肺癌靶向治疗相关的20个基因,并分析其相应的临床病理学特征,同时结合免疫组化结果分析驱动基因突变状态与肿瘤细胞PD-L1表达的相关性,以期更加精准地指导肺癌患者制订靶向和免疫治疗方案。
1 材料与方法
1.1 标本来源收集中国科学技术大学附属第一医院2019年9月30日~2020年9月30日收治的肺癌手术切除及活检NSCLC组织标本128例。所有样本均经10%中性福尔马林固定,石蜡包埋后保存,HE染色评估肿瘤细胞含量均>20%。128例样本中手术大标本74例,支气管镜活检样本54例。其中男性71例,女性57例。年龄33~89岁,中位年龄63岁。根据WHO(2015)肺肿瘤病理分类:腺癌114例,鳞状细胞癌11例,其他类型3例。根据2017年国际抗癌联盟(UICC)第8版肺癌TNM分期标准:Ⅰ期8例,Ⅱ期23例,Ⅲ期35例,Ⅳ期62例。有淋巴结转移者84例,无淋巴结转移者44例。初诊患者112例,耐药患者16例。吸烟患者45例,非吸烟患者83例。
1.2 DNA提取、文库构建及测序使用FFPE核酸提取试剂盒(BGI)提取石蜡组织样本DNA,主要步骤包括脱蜡、消化、吸附、洗脱等;使用EGFR/KRAS/ALK基因突变联合检测试剂盒(联合探针锚定聚合测序法,BGI)进行靶向扩增与文库扩增两轮PCR,构建DNA文库;使用MGISEQ-2000测序仪对构建的DNA文库进行测序实验,并使用“非小细胞肺癌突变基因分析软件”(V1,华大生物科技)进行数据分析。
1.3 免疫组化使用Dako 22C3抗体和罗氏免疫组化全自动处理系统进行PD-L1免疫组化染色,由2名经过系统培训的病理科高年资医师对染色结果进行评估和复核。每张切片随机抽取10个高倍视野(200×),PD-L1表达主要位于细胞膜,对镜下呈现部分或全部胞膜阳性细胞百分比进行计数评分(TPS),TPS≥1%判定为阳性。
1.4 统计学方法采用SPSS 16.0软件进行统计学分析,计数资料使用例数或率(%)表示,PD-L1蛋白表达及EGFR、KRAS、ALK基因突变状态与肺腺癌临床病理特征采用χ2检验,并进行Pearson相关分析,以P<0.05为差异有统计学意义。
2 结果
2.1 EGFR、ALK、KRAS基因突变状态与NSCLC临床病理特征的关系在NSCLC中,EGFR基因突变阳性率为55.47%(71/128),在女性、腺癌患者中的突变率较高(P<0.05),无吸烟史患者突变率高于有吸烟史患者(P=0.065);ALK基因突变阳性率为4.69%(6/128),均为EML4-ALK融合类型,ALK融合发生的突变率在女性患者中具有高于男性患者的趋势(P=0.05),突变阳性患者更易发生胸膜转移(P=0.031);KRAS基因突变阳性率为8.59%(11/128),EGFR、ALK、KRAS基因突变状态与患者年龄、TNM分期、淋巴结转移均无明显相关性(P>0.05,表1)。

表1 EGFR、ALK、KRAS突变与NSCLC临床病理特征的关系
2.2 PD-L1表达与NSCLC临床病理特征的关系PD-L1在肺癌细胞中呈细胞膜染色,染色强度分为阴性、弱阳性、强阳性(图1)。TPS=0占30.47%(39/128),TPS 1%~49%占41.41%(53/128),TPS≥50%占28.12%(36/128)。男性(P=0.073)、非吸烟患者(P=0.022)中PD-L1≥1%水平相对较高;其中肺腺癌(P=0.007)、Ⅲ+Ⅳ期患者PD-L1 TPS 1%~49%水平相对较高(P=0.022)。PD-L1表达与患者年龄、胸膜侵犯、淋巴结转移无相关性(P>0.05,表2)。

图1 A.PD-L1阴性肺癌石蜡组织HE染色;B.PD-L1阴性,EnVision法;C.PD-L1弱阳性肺癌石蜡组织HE染色;D.PD-L1弱阳性,EnVision法;E.PD-L1强阳性肺癌石蜡组织HE染色;F.PD-L1强阳性,EnVision法
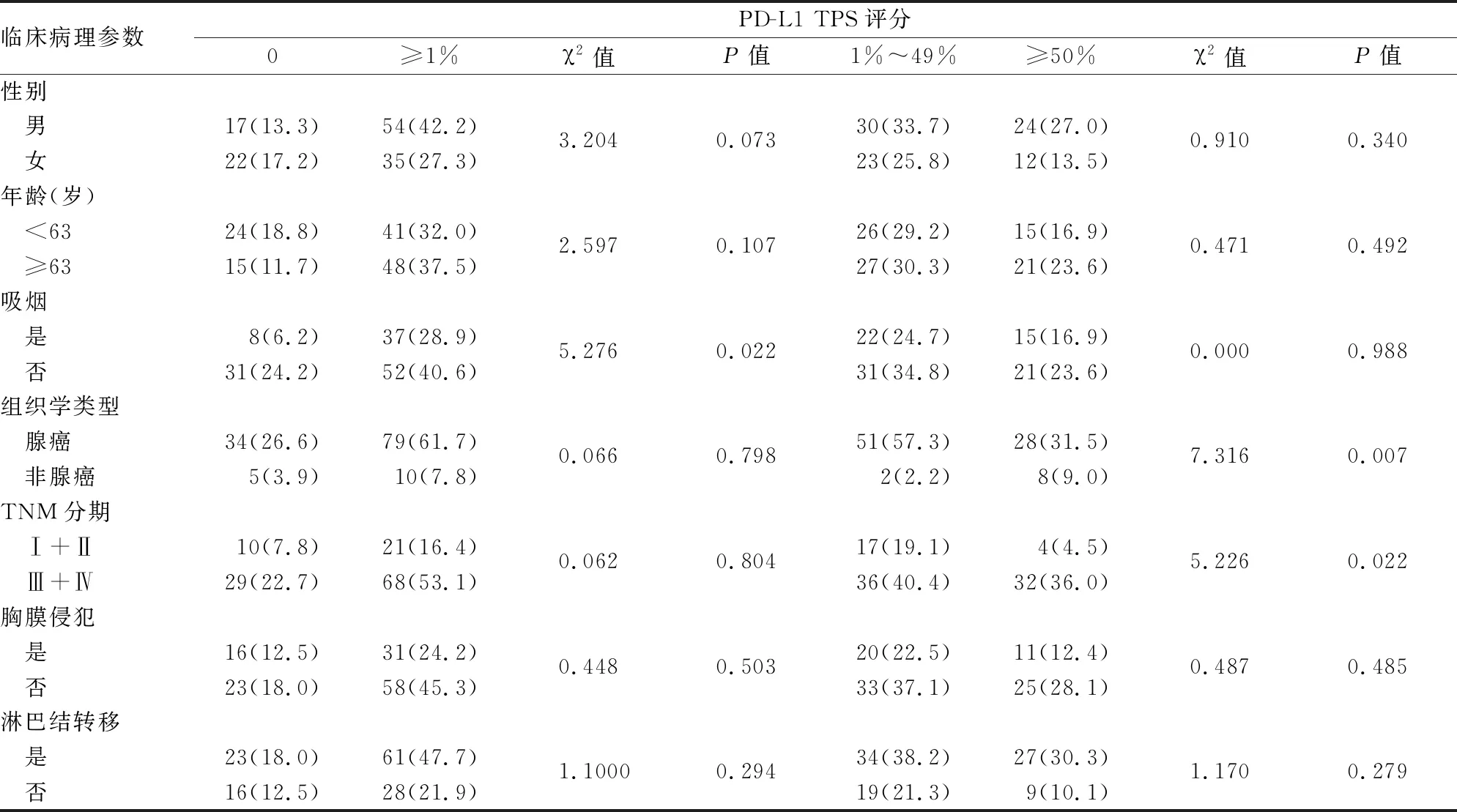
表2 PD-L1表达与NSCLC临床病理特征的关系
2.3 NSCLC中PD-L1表达与EGFR、KRAS、ALK突变的相关性KRAS突变患者PD-L1阳性率高(P=0.022);在EGFR突变患者中PD-L1 TPS 1%~49%水平患者阳性率较高(P=0.025),但总体阳性率仅具有较高的趋势(P=0.092);PD-L1表达与ALK表达无关(P>0.05,表3)。与EGFR突变患者比较,KRAS突变患者肿瘤细胞PD-L1表达水平较高(P=0.028),而与ALK突变型及野生型组相比差异无统计学意义(P>0.05,图2)。EGFR 19del/L858R及KRAS G12D/G12C各突变亚型患者之间PD-L1表达差异无统计学意义(P>0.05,图2)。PD-L1表达与KRAS基因突变呈显著正相关(r=0.203,P=0.022),与EGFR基因突变呈负相关,但差异无统计学意义(r=-0.149,P=0.093),与ALK基因突变无相关性(r=0.067,P>0.05,表4)。
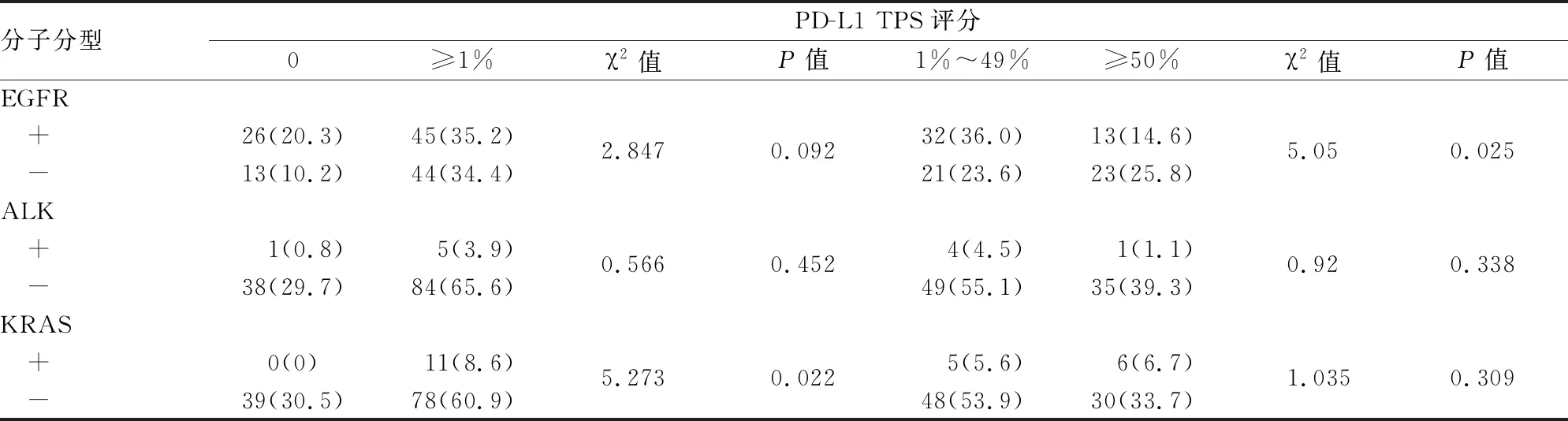
表3 PD-L1表达与NSCLC肿瘤分子分型的相关性
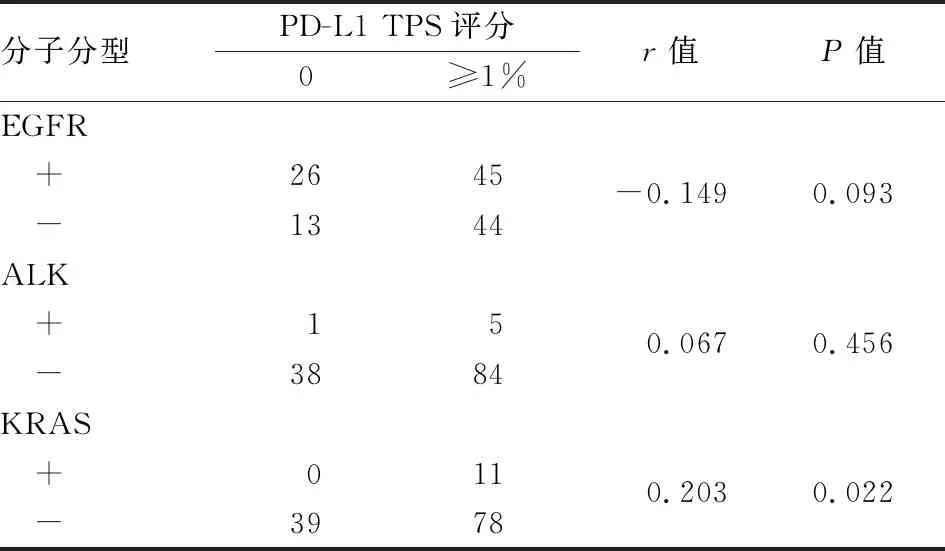
表4 NSCLC中PD-L1表达与EGFR、ALK、KRAS基因突变状态的相关性
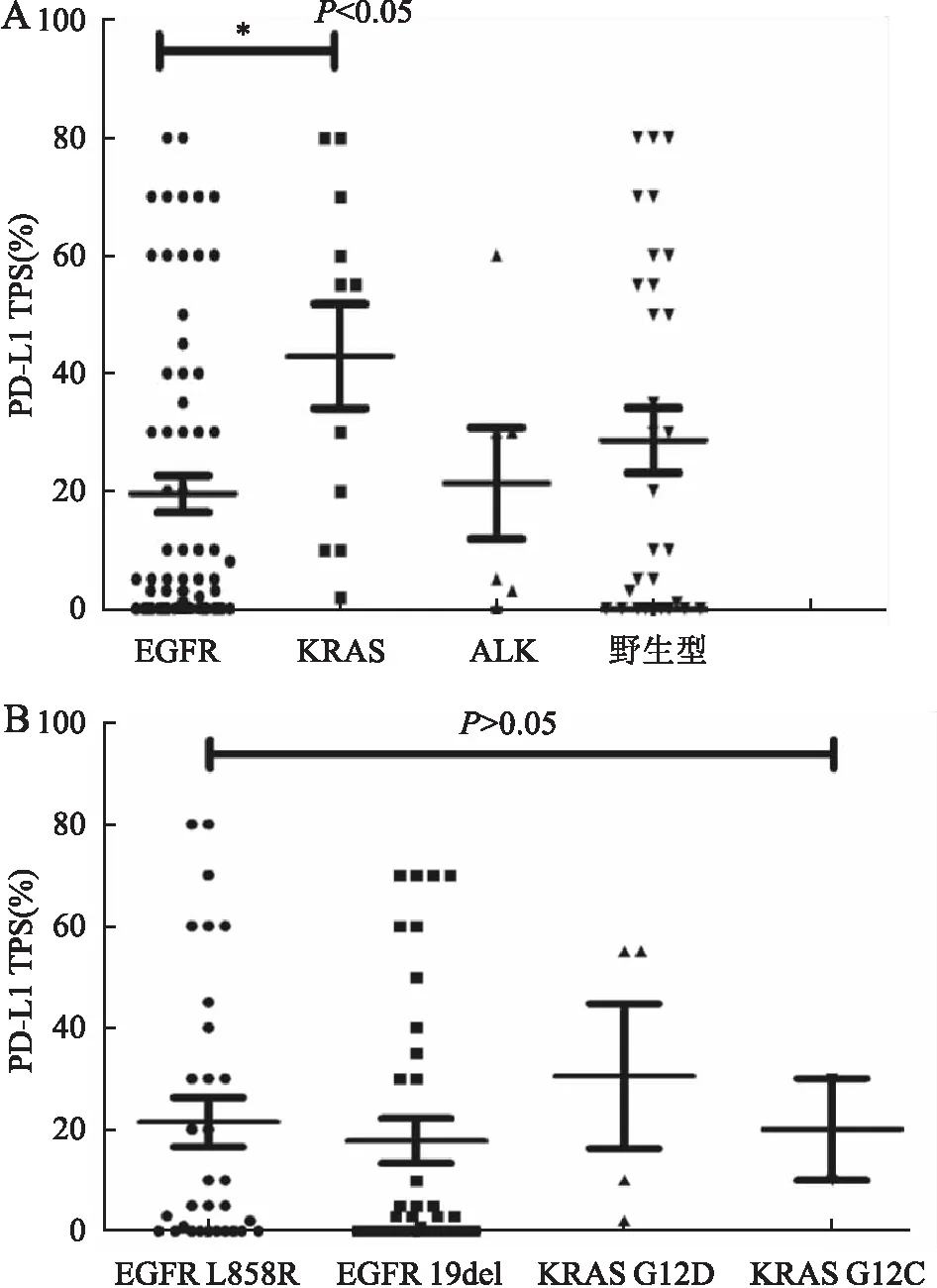
图2 A.EGFR、ALK、KRAS突变型及野生型患者PD-L1表达水平比较;B.EGFR、KRAS突变亚型间患者PD-L1表达水平比较
3 讨论
在NSCLC中,EGFR突变可激活与肿瘤发生发展相关的下游信号通路。既往研究表明,EGFR突变与非吸烟女性亚裔肺腺癌患者密切相关[7]。本组中,EGFR突变在女性(P=0.022)、腺癌(P<0.001)中频率较高,虽然非吸烟患者EGFR突变率高于吸烟者,但与患者吸烟史、年龄、TNM分期无相关性(P>0.05),可能由于纳入研究的样本量少,具有一定局限性。ALK融合是肿瘤最常见的活化和过表达机制,融合的主要形式是EML4-ALK,发生率占5%~6%[8]。ALK重排多见于年轻、女性、从不或轻度吸烟的晚期肺腺癌患者[9]。本组6例ALK阳性患者融合类型均为EML4-ALK,阳性率为4.69%,与文献报道一致;融合发生率在女性、年轻、腺癌、晚期患者中较高。KRAS基因突变可促进肿瘤生长,在亚洲肺腺癌患者中约占10%,且在老年、男性、吸烟、肺黏液型腺癌中的阳性率高[10-13]。本组中KRAS突变率为8.59%,与既往研究基本一致;在老年、男性、肺腺癌的患者中阳性率较高,但差异无统计学意义。此类患者预后较差,且与EGFR-TK1耐药密切相关,因此检测KRAS突变状态对NSCLC治疗具有重要的指导意义[14]。
PD-1与PD-L1结合可抑制CD4、CD8+T细胞的增殖与活化,促进T细胞凋亡,负性调控机体的免疫应答过程。有研究表明,PD-L1表达水平在女性、非吸烟、腺癌患者中较高,在EGFR、KRAS突变型NSCLC细胞组中高于野生型组,使用EGFR抑制剂可以降低其在突变型组细胞中的表达水平,但对野生型组不产生影响[1,15-16]。本组中PD-L1表达水平在非吸烟患者中高于吸烟者(P=0.022),在男性患者中表现出高于女性的趋势(P=0.073);EGFR(P=0.092)、KRAS突变患者阳性率高(P=0.022),且在KRAS突变患者中高于EGFR突变患者(P<0.05),但与ALK突变及野生型患者组间差异无统计学意义。
综上所述,PD-L1表达与EGFR、KRAS有相关性,其表达水平在肺癌不同突变亚型之间存在差异,以PD-L1为靶点的免疫治疗方案有望成为EGFR、KRAS突变型患者的辅助治疗手段。
