细胞吞食在细胞病理学诊断中的价值
2021-10-12赵世平孙瑞英
黄 红,赵世平,孙瑞英,杨 军
Cell-in-Cell(CIC)样结构是指一个或多个细胞(通常是活细胞)存在于另一个细胞(通常是非吞噬细胞)内的细胞病理学结构[1],最早由Steinhaus等[2]于1891年在肿瘤组织中首次发现并报道。此后,陆续有学者在胸腺、肝脏等正常组织,病理性炎性组织和多种类型的肿瘤,尤其是进展期恶性肿瘤中发现CIC样结构[3],并认为其很可能与肿瘤的恶性进展有关。近年作者发现,在多种肿瘤细胞学样本中也存在数量不等的CIC样结构。截至目前,CIC样结构尚缺乏一个被广泛认可的中文译名,为便于对其形态特征进行准确描述,作者根据CIC样结构的形成过程和特征,暂且将CIC样结构命名为“细胞吞食(cellular devouring)”,并认为细胞吞食是恶性肿瘤进展中肿瘤细胞吞食肿瘤细胞或其它细胞及成分的过程中所形成的特殊的形态学结构。本实验拟通过对细胞蜡块中细胞吞食的观察,探索其在细胞病理学诊断中的价值和临床意义。
1 材料与方法
1.1 临床资料收集2020年1月~2021年1月西安交通大学第二附属医院病理科存档的体液样本细胞蜡块128例。经免疫组化和(或)活检标本证实其中恶性肿瘤98例(胸水蜡块69例、腹水蜡块25例、心包积液蜡块4例),非恶性肿瘤30例。
1.2 方法
1.2.1细胞蜡块的制作 所有体液标本4 000 r/min离心5 min,弃上清,沉淀物加入95%乙醇3 mL,混匀后室温静置30 min,沉淀物凝固成块后,用擦镜纸包裹后放入包埋盒内继续固定3~12 h,常规进行全自动脱水机固定、脱水、包埋、切片(4~5 μm)、HE染色。由具有资质的病理医师在光学显微镜下进行观察和细胞病理学诊断,免疫组化采用Roche Ventana Ultraview全自动免疫组化机进行染色,所有抗体均购自福州迈新公司。
1.2.2评价标准 细胞蜡块HE切片中CIC样结构的判读标准:宿主细胞体积膨大呈指环状,单核或多核,呈新月形偏于一侧;内部细胞呈圆形,可为单个或多个细胞,被宿主细胞膜完整包裹[4]。CIC阳性细胞占比=高倍视野下CIC样结构的细胞数/总肿瘤细胞数×100%。
1.3 统计学分析采用SPSS 22.0软件进行统计学分析,多组间比较采用Kruskal-Wallis检验分析,两组间比较用Mann-WhitneyU检验分析,P<0.05为差异有统计学意义。
2 结果
2.1 细胞蜡块中CIC样结构的检出率、CIC阳性细胞占比及与肿瘤类型的关系在98例恶性肿瘤细胞蜡块中CIC结构的检出率为26.5%(26/98),其中男性12例,女性14例,年龄44~85岁;胸水蜡块中CIC结构的检出率为30.4%(21/69),腹水蜡块中CIC结构的检出率为12.0%(3/25),心包积液蜡块中CIC结构的检出率为50.0%(2/4)。在26例有CIC结构病例中,其中19例CIC阳性细胞占比1%~10%,5例CIC阳性细胞占比11%~20%,2例CIC阳性细胞占比大于20%;原发癌来自肺腺癌13例、肺鳞状细胞癌2例、肺小细胞癌1例、乳腺癌2例、胃腺癌3例、原发灶不明者5例。30例非恶性肿瘤细胞蜡块中未观察到典型的CIC结构(表1、2)。
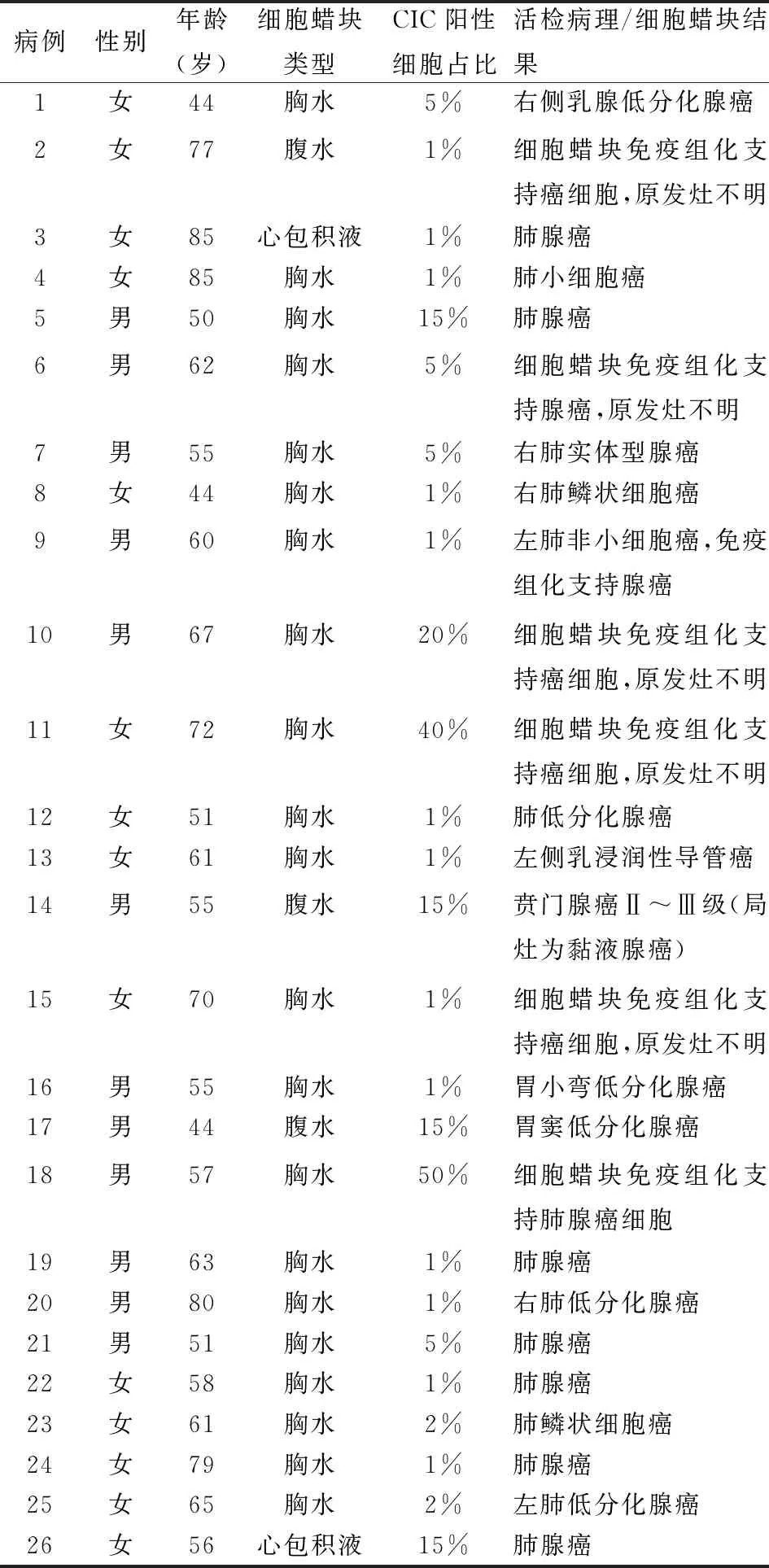
表1 26例检出CIC结构的细胞蜡块类型、CIC阳性细胞占比及原发灶肿瘤
2.2 细胞蜡块中CIC的形态结构细胞蜡块HE切片中CIC样结构表现为吞食细胞体积膨大,可见1~2个细胞核,核被挤压于细胞一侧呈新月形,内吞细胞呈圆形,1个或多个,被吞食细胞完整包裹,部分病例中可见两者的细胞核均增大、深染、染色质增粗,可见大核仁,显示恶性肿瘤细胞的特征(图1);内吞细胞可呈有丝分裂状态(图2)、凋亡状态(图3)。另外,还可见吞食细胞吞食中性粒细胞(图4)、淋巴细胞(图5)及红细胞(图6)或细胞外的渗出物(图7)。免疫组化CK染色能更清楚地显示其形态(图8)。

图1 肺腺癌胸水蜡块中CIC结构:黑箭头示宿主细胞(含1~2个细胞核),红箭头示内部细胞(1~5个) 图2 肺腺癌胸水蜡块CIC结构:黑箭头示宿主细胞,红、黄箭头示内部细胞,其中一个内部细胞(黄箭头)处于有丝分裂状态,说明进入宿主细胞的癌细胞是活细胞 图3 肺腺癌胸水蜡块CIC结构:进入宿主细胞(黑箭头)的内部细胞(红箭头)核碎裂,处于凋亡状态 图4 肺腺癌胸水蜡块CIC结构:示宿主细胞(黑箭头)吞食中性粒细胞(红箭头) 图5 肺腺癌胸水蜡块CIC结构:示宿主细胞(黑箭头)吞食淋巴细胞(红箭头) 图6 肺腺癌胸水蜡块CIC结构:示宿主细胞(黑箭头)吞食红细胞(红箭头) 图7 胃腺癌腹水蜡块中CIC结构:示宿主细胞(黑箭头)吞食细胞外渗出物(红箭头) 图8 肺腺癌胸水蜡块:宿主细胞(黑箭头)和内部细胞(红箭头)CK均阳性,EnVision法
3 讨论
目前认为,细胞吞食是由吞食细胞(也称宿主细胞)和内吞细胞(也称内部细胞)组成,可分为同源型(肿瘤细胞存在于肿瘤细胞内)和异源型(非肿瘤细胞存在于肿瘤细胞内)两种吞食模式,由“自食(cannibalism)”“伸入运动(emperipolesis)”“内吞(entosis)”三个复杂的连续过程形成[1]。
尽管目前对于细胞吞食在肿瘤进展中的机制和作用尚不清楚,但多数研究者认为,营养缺乏是癌细胞一直面临的生存压力之一,尤其是当癌细胞转移至浆膜腔后,癌细胞只能从周围微环境中摄取蛋白及其它物质以维持自身生存和增殖。因而,细胞吞食也就成为癌细胞获取营养的主要途径[5-6]。而癌细胞持续的无氧糖酵解引起的细胞内乳酸积累,pH值降低也可诱发癌细胞吞食的发生[7]。目前发现,细胞吞食的发生主要与微囊蛋白-1(caveolin-1, Cav-1)、埃兹蛋白(Ezrin)、TM9、白细胞功能相关抗原-1(LFA-1)、细胞间黏附分子-1(ICAM-1)、Rho蛋白、KRAS信号通路的活化有关[1,8-12]。
虽然细胞吞食的过程在一定程度上类似于巨噬细胞的细胞吞噬(cell phagocytosis),两者均可吞噬凋亡细胞、细胞碎片或非细胞类物质,但却有着本质差异:细胞吞食是肿瘤细胞吞食肿瘤细胞的过程,更倾向于存活肿瘤细胞间的相互吞食,是肿瘤细胞为自身的生存而摄取营养的一种方式;而巨噬细胞的吞噬则是清除死亡细胞、坏死组织碎片、病菌和外源性物质以维持内环境的稳定[7,13]。

表2 CIC阳性细胞占比与肿瘤类型的关系
有研究发现胰腺癌中细胞吞食的发生与肿瘤转移呈负相关[14]。但多数研究证实,高级别恶性肿瘤中细胞吞食的检出率更高,而且头颈部鳞状细胞癌、肺癌、直肠癌中细胞吞食的高检出率与患者的低生存率和肿瘤的复发密切相关。由此可见,细胞吞食可作为恶性肿瘤的独立预后因素,且较组织异型性、分级、核分裂象等参数更能预测患者的预后[4,15-16]。
本组中恶性肿瘤体液样本细胞蜡块中细胞吞食的检出率为26.5%(26/98),其中73.1%(19/26)的病例中CIC细胞占比为1%~10%,19.2%(5/26)的病例中CIC细胞占比11%~20%,7.7%(2/26)的病例中CIC细胞占比大于20%;而在30例非恶性肿瘤样本中均未发现细胞吞食现象。CIC细胞占比在不同类型恶性肿瘤之间比较差异无统计学意义,而在恶性肿瘤与非恶性肿瘤之间差异有统计学意义。由此可见,虽然细胞吞食的检出率和CIC占比并不是很高,但特异性较高,且与肿瘤类型无关。
同时,本实验还发现细胞吞食可呈现多种形态特征:吞食细胞体积常膨大,形成印戒状、环状或大囊腔样,1~2个细胞核常被挤压于细胞一侧呈新月形,核深染,部分可见核仁;内吞细胞呈圆形,数量不等,1~5个细胞,多为1个,可为增殖期、分裂期或凋亡状态细胞或死亡细胞碎片,被吞食细胞完整包裹,这也从形态上说明被吞食细胞吞食的内吞细胞是可分裂增殖的活细胞。此外,吞食细胞内还可见吞食的淋巴细胞、中性粒细胞及红细胞等细胞或其它成分。免疫组化CK染色能更清楚地显示出其形态特点,且便于准确计数。
总之,细胞吞食是在营养缺乏或低pH环境压力下肿瘤细胞为维持生存的一种适应性变化,预示着肿瘤细胞具有更强的运动和吞食活性,并且有可能通过细胞吞食诱导多倍体细胞的形成和染色体突变,从而促进恶性肿瘤的演进[17]。同时,由于细胞吞食具有典型的细胞形态学特征,因而细胞吞食可作为诊断恶性肿瘤可靠的细胞形态学指标,用于良、恶性肿瘤的诊断和鉴别诊断。
