透明细胞性肾细胞癌中MYBL2表达及临床意义
2021-10-12眭怡群杨天宇谢佳明张永胜
眭怡群,杨 芹,涂 健,杨天宇,谢佳明,张永胜
透明细胞性肾细胞癌(clear cell renal cell carcinoma, ccRCC)起源于肾小管上皮细胞,是肾细胞癌中最常见且预后最差的病理类型。目前对其的治疗手段有限,主要以根治性肾切除术为主,但术后易复发和转移,致死率高。因此,探索ccRCC潜在生物学标志物和治疗靶点的研究越来越多[1-2]。骨髓母细胞增生症病毒癌基因同源物样2(MYB proto-oncogene like 2, MYBL2)基因又名B-myb,定位于20q13染色体上,与A-myb、C-myb是同源基因,在增殖细胞中广泛表达。MYBL2参与调节细胞周期、细胞存活和细胞分化等多种生理过程,且其过表达与癌症的发生密切相关[3]。已有研究表明,在前列腺癌、肝细胞肝癌、肺癌、乳腺癌、子宫颈癌、胰腺癌、胃癌和结直肠癌[4-11]等多种肿瘤中均存在MYBL2过表达,且MYBL2过表达与肝细胞肝癌、胰腺癌和胃癌患者的不良预后有关[5-7]。目前,关于MYBL2基因在ccRCC中的研究较少。因此,本实验通过分析MYBL2 mRNA和蛋白在ccRCC中的表达,探讨ccRCC中MYBL2表达及临床病理意义。
1 材料与方法
1.1 标本来源收集2009年10月~2019年8月苏州大学附属第二医院存档的ccRCC手术切除标本217例及其癌旁正常肾组织185例,所有ccRCC标本均经两名有经验的病理医师复阅确诊。其中位于左肾109例,右肾108例;男性149例,女性68例;患者年龄21~88岁,中位年龄60岁,四分位数间距16岁;肿瘤直径<6 cm者167例,≥6 cm者50例。根据WHO/ISUP分级系统分为4级:其中1+2级155例,3+4级62例;按AJCC第七版临床分期:Ⅰ+Ⅱ期204例,Ⅲ+Ⅳ期13例;伴淋巴结转移者3例,无淋巴结转移者214例;伴脉管侵犯者15例,无脉管侵犯者202例;伴远处转移者5例,无远处转移者212例。217例中197例获得随访,主要采用门诊复查及电话回访等形式,随访截至2021年3月,随访时间1~129个月,中位时间为51个月。患者总体生存时间为手术日至末次随访或患者死亡时间。另随机收集苏州大学附属第二医院病理科存档的新鲜ccRCC组织及其对应癌旁组织标本各20例。所有患者术前均未接受任何辅助治疗。
1.2 qRT-PCR取出液氮中保存的ccRCC组织及其对应癌旁组织,加入Trizol裂解液(Sangon Biotech公司)提取总RNA,并利用全波长酶标仪测定其浓度。经反转录试剂盒(购自Tiangen公司)逆转录为cDNA,然后用SYBRGreen试剂盒(购自Tiangen公司)进行qRT-PCR检测。MYBL2基因引物序列:上游5′-CTTGAGCGAGTCCAAAGACTG-3′,下游5′-AGTTGGTCAGAAGACTTCCCT-3′。内参β-actin引物序列:上游5′-CACCATTGGCAATGAGCGGTTCC-3′,下游5′-GTAGTTTCGTGGATGCCACAGG-3′。每组样品设置3个复孔,按2-ΔΔCt法计算mRNA表达水平。
1.3 组织芯片构建依据HE染色切片选取存档组织蜡块,显微镜下观察切片,并选取具有代表性的病变部位。利用组织芯片构建仪制备组织芯片。
1.4 免疫组化和结果判断免疫组化采用EnVision两步法,MYBL2兔抗人单克隆抗体(英国Abcam公司)工作浓度为1 ∶100。MYBL2蛋白阳性染色主要定位于细胞核/质。由两位病理医师对切片进行双盲法阅片,每例镜下随机采集10个视野。根据染色细胞比例评分:<5%为0分,5%~25%为1分,26%~50%为2分,51%~75%为3分,>75%为4分;根据细胞染色强度评分:无阳性染色为0分,淡黄色为1分,黄色为2分,棕黄或棕褐色为3分。将两项评分结果相乘作为MYBL2蛋白表达最终评分:0~5分为低表达,6~12分为高表达。
1.5 生物信息学方法从癌症基因组图谱(The Cancer Genome Atlas, TCGA)数据库(https://cancergenome.nih.gov/)中获取原发性ccRCC数据集中经RSEM标准化后的RNA-Seq数据和相应的临床随访数据,最终共纳入正常肾组织标本72例,ccRCC组织标本534例,比较ccRCC组织及正常肾组织中MYBL2 mRNA的表达情况,并以534例ccRCC组织中MYBL2 mRNA表达均值作为cut-off值绘制生存曲线。通过计算Pearson相关系数获得与MYBL2表达显著相关的基因,且利用DAVID数据库(https://david.ncifcrf.gov/)对这些基因进行GO分析,并通过气泡图展示结果。
1.6 统计学方法所有数据使用SPSS 22.0软件进行统计学分析,20对新鲜ccRCC组织及癌旁组织中MYBL2 mRNA的表达水平采用配对t检验进行分析。MYBL2蛋白表达在正常肾组织和ccRCC组织之间,及在ccRCC临床病理特征之间的差异性比较用χ2检验(或Fisher概率法)。采用Cox回归模型进行单因素及多因素分析,Kaplan-Meier法绘制生存曲线。以P<0.05为差异有统计学意义。
2 结果
2.1 ccRCC组织和正常肾组织中MYBL2 mRNA表达20对ccRCC组织和癌旁正常肾组织的qRT-PCR结果显示,MYBL2 mRNA相对表达量在ccRCC组织中为(188.60%±31.67%),在癌旁正常组织中为(100.00%±17.29%),差异具有统计学意义(t=-2.532,P=0.020)。
2.2 ccRCC组织和正常肾组织中MYBL2蛋白表达ccRCC肿瘤细胞呈泡巢状生长,胞质丰富且透明,间质富含毛细血管网(图1)。MYBL2蛋白表达主要定位于细胞核/质,呈淡黄色至棕褐色颗粒状或团雾状(图2)。217例ccRCC中57例(26.3%)MYBL2蛋白高表达;185例正常肾脏组织中27例(14.6%)MYBL2蛋白高表达。两组差异具有统计学意义(χ2=8.232,P=0.004,表1)。

表1 ccRCC及癌旁正常肾脏组织中MYBL2蛋白的表达
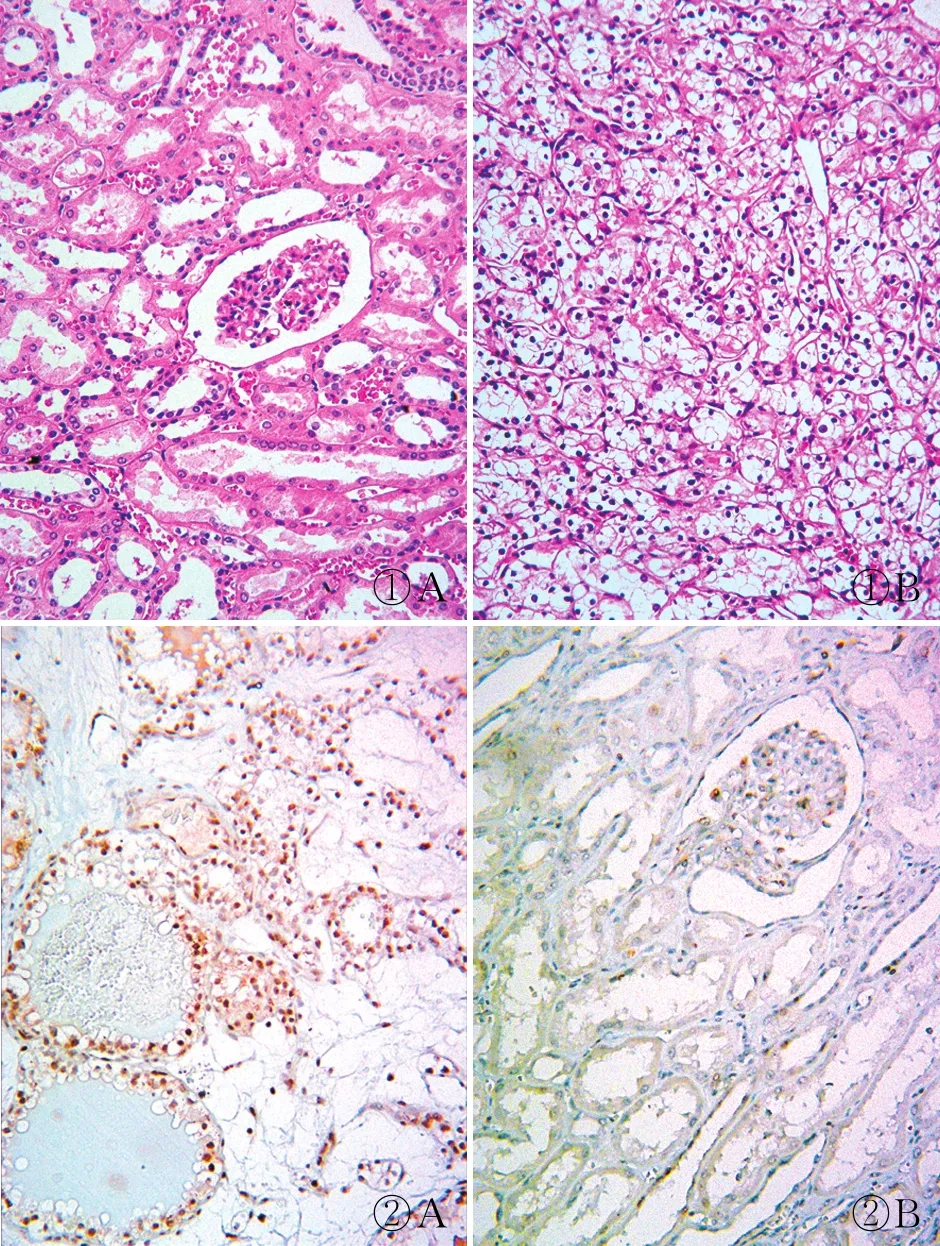
图1 正常肾脏组织和ccRCC组织HE染色:A.正常肾脏组织,可见肾小球和肾小管结构;B.ccRCC组织,胞质透亮的肿瘤细胞呈泡巢状生长 图2 ccRCC组织及正常肾脏组织中MYBL2蛋白的表达,EnVision两步法:A.MYBL2蛋白在ccRCC组织中呈阳性;B.MYBL2蛋白在正常肾脏组织中呈阴性
2.3 MYBL2蛋白表达与ccRCC临床病理特征的关系MYBL2蛋白表达与ccRCC临床病理特征的相关性分析表明,MYBL2蛋白表达与ccRCC远处转移相关(χ2=5.054,P<0.05,表2),而与患者性别、年龄、肿瘤大小、部位、病理学分级、淋巴结转移、脉管癌栓等临床病理特征无关(P>0.05)。
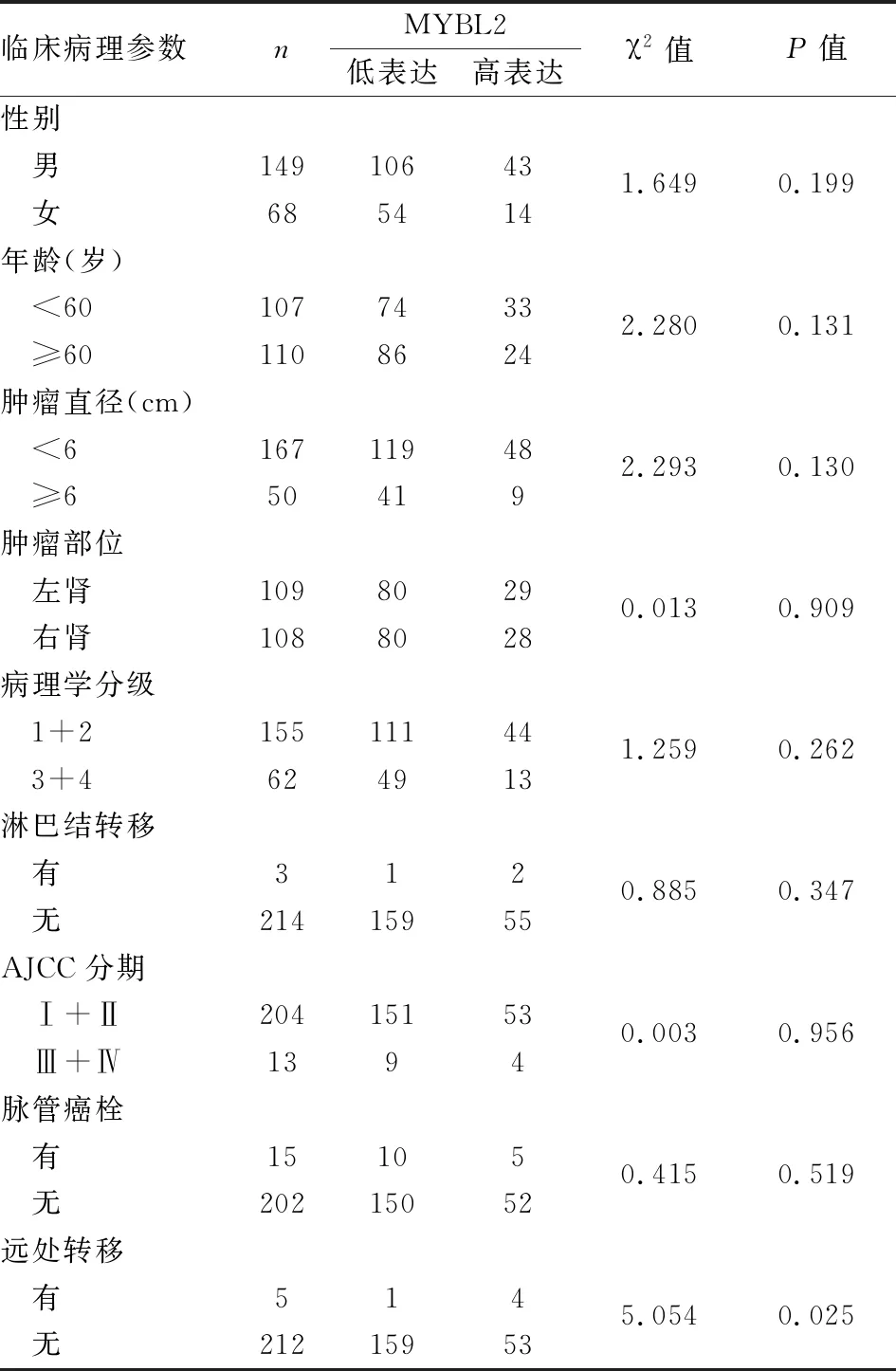
表2 ccRCC中MYBL2蛋白表达与临床病理特征的关系
2.4 预后的相关性分析单因素分析结果显示,患者年龄、肿瘤大小、脉管癌栓、淋巴结转移、远处转移、AJCC分期及MYBL2蛋白表达与ccRCC患者预后相关(P<0.05,表3)。多因素分析结果显示,患者年龄、肿瘤大小及MYBL2蛋白表达是ccRCC独立的预后因素(P<0.05,表4)。Kaplan-Meier生存分析显示,MYBL2蛋白高表达患者的总生存期(overall survival, OS)显著缩短(P=0.011,图3)。

图3 ccRCC组织中MYBL2蛋白表达与患者生存的关系
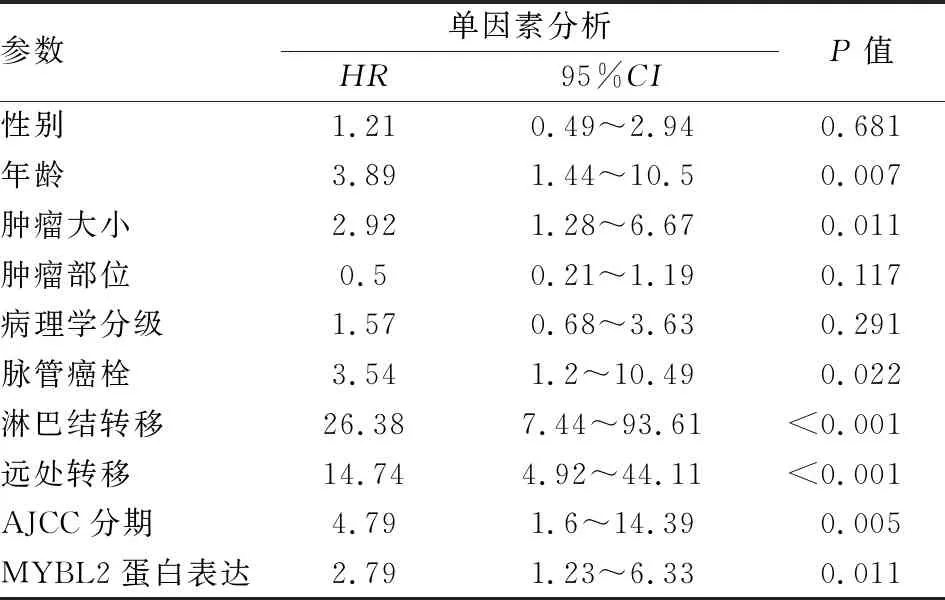
表3 影响ccRCC患者预后的单因素分析

表4 影响ccRCC患者预后的多因素分析
2.5 TCGA数据库分析数据库结果进一步显示,534例ccRCC组织中MYBL2 mRNA表达(151.70±245.19)高于正常肾组织(20.84±89.20),差异具有统计学意义(P<0.001)。MYBL2 mRNA表达与ccRCC患者生存分析表明(图4),与MYBL2 mRNA低表达者相比,高表达者的OS显著缩短(P<0.000 1)。
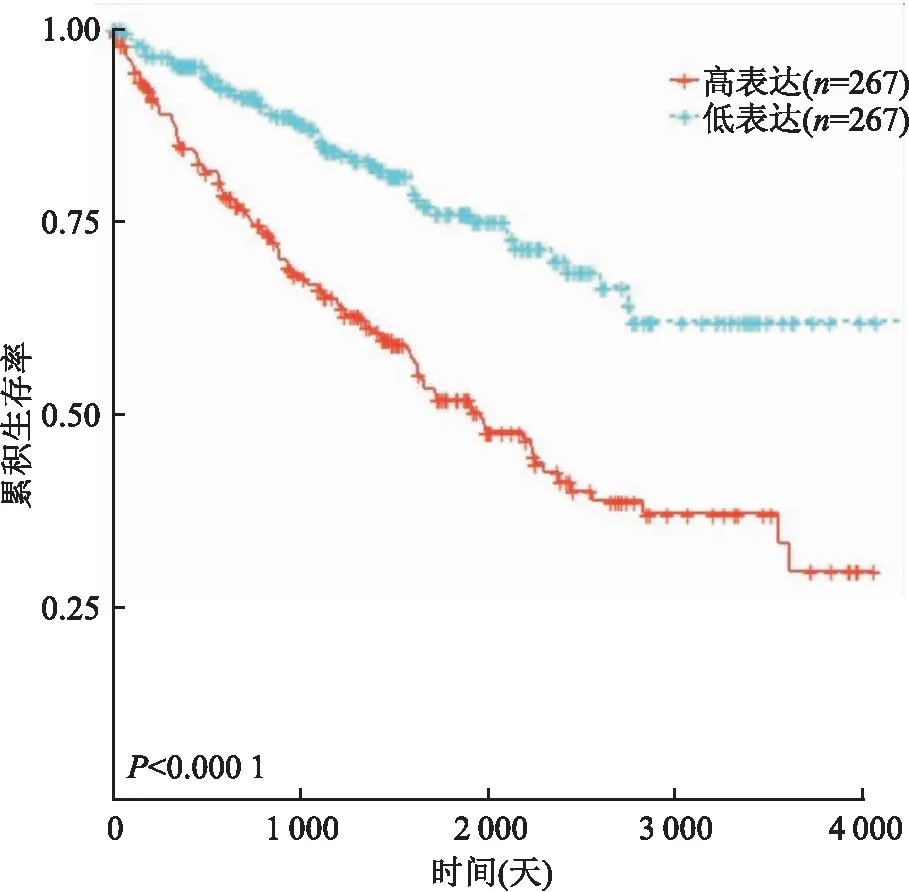
图4 TCGA数据库对ccRCC组织中MYBL2 mRNA表达的预后分析:以534例ccRCC中MYBL2 mRNA表达均值为cut-off值绘制生存曲线
2.6 与MYBL2表达显著相关的基因及其GO分析采用相关系数热图展示了ccRCC组织中,与MYBL2表达显著相关的排名前100个基因,包括CDC20、PLK1、KIF20A、CENPA、KIF2C、CCNB1、PK-MYT1、CDCA8、CDCA3、CEP55等基因(图5)。对这100个基因进行了GO富集分析,包括了分子功能、生物过程和细胞组成,并通过气泡图展示结果。ccRCC组织中MYBL2表达主要与ATP酶活性、微管结合、解旋酶活性、丝氨酸/苏氨酸激酶活性、组蛋白激酶活性、有丝分裂细胞周期转变调控、细胞周期中后期转换等的调控相关联(图6)。

图5 ccRCC组织中MYBL2与100个基因的相关性热图:从左到右关联减弱
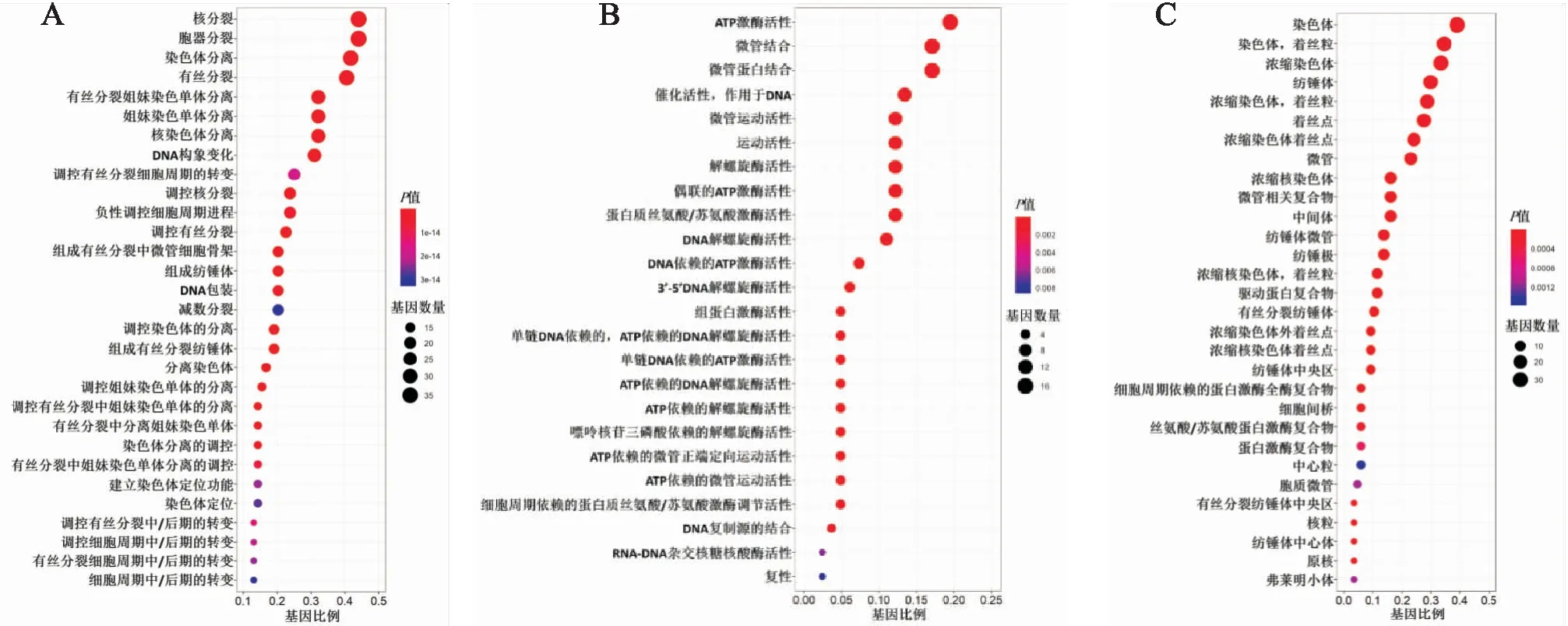
图6 ccRCC组织中相关基因的GO分析:A.生物过程;B.分子功能;C.细胞组成
3 讨论
MYBL2作为转录因子参与细胞周期调控、细胞增殖与分化、细胞凋亡与自噬等多种生理过程[3,12]。目前认为,MYBL2可通过促进癌细胞增殖、介导化疗药物耐药性和促进癌细胞转移扩散等方式,参与癌症的发生、发展。Parikh等[13]报道MYBL2在许多p53突变型癌症中过度上调,通过与p53协同作用,促进癌细胞的周期进展和细胞存活。此外,Tao等[14]研究表明,在乳腺癌中敲除MYBL2基因,能上调E-cadherin的表达,而MYBL2过表达则下调E-cadherin表达,且增加间充质标志物的表达,提示MYBL2可能通过上调上皮-间质转化(epithelial-mesenchymal transformation, EMT)相关调控因子SNAIL的表达,从而介导EMT的激活和癌细胞的侵袭。
本实验结果发现,ccRCC组织中MYBL2 mRNA的相对表达量高于癌旁正常肾组织,ccRCC组织中MYBL2蛋白高表达率也显著高于正常肾组织,提示ccRCC组织中存在MYBL2过表达。MYBL2蛋白表达与临床病理特征的相关性分析表明,MYBL2蛋白高表达与ccRCC远处转移相关,而与其它临床病理参数无相关性。Sun等[15]利用生物信息学分析表明,MYBL2蛋白高表达与ccRCC患者性别、高组织学分级、临床晚期、淋巴结转移及远处转移相关。Nientiedt等[16]研究表明MYBL2在高组织学分级、临床晚期ccRCC患者中高表达。本实验结果显示,尽管MYBL2蛋白表达与淋巴结转移、脉管癌栓及AJCC分期无统计学相关性,但在有淋巴结转移、有脉管内癌栓及AJCC分期(Ⅲ+Ⅳ期)ccRCC患者中,MYBL2蛋白高表达率有升高的趋势,分析其可能由于本组病例总体分期较早,有淋巴结转移及脉管内癌栓者较少,样本内部参数可能存在一定偏差,故MYBL2蛋白表达与临床病理特征的相关性可能仍需更多的研究验证。本组预后分析显示,MYBL2蛋白表达与ccRCC患者生存时间呈负相关。此外,利用TCGA数据库进一步证实,与正常肾组织相比,ccRCC中MYBL2 mRNA表达明显上调,且MYBL2 mRNA的高表达与ccRCC患者的不良预后密切相关。上述研究结果提示,MYBL2过表达可能参与了ccRCC的发生、发展和转归。
相关系数热图显示,在ccRCC组织中,MYBL2与CDC20、PLK1、KIF20A等基因明显相关。已有研究[17-21]表明,上述MYBL2相关基因与细胞周期进展及多种癌症的发生、发展有关。GO富集分析表明,ccRCC组织中MYBL2相关基因明显富集在ATP酶活性、微管结合、解旋酶活性、丝氨酸/苏氨酸激酶活性、组蛋白激酶活性等分子功能,染色体、着丝粒、纺锤体、微管等细胞组分,进而调控有丝分裂细胞周期的转换。因此,推测MYBL2基因与其显著相关基因可能通过上述功能簇,参与ccRCC的发生、发展和转归,具体作用机制有待进一步分析。
综上所述,MYBL2在ccRCC中高表达,其可能成为ccRCC的独立预后标志物及潜在治疗靶点,但其在应用于临床前仍需进行大量的实验研究。
