银杏内酯B口服对cuprizone诱导的脱髓鞘小鼠的髓鞘保护
2021-10-11俞明杨赵梦茹田童张倩霞张雨萌杨颖博肖保国肖伟
俞明杨 赵梦茹 田童 张倩霞 张雨萌 杨颖博 肖保国 肖伟
多发性硬化(multiple sclerosis,MS)是一种中枢神经系统脱髓鞘疾病,以神经炎症、脱髓鞘和轴突丢失为主要病理学特点[1]。双环己酮草酰二腙(cuprizone,CPZ)是一种铜离子螯合剂,可靶向诱导少突胶质细胞死亡而引发中枢髓鞘脱失,常用于髓鞘脱失及保护再生的研究[2],用其诱导的脱髓鞘动物模型可模拟MS的病理变化。银杏内酯B(ginkgolide B,GB)是一种银杏二萜内酯单体,是银杏叶提取物的主要有效成分,具有抗炎、抗氧化、抗血管生成和防治阿尔兹海默等作用[3]。作者团队前期研究发现腹腔注射GB可保护CPZ诱导的脱髓鞘小鼠的髓鞘脱失和行为异常[4]。然而,脱髓鞘疾病作为神经系统慢性病,需要长期治疗,静脉注射用药并不合适。近年来,口服给药已成为脱髓鞘疾病新药的研发趋势。本研究探索了口服GB对CPZ诱导的脱髓鞘模型小鼠髓鞘的保护作用,旨在为MS的治疗提供实验依据。
1 材料和方法
1.1 动物和BV-2细胞选取8周龄雄性C57BL/6小鼠24只,体重18~22 g,购自上海西普尔必凯实验动物有限公司,饲养于室温23~25℃、湿度(50±5)%、光/暗循环12 h的SPF级动物房,自由饮水与进食。适应性饲养1周后,将小鼠随机分为正常组、CPZ模型组、GB干预组,每组8只。动物实验操作得到江苏康缘药业股份有限公司伦理委员会批准通过。BV-2细胞购自武汉大学,使用含10%(体积分数)胎牛血清和1%(体积分数)双抗的RPMI 1640培养液,置37℃,5%(体积分数)CO2培养箱中培养,待细胞长至70%~80%时进行实验。
1.2 主要试剂和仪器CPZ、固蓝(LFB)和脂多糖(LPS)购于美国 Sigma 公司,兔抗小鼠钙离子结合衔接分子1(Iba-1)和兔抗小鼠β-tubulin、Alexa Flour 488标记的山羊抗兔、辣根过氧化物酶(HRP)标记的山羊抗兔购自美国CST公司,肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)、IL-6试剂盒购于R&D System,BCA试剂盒和Griess试剂盒购自中国碧云天生物技术有限公司,RPMI 1640培养基、胎牛血清和双抗购自美国赛默飞公司。GB由江苏康缘药业中药制药过程新技术国家重点实验室制备,纯度>99%。将GB溶解于0.5%(质量浓度)CMC-Na溶液中,浓度为2 mg/mL,超声30 min,现配现用。主要仪器包括冷冻切片机(LEICA CM 1950)、荧光显微镜(LEICA DM6 B)、化学发光仪(BIO-RAD ChemiDocTMXRS+)和酶标仪(美谷生物 i3x)。
1.3 方法
1.3.1造模:以含0.2%(质量分数)CPZ的饲料连续喂食6周进行造模。正常组小鼠以常规饲料连续喂食6周;GB干预组小鼠于造模开始的第3周时给予250 μL GB溶液灌胃,正常组和模型组小鼠给予等量0.5%(质量分数)CMC-Na溶液灌胃,连续4周。
1.3.2行为学检测:造模第6周进行行为学检测。(1)高架十字迷宫实验:记录小鼠在开臂所在时间百分比、进入开臂次数和在开臂内的总路程,评估各组小鼠焦虑行为[5]。(2)强迫游泳实验:记录小鼠在水中的总不动时间、速度和总游泳距离,评估小鼠抑郁行为[6]。(3)T迷宫实验:记录小鼠进入另一臂的正确次数,计算正确率,评估小鼠认知行为[7]。
1.3.3组织准备:喂食第6周末,将小鼠以10%(质量分数)水合氯醛麻醉。每组随机取4只小鼠,心脏灌注生理盐水,再灌注4%(质量分数)多聚甲醛固定,取脑置30%(质量分数)蔗糖溶液中脱水,直至脑组织沉底,OTC包埋,液氮速冻,采用冷冻切片机行脑组织切片(片厚10 μm),置-80℃冰箱备用,进行免疫组化和免疫荧光染色。各组余小鼠麻醉后仅灌注生理盐水,取脑组织置-80℃冰箱备用,进行Western blot 和 ELISA 检测。
1.3.4细胞实验:BV-2细胞接种于96孔细胞培养板(5×105/mL),随机分为正常组细胞、模型组细胞和GB干预组细胞。模型组细胞:加入0.1 μg/mL LPS培养24 h;GB干预组细胞:加入50 μg/mL GB和0.1 μg/mL LPS共同培养24 h。
1.3.5髓鞘染色:脑切片经蒸馏水清洗后,放入0.1%(质量分数)LFB染液中60℃过夜,第2天经蒸馏水和95%(体积分数)酒精漂洗,以0.05%(质量分数)碳酸锂溶液分色,70%(体积分数)酒精继续分色,蒸馏水清洗后,置正丁醇中脱水、二甲苯透明、中性树胶封片。显微镜下拍照,采用Image J软件分析髓鞘染色平均光密度值。
1.3.6免疫荧光染色:脑切片置室温下用1%(质量分数)BSA封闭30 min。PBS漂洗1~2次后,添加兔抗Iba-1(1∶1000),置4℃过夜。第2天,PBS漂洗后,添加Alexa Flour 488标记的荧光二抗(1∶1000),室温避光2 h。显微镜下双盲观察并拍照,用Image J软件分析Iba-l+阳性细胞面积百分比,表示小胶质细胞激活状态。
1.3.7Western Blot检测:脑组织用RIPA裂解液提取蛋白,BCA法测定蛋白浓度。取30 μg蛋白进行SDS-PAGE凝胶电泳分离,然后湿转法转膜。经5%(质量分数)脱脂奶粉封闭后,加入β-Tubulin(1∶1000)和Iba-1 抗体(1∶1000)置4℃过夜。第2天,TBST洗膜4次后,加入HRP标记的山羊抗兔二抗(1∶5000)室温孵育 1 h。TBST洗膜4次,加入ECL发光液显色。分析条带灰度值,以Iba-1/β-tubulin比值表示目标蛋白表达相对水平。
1.3.8ELISA检测:采用双抗体夹心法,根据试剂盒说明书检测各组小鼠脑组织提取液和BV-2细胞上清液中TNF-α、IL-6和IL-1β浓度。
1.3.9NO水平检测:采用Griess试剂法,根据NO测定试剂盒说明书检测各组细胞NO水平。
1.4 统计学处理采用GraphPad Prism 5.0 软件进行统计学分析,符合正态分布的计量资料采用均数±标准差表示,多组均数间比较采用单因素方差分析,两两比较采用 Turkey检验;非正态分布的计量资料以中位数(四分位数间距)表示,组间比较采用Kruskal-Wallis检验。取a=0.05。
2 结果
2.1 各组小鼠行为学比较结果见表1。与正常组比较,CPZ模型组开臂所在时间百分比、进入开臂次数、在开臂内的总路程减少(P<0.01或P<0.05),在水中不动时间延长(P<0.01),游泳速度和距离降低(P<0.05或P<0.01),进入另一臂的正确率降低(P<0.01);与CPZ模型组比较,GB干预组在开臂所在时间百分比、进入开臂次数、在开臂内的总路程增加(P<0.05或P<0.01),在水中不动时间减少(P<0.01),游泳速度和距离升高(P<0.01)。

注:A:正常组;B:CPZ模型组;C:GB干预组图1 各组小鼠脑胼胝体髓鞘脱失情况比较(LFB染色,比例尺=200 μm)
2.2 各组小鼠脑组织髓鞘脱失情况与正常组比较,CPZ模型组小鼠脑胼胝体髓鞘染色减少(P<0.01);与CPZ模型组比较,GB干预组小鼠髓鞘染色增多(P<0.01)。结果见图1、表2。
表2 各组小鼠大脑胼胝体髓鞘LFB染色及脑小胶质细胞表达比较
2.3 各组小鼠脑组织小胶质细胞比较结果见图2、表2。与正常组比较,CPZ模型组脑皮层、胼胝体和纹状体小胶质细胞增多(均P<0.01);与CPZ模型组比较,GB干预组脑小胶质细胞数量减少(均P<0.01)。
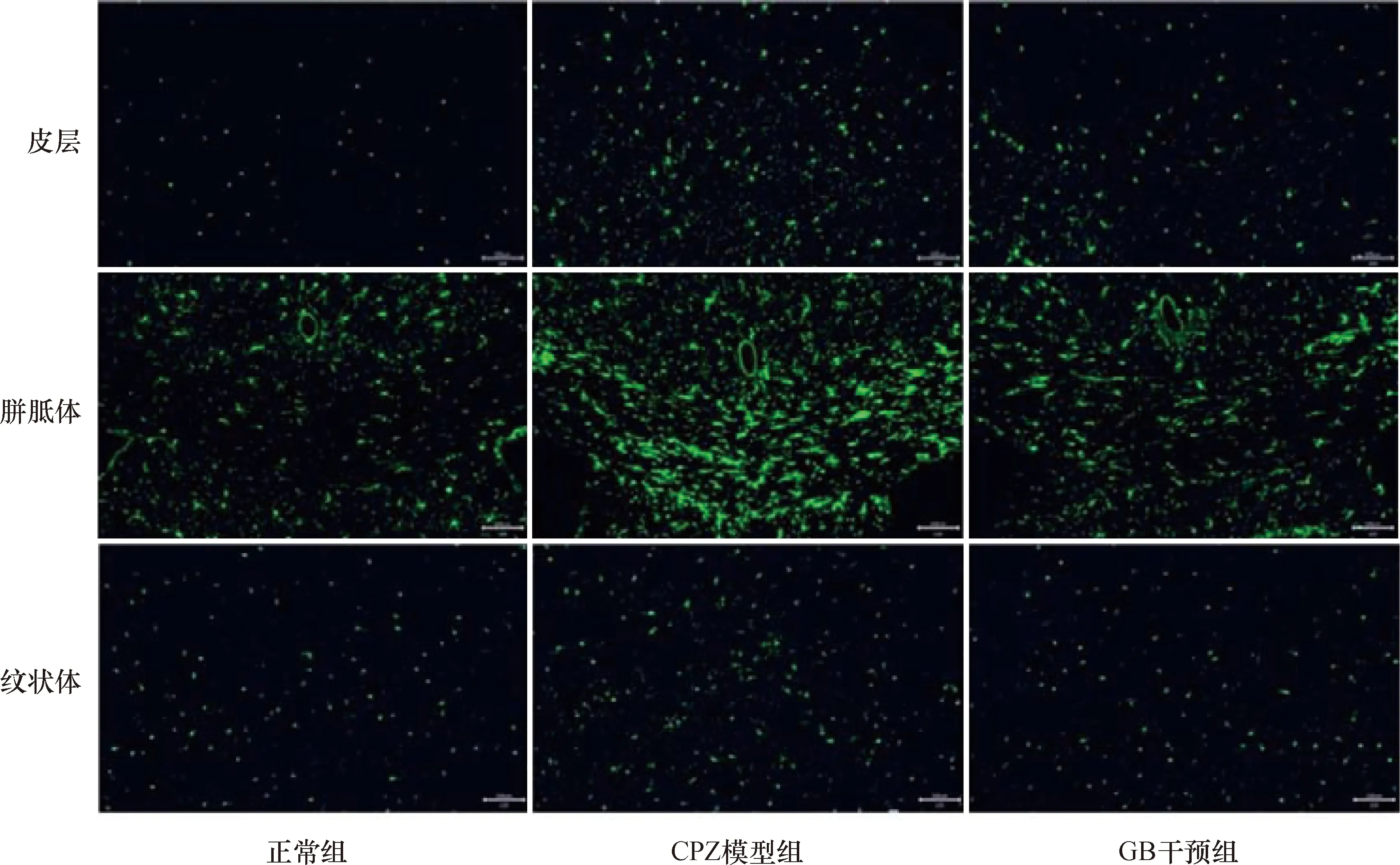
图2 各组小鼠大脑不同部位小胶质细胞表达情况(免疫荧光染色,比例尺=100 μm)
2.4 各组小鼠脑组织Iba-1蛋白表达与正常组比较,CPZ模型组脑匀浆Iba-1蛋白表达升高 (P<0.01);与CPZ模型组比较,GB干预组脑Iba-1蛋白表达降低(P<0.05),结果见图3、表3。
表3 各组小鼠大脑Iba-1蛋白相对表达水平及炎性因子表达水平比较
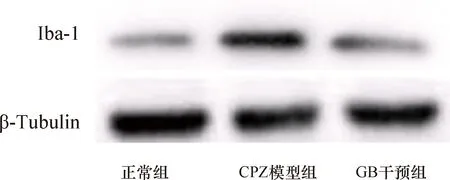
注:Iba-1:钙离子结合衔接分子1图3 各组小鼠脑组织Iba-1蛋白表达电泳图(Western blot)
2.5 各组小鼠脑组织炎性细胞因子表达与正常组比较,CPZ模型组脑炎性因子TNF-α、IL-6和IL-1β水平升高(均P<0.01);与CPZ模型组比较,GB干预组脑炎性因子TNF-α、IL-6和IL-1β水平降低(均P<0.01)。结果见表3。
2.6 各组BV2细胞上清液炎性细胞因子及NO表达与正常组细胞比较,模型组细胞上清液中TNF-α、IL-6、IL-1β及NO水平高(均P<0.01);与模型组细胞比较,GB干预组细胞上清液中TNF-α、IL-6、IL-1β及NO水平低(均P<0.01)。结果见表4。
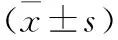
表4 各组BV-2细胞上清中炎性因子及NO表达比较
3 讨论
GB具有广泛的神经保护作用,可促进脑缺血/再灌注损伤大鼠神经干细胞的增殖和分化,改善神经功能[8]。GB通过调节钙内流和细胞内钙释放维持钙稳态,从而保护神经元免受缺氧[9]。在大鼠大脑中动脉闭塞(MCAO)模型中,GB可通过激活蛋白激酶B(Akt)/核因子E2相关因子2(Nrf2)通路保护神经元免受氧化应激损伤[10]。目前尚未检索到有关口服GB是否具有中枢神经系统髓鞘保护和再生作用的研究。
CPZ诱导的脱髓鞘小鼠常伴有焦虑、抑郁和认知等行为障碍[11]。该研究结果显示,CPZ喂食小鼠可出现焦虑、抑郁和认知障碍,而口服GB可改善小鼠上述部分症状;与行为学改善结果一致,病理学染色显示GB可有效改善髓鞘脱失,表明口服GB可能用于治疗脱髓鞘病变。值得注意的是,本实验中GB组的某些行为学指标改善甚至好于正常对照组,但从病理形态学上其髓鞘脱失并未达到正常。作者推测其原因可能为:组织病理学观察脱髓鞘反映疾病是一个相对客观的指标,受其他因素干扰较小,而焦虑、抑郁和认知行为学指标检测受其他影响因素较多,如检测时动物的状态和情绪,可能造成行为学评分结果偏移真实的情况。因此,尽管GB组小鼠多数行为学评分“好于”正常对照组,但并不能得出GB干预可完全使小鼠恢复至正常状态甚至比正常状态更好的结论。
中枢脱髓鞘可导致继发性小胶质细胞活化及由此引起的神经炎症[12]。小胶质细胞神经炎症不仅可直接靶向神经元和少突胶质细胞损伤,还可影响少突胶质前体细胞分化成熟。抑制小胶质细胞的神经炎症,可改善脑内微环境,清除受损及坏死的神经组织,分泌神经营养因子,还能促进少突胶质前体细胞(oligodendrocyte precursor cells,OPC)形成与分化,促进髓鞘再生,改善神经功能[13]。GB抑制小胶质细胞炎性反应的可能机制为:首先,GB是一种PAF受体(platelet activating factor receptor,PAFR)拮抗剂[14],可与血小板上的PAFR特异性竞争抑制,从而阻止PAF引起的血小板聚集。GB具有的特异性PAFR拮抗剂特征是确定PAF生物学作用和PAFR部位结构性质的有效工具,已被应用于创伤性损伤和缺血再灌注模型等多种模型,至今为止是被评价最多的PAFR拮抗剂。其次,PAFR在不同脑区表达,包括下丘脑、大脑皮层、嗅球、海马、脑干和脊髓。在细胞水平上,PAFR主要表达于小胶质细胞,即脑内驻留的免疫细胞[15]。在创伤性脑损伤和缺血再灌注模型中,PAFR缺乏小鼠的脑损伤程度明显小于野生型小鼠,进一步观察发现前者的神经炎症也明显低于后者[16-17]。尽管PAF-PAFR通路在中枢神经系统中的功能尚未明确阐明,但已有证据表明PAF可通过促进小胶质细胞活化而诱导或增强神经炎症,从而以PAFR依赖的方式促进疾病进展和髓鞘脱失[15]。本研究结果显示,GB可改善中枢脱髓鞘小鼠的行为障碍和髓鞘脱失,其作用机制极有可能与GB的PAFR拮抗剂作用有关,可能通过抑制PAF-PAFR通路发挥抑制小胶质细胞神经炎症作用。
综上所述,该研究结果显示,口服GB可改善CPZ诱导的脱髓鞘小鼠的行为学障碍,减轻髓鞘损伤,其作用机制可能与其抑制小胶质细胞活化引起的炎性反应和氧化应激有关,从而改善炎症微环境,发挥髓鞘保护作用。有关GB精准的作用位点仍有待进一步研究。
