Tfh细胞相关作用分子在EAE中的调节作用
2021-10-11沈新月石郑浩任安艳葛汝丽范雪丽
沈新月 石郑浩 任安艳 葛汝丽 范雪丽
多发性硬化(multiple sclerosis,MS)是一种累及中枢神经系统(central nervous system,CNS)的与免疫相关的慢性炎性脱髓鞘疾病,其具体发病机制尚不明确,可能与感染、自身免疫反应、遗传与环境因素有关。既往研究认为MS是自身反应性T细胞介导的自身免疫性疾病[1],但越来越多研究表明体液免疫在MS疾病的形成中不可或缺[2]。滤泡辅助性T细胞(Tfh)是一种重要的辅助B细胞的CD4+Th细胞亚型[3],其定位于生发中心(germinal center,GC),分泌白细胞介素21(interleukin21,IL-21),表达程序性死亡因子-1(programmed death-1,PD-1)、可诱导的共刺激分子(inducible costimulator,ICOS)、转录因子B细胞淋巴6(B cell lymphoma 6,Bcl-6)等[4]。Tfh细胞参与体液免疫反应,对GC形成、B细胞在GC亲和力的成熟、高亲和力抗体和记忆性B细胞的产生至关重要[5]。Tfh细胞功能失调可导致自身免疫性疾病、免疫缺陷病、肿瘤等多种疾病[6]。该研究通过观察实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis,EAE)小鼠脑、脊髓PD-1、ICOS、IL-21的表达情况,探讨Tfh细胞相关作用分子在MS/EAE中的调节作用。
1 材料和方法
1.1 动物选择SPF级6~8周龄C57BL/6雌性小鼠40只,体重(18±2)g,由济南朋悦实验动物繁育有限公司提供,动物许可证号:SCXK(鲁)20140007。置SPF级、恒温(20~24℃)、恒湿(40%~70%)环境饲养,自由进食、饮水。所有操作均符合滨州医学院实验动物伦理委员会规定。将小鼠随机分为对照组和EAE模型组,各20只。剔除死亡及造模失败小鼠,最终对照组18只(死亡2只,余18只未出现症状)、EAE模型组17只(死亡2只,1只未出现明显症状)入组。
1.2 主要试剂及仪器髓鞘少突胶质细胞糖蛋白(myelin oligodendrocyte glycoprotein,MOG)35-55肽段购自美国GenScript公司,完全福氏佐剂(FAC)购自美国Sigma Aldrich公司,灭活结核分枝杆菌(H37Ra)购自美国BD Difco公司,磷酸缓冲盐溶液(PBS)购自美国Gibco公司,百日咳毒素(pertussis toxin,PTX)购自德国Merck Millipore公司,HE染色试剂盒购自Solarbio公司,PCR试剂盒购自Takara公司,IL-21、PD-1、ICOS抗体购自Abcam公司。
1.3 方法
1.3.1EAE模型制备:配制MOG35-55肽段溶液(溶于PBS,浓度为2 mg/mL)、结核分枝杆菌溶液(加至FAC中,浓度为8 mg/mL)、PTX溶液(溶于PBS,浓度为300 ng/mL)。将MOG35-55肽段溶液与结核分枝杆菌溶液等比例混合,充分乳化MOG抗原,给予小鼠200 μg皮下多点注射,并于注射后及48 h腹腔注射PTX溶液。对照组以等量PBS代替MOG35-55肽段溶液,余操作步骤同模型组。
1.3.2EAE小鼠评分:随机取对照组小鼠6只,EAE模型组5只,于主动免疫后的第1天至第29天,每天清晨同一时间对小鼠称重并进行临床表现评分。EAE小鼠评分标准:0分,正常;1分,尾部无力,不能抬起或步态蹒跚;1.5分,尾部无力伴蹒跚步态;2分,除尾部无力外,可见单后肢瘫或双后肢不全瘫;2.5分,小鼠单后肢全瘫伴对侧后肢不全瘫;3分,双后肢全瘫;4分,双后肢瘫且伴前肢单肢或双肢受累;5分,死亡。
1.3.3组织切片的制备:主动免疫后第21天(发病高峰期),随机取EAE模型组及对照组小鼠各6只,将小鼠深度麻醉,用恒流泵灌流,观察小鼠肝脏颜色,变至灰白色时改用4%(质量浓度)多聚甲醛灌注,待小鼠全身僵硬、肝脏质地坚韧,停止灌流。立即取其脑、脊髓组织,进行固定、脱水、透明、浸蜡、包埋,制作石蜡切片备用,片厚4~6 μm,用于HE染色和免疫组化检测。
1.3.4HE染色:依照HE染色盒试剂说明书将脑、脊髓石蜡切片进行脱蜡水化、染色、脱水、透明、中性树胶封固,置光学显微镜下观察小鼠脑、脊髓组织的炎症细胞浸润情况,并采集图片。
1.3.5免疫组化:将上述制备好的脑、脊髓石蜡切片进行脱蜡水化,高压修复后将玻片浸泡至3%(体积分数)H2O2溶液内,避光浸泡15 min,清洗玻片。用免疫组化笔划定组织范围,玻片上滴加山羊血清,置37℃温箱内封闭30 min,清洗玻片。滴加Ⅰ、Ⅱ抗,置37℃温箱内分别放置2 h、30 min,清洗玻片。滴加DAB显色盒中的试剂至玻片显色,经染色、分化、脱水、封片等步骤,置镜下观察ICOS、IL-21、PD-1的表达情况。显微镜下细胞核呈蓝色,脑、脊髓组织ICOS、IL-21、PD-1阳性表达呈棕褐色,采用IPP6.0软件定量分析其阳性染色相应累积光密度值(IOD)。
1.3.6实时荧光定量PCR检测:将发病高峰期(造模后第21天)的剩余EAE小鼠6只及对照组6只断头处死,置冰上快速取脑组织。根据PCR试剂盒(含GAPDH内参、PD-1、ICOS、IL-21引物)说明书进行RNA提取、反转录、扩增等步骤,采用2-△△T法定量分析PD-1、ICOS、IL-21 mRNA水平。
1.4 统计学处理采用SPSS 22.0软件进行统计学分析,符合正态分布的计量资料以均数±标准差表示,两均数间比较采用t检验,多组均数间比较采用重复测量的单因素方差分析,两两比较采用LSD-t法;非正态分布的计量资料以中位数(四分位数间距)表示,采用秩和检验。以P<0.05为差异具有统计学意义。
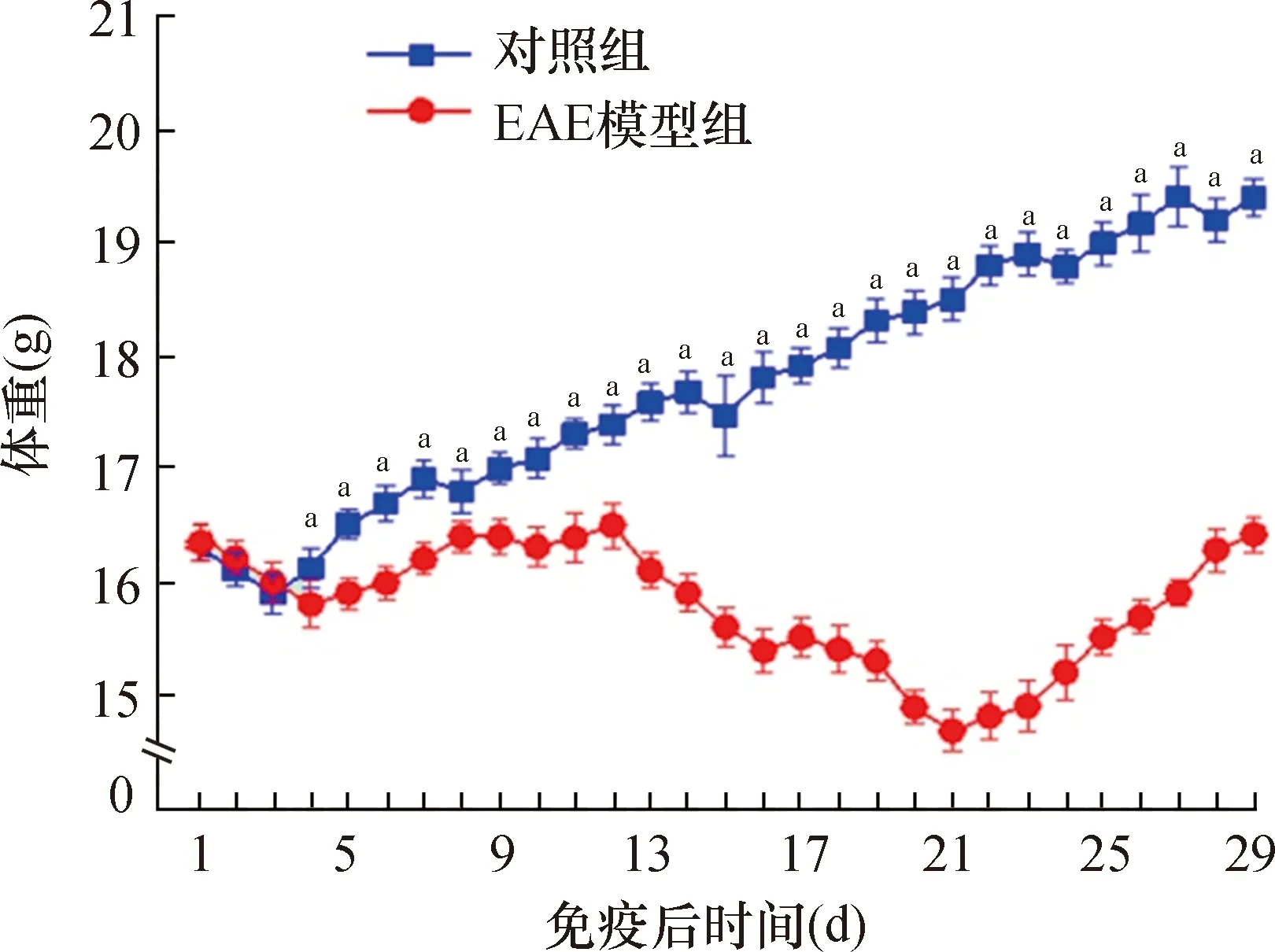
注:EAE:实验性自身免疫性脑脊髓炎,图2~5,表1~2同;与EAE模型组比较,aP<0.05图1 两组小鼠主动免疫后不同时间体重变化
2 结果
2.1 体重变化结果见图1。对照组小鼠随时间延长体重增加(F=89.833,P=0.000);EAE模型组免疫后不同时间点间体重变化有统计学差异(F=174.159,P=0.000),自主动免疫第13天时体重下降,发病高峰(主动免疫后第21天下降最明显,之后体重逐渐增加(均P<0.05)。与对照组比较,EAE模型组小鼠主动免疫后1~3 d体重比较无统计学差异(P>0.05),从第4天开始其体重降低(均P<0.05)。
2.2 EAE小鼠行为学评分EAE模型组小鼠免疫后不同天数间的症状评分比较有统计学差异(F=80.860,P=0.000);对照组小鼠不同天数之间的评分无统计学差异(F=0,P=1)。EAE模型组小鼠于主动免疫后第13天开始发病,第21天症状评分达高峰,随后症状逐渐好转(均P<0.05)。对照组小鼠未出现任何症状,评分均为0分。EAE模型组主动免疫后 1~12 d行为学评分与对照组比较无统计学变化(P>0.05),第13~29天行为学评分高于对照组(均P<0.05)。结果见图2。
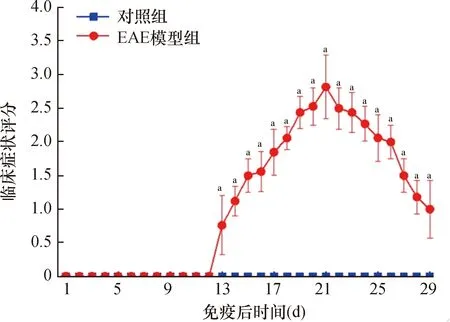
注:与对照组比较,aP<0.05图2 各组小鼠不同时间临床症状评分变化
2.3 病理学改变对照组小鼠脑、脊髓组织中无明显炎性细胞浸润;EAE模型组小鼠脑、脊髓组织可见大量炎性细胞浸润,小血管周围可见炎性细胞浸润,可见袖套样改变。结果见图3。
2.4 免疫组化EAE模型组小鼠脑、脊髓组织中IL-21、ICOS表达较对照组增高,而PD-1表达降低(P<0.05)。结果见表1、图4、图5。
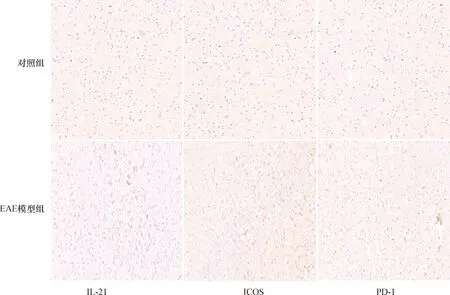
图4 两组小鼠脑组织IL-21、ICOS及PD-1表达(免疫组化,×20)
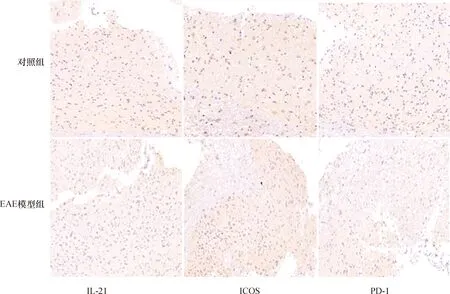
图5 两组小鼠脊髓IL-21、ICOS及PD-1表达(免疫组化,×20)
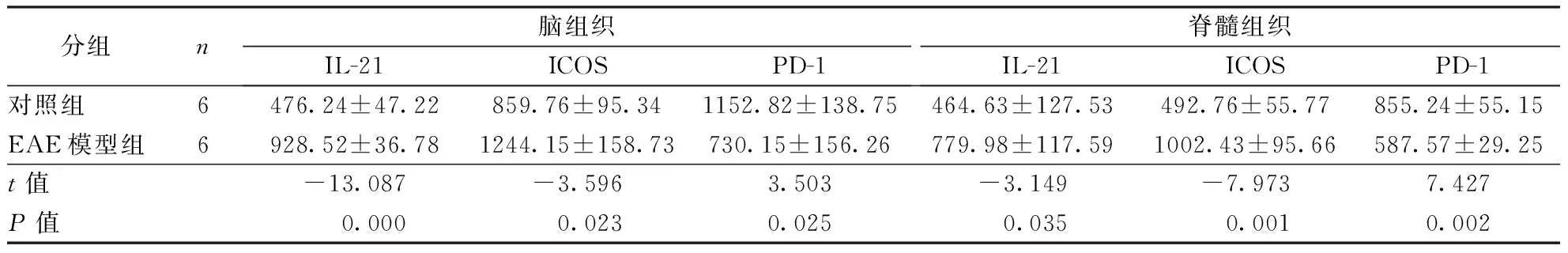
表1 两组小鼠脑和脊髓组织ICOS、IL-21、PD-1表达累积光密度值比较
2.5 实时荧光定量PCR与对照组比较,EAE模型组脑组织PD-1 mRNA相对表达量降低,而ICOS、IL-21 mRNA相对表达量增高(P<0.05)。结果见表2。
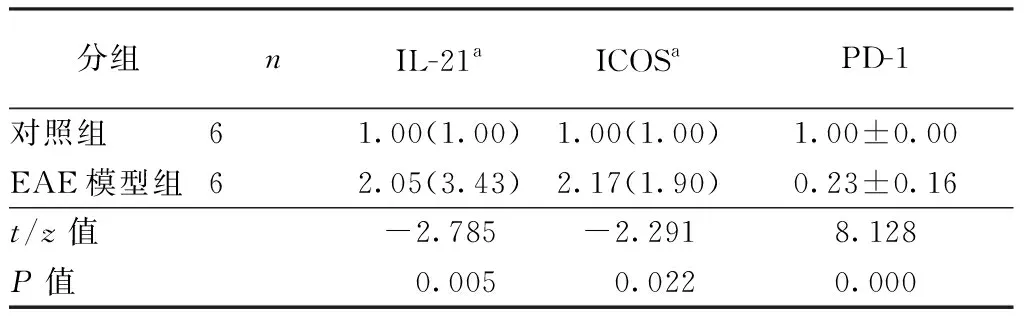
表2 两组小鼠脑组织PD-1、ICOS、IL-21 mRNA相对表达水平比较
3 讨论
MS是一种累及中枢神经系统的与免疫相关的慢性炎性脱髓鞘疾病,表现为脱髓鞘、轴突损伤、炎症细胞浸润和反应性星形胶质细胞增生[7]。该研究Tfh细胞在体液免疫反应中发挥重要作用,能够辅助B细胞分化成浆细胞和记忆性B细胞。Tfh细胞表达的ICOS、PD-1及其分泌的IL-21,对Tfh细胞和B细胞的活化、分化和存活至关重要。Tfh细胞及其相关分子的异常可导致致病性自身抗体的产生,继而引发自身免疫疾病。Rikke等[9]研究表明,MS患者中的Tfh细胞活性增强。作者团队既往研究表明MS、NMOSD患者外周循环中的记忆性Tfh细胞数量增多[10],可能参与疾病的发病机制。
该研究结果显示EAE小鼠脑、脊髓组织Tfh细胞表达的ICOS水平增高。这与Guo等[11]研究结果相一致。Guo等[11]研究发现,EAE小鼠脊髓组织ICOS水平表达增高,且在发病高峰期达高峰。推测ICOS水平升高可能对MS/EAE的发病有促进作用。Tfh细胞表达的ICOS与其配体(ICOSL)结合,可促进Tfh细胞和GC的形成,阻断ICOS-ICOSL通路可能抑制Tfh细胞的功能,因此抗ICOS/ICOSL单抗治疗可能成为难治性或严重自身免疫性疾病的潜在治疗办法[12]。
该研究结果显示EAE小鼠脑、脊髓组织IL-21表达水平较对照组高。IL-21在GC B 细胞的增殖、生存和分化以及Tfh细胞的生存中发挥主要作用[13],也是最有效促进浆细胞分化的细胞因子[14]。在MS患者的活动性病灶中,分泌IL-21的CD4+T细胞可进一步促进Tfh细胞的活化[15]。Gharibi等[16]亦报道了MS患者炎性细胞浸润病变部位的淋巴细胞中IL-21呈高表达。推测IL-21水平的升高可能与EAE/MS的严重程度和进展呈正相关。
既往研究发现,破坏BALB/c小鼠PD-1的编码基因可致自身免疫性心脏病;敲除PD-1的C57BL/6小鼠可出现渐进性关节炎、狼疮样肾小球肾炎以及急性自身免疫性糖尿病[17-19]。Haile等[20]研究表明PD-1缺陷的EAE小鼠症状更为严重。该研究结果显示,EAE小鼠脑、脊髓组织PD-1的表达水平较对照组小鼠降低。因此作者推测,PD-1在MS/EAE的发病中起负性调节作用,并可能成为治疗靶点。
综上所述,该研究结果显示,EAE模型组小鼠脑、脊髓组织IL-21、ICOS及其mRNA表达较对照组增高,而PD-1及其mRNA表达低,提示上述分子可能参与了EAE的发病,并可能成为治疗疾病的新靶点。有关Tfh细胞及其相关作用分子在MS/EAE中的确切作用尚需进一步研究,为临床治疗提供更充分的依据。
