散发性肌萎缩侧索硬化患者骨骼肌病理改变特点及其与疾病进展的相关性
2021-10-08朱文佳欧阳雅声邸丽卢岩王敏文欣玫朵建英栾沁榕李存江笪宇威
朱文佳 欧阳雅声 邸丽 卢岩 王敏 文欣玫 朵建英 栾沁榕 李存江 笪宇威
肌萎缩侧索硬化(amyotrophic lateral sclerosis,ALS)是一种渐进性、致死性神经系统变性病,是运动神经元病中最常见的类型,年发病率约为(2~3)/10万[1]。ALS主要临床核心症状为上、下运动神经元同时受累表现,如肌无力、肌萎缩、肌束颤动、腱反射活跃或亢进、病理征阳性等。目前该病发病机制尚不明确,主要涉及基因易感[2]、谷氨酸兴奋性毒性[3]、氧化应激损伤[4]、线粒体功能障碍[5]以及异常蛋白聚集[6]等。ALS患者在出现临床症状或体征前,肌电图检查可能发现广泛失神经及神经再支配现象。骨骼肌是运动神经元的效应器及运动神经元变性的靶器官,从病理上骨骼肌主要分为Ⅰ型(慢收缩型)和Ⅱ型(快收缩型)。研究结果显示,脊髓运动神经元变性常导致Ⅱ型肌纤维首先受累,而Ⅰ型肌纤维受累较轻,甚至出现轻度肥大[7]。
临床发现,ALS患者电生理改变是建立在病理改变的基础上,但患者在不同疾病阶段以及不同疾病进展速度下骨骼肌病理改变是否存在差异尚不清楚。本研究回顾性分析了散发性ALS(sporadic ALS,sALS)患者症状前期和症状期骨骼肌病理改变特点,并探讨了骨骼肌病理改变与疾病进展速率的相关性。
1 对象和方法
1.1 对象回顾性分析2011年4月至2018年3月就诊于首都医科大学宣武医院神经内科的sALS患者29例,其中男18例,女11例。入组标准:(1)行肌肉活检提示神经源性损害;(2)随访时符合世界神经病学联盟的修订版ALS诊断标准[8]中的“临床确诊(clinically definite)”或“临床很可能(clinically probable)”标准,同时除外其他可导致骨骼肌神经源性损害的疾病。
1.2 方法
1.2.1临床资料采集:包括性别、年龄、病程、活检部位肌力(徒手肌力法,0~5级)、ALS功能评分量表修订版(ALS functional rating scale-revised,ALSFRS-R)、疾病进展速率(progression rate,PR)评估。PR计算公式:PR=(48-ALSFRS-R评分)/疾病病程(月)。
1.2.2分组:(1)根据患者活检部位肌力异常情况分为症状前期(活检部位肌力=5级)和症状期(活检部位肌力<5级);(2)根据患者PR中位数分为缓慢进展组(PR≤中位数)和快速进展组(PR>中位数)。
1.2.3骨骼肌病理检:取肱二头肌或三角肌组织标本,经异戊烷及液氮冰冻包埋处理后置-80℃冰箱备用。行组织切片(片厚8 μm),行HE、GT染色观察角形萎缩肌纤维及小组样萎缩情况,行NADH、SDH染色观察靶及靶样纤维,行ATPase染色(pH分别为4.2、9.5)观察群组化及两型肌纤维分布情况,每种染色取2张切片,选择染色成像较好的切片置光学显微镜下观察患者3束不同肌束内分别出现角形萎缩肌纤维数目、小组样萎缩、群组化及靶纤维数目,均以最高值进行分级。计算角形萎缩肌纤维中Ⅰ型和Ⅱ型肌纤维百分比(Ⅰ型或Ⅱ型角形萎缩肌纤维数/角形萎缩肌纤维总数×100%)以及群组化中Ⅰ型和Ⅱ型肌纤维各自群组化百分比(Ⅰ型或Ⅱ型肌纤维群组化数/群组化总数目×100%)。
(1)肌纤维萎缩程度分级:①无小组样萎缩:仅有散在的角形萎缩肌纤维;②轻度小组样萎缩:1束肌纤维内成组的角形萎缩肌纤维为3~15个;③重度小组样萎缩:肌束内成组的角形萎缩肌纤维大于15个。
(2)角形萎缩肌纤维中,两型肌纤维受累分布:①Ⅰ型肌纤维萎缩为主:Ⅰ型萎缩肌纤维比例达60%及以上;②Ⅱ型肌纤维萎缩为主:Ⅱ型萎缩肌纤维比例达60%及以上;③两型肌纤维均等受累:两型肌纤维萎缩所占比例无明显差别。
(3)肌纤维群组化分级:①Ⅰ型肌纤维群组化为主:Ⅰ型肌纤维群组化数目比例占群组化肌纤维比例达60%及以上;②Ⅱ型肌纤维群组化为主:Ⅱ型肌纤维群组化数量比例达60%及以上;③两型肌纤维均等:两类肌纤维群组化现象无明显差别。
(4)靶纤维化程度分级:①无靶纤维化:3束肌纤维中均未见靶及靶样肌纤维;②轻度靶纤维化:每束肌纤维内靶样纤维数目小于等于15个;③重度靶纤维化:每束肌纤维内靶样纤维数目大于15个。
1.2.4神经再生支配代偿程度:小组样萎缩代表着失神经改变,而群组化现象为神经再支配改变。根据上述分级标准,分别将小组样萎缩程度分为无(1分),轻度(2分)和重度(3分),将群组化程度分为无(1分),低(2分,Ⅰ型/Ⅱ型肌纤维群组化数量比例小于60%)以及高(3分,Ⅰ型/Ⅱ型肌纤维群组化数量≥60%)。按下列公式计算神经再生支配代偿程度:神经再生支配代偿程度=群组化程度/小组样萎缩程度。神经再生支配代偿程度<1提示患者代偿较差,≥1提示患者代偿良好。
1.3 统计学处理采用SPSS 24.0软件进行统计学分析,计数资料以率表示,采用卡方检验和Fisher精确概率法;符合正态分布的计量资料以均数±标准差表示,两组均数比较采用t检验;非正态分布的计量资料以中位数(四分位数间距)表示,组间比较采用Mann-WhitneyU检验。以P<0.05表示差别具有统计学意义。
2 结果
2.1 临床特征比较29例sALS患者PR中位数0.75分/月,四分位数间距为1.40分/月,以中位数0.75分/月为界分组,其中缓慢进展组15例,快速进展组14例。与快速进展组比较,缓慢进展组病程更短,ALSFRS-R评分更高,PR更慢(均P<0.05),而两组间性别构成、发病年龄、起病部位及活检部位肌力正常者占比比较无统计学差异(均P>0.05)。结果见表1。
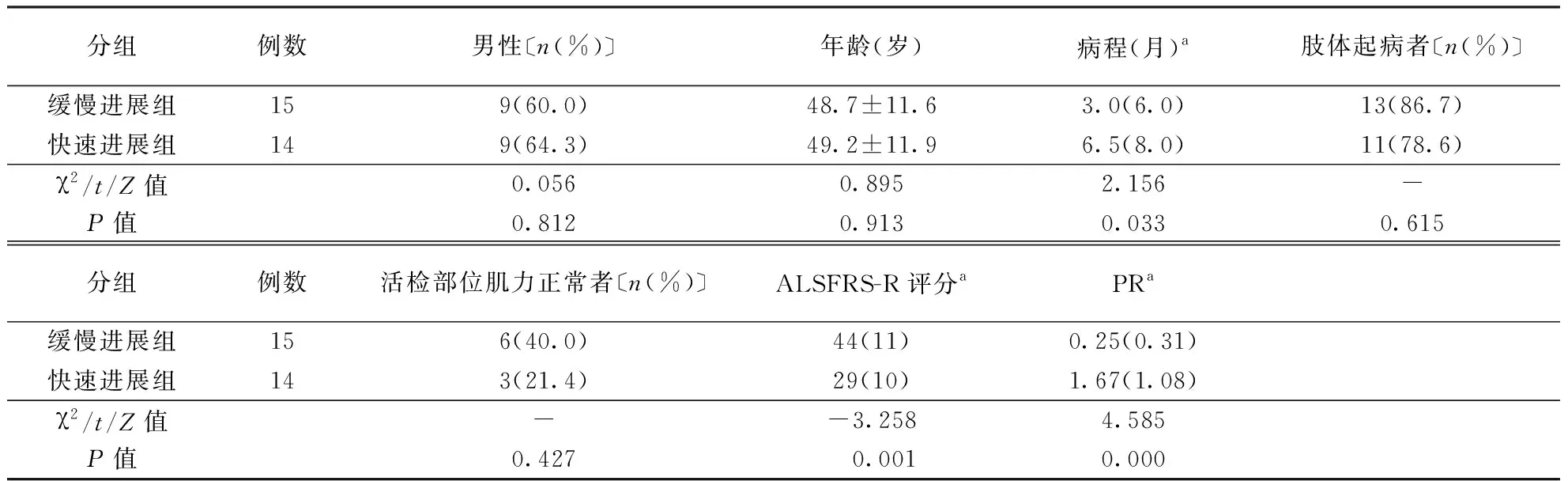
表1 两组sALS患者临床资料比较
2.2 骨骼肌病理改变29例患者HE及GT染色均可见肌纤维大小不等,角形萎缩的肌纤维呈散在或小组样分布(图1A、B)。部分患者病理切片NADH染色可见靶纤维(图1C)。ATP酶染色(pH值4.2)可见萎缩的肌纤维累及两型或/和群组化现象(图1D)。
2.3 不同疾病阶段肌纤维的萎缩及群组化症状前期(n=9)和症状期(n=20)患者Ⅰ、Ⅱ型肌纤维均存在失神经改变,偶可见Ⅰ型或Ⅱ型肌纤维萎缩为主的病理改变。症状前期和症状期患者间发生不同类型肌纤维萎缩患者构成无统计学差异(P>0.05)。症状前期患者骨骼肌纤维均存在群组化现象,症状期患者存在肌纤维群组化患者占85%,两组患者发生不同类型肌纤维群组化者构成无统计学差异(P>0.05)。结果见表2~3。
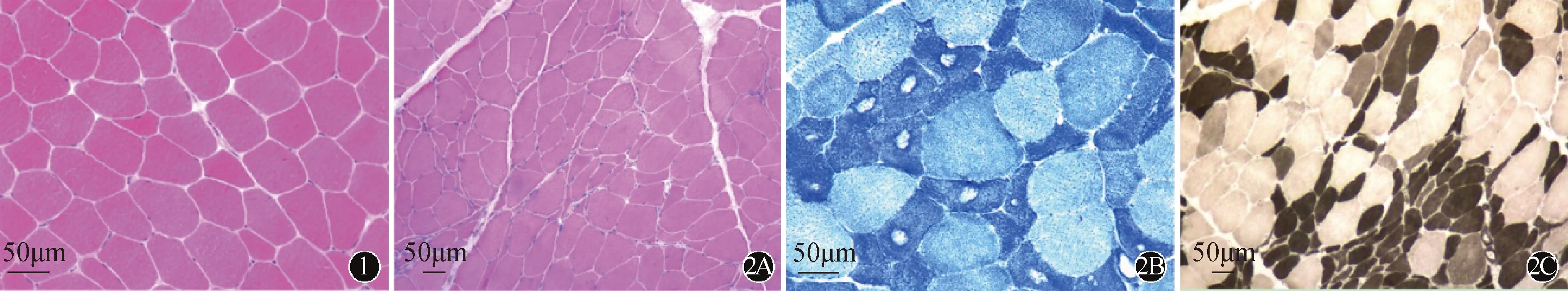
注:sALS:散发性肌萎缩侧索硬化图1 某例sALS患者左侧肱二头肌肌肉活检病理学检查结果(HE染色):角形萎缩肌纤维呈散在分布 注:sALS:散发性肌萎缩侧索硬化图2 某例ALS患者左侧三角肌肌肉活检病理学检查结果:角形萎缩肌纤维呈小组样分布(A,HE染色),肌纤维中靶及靶样纤维(B,NADH染色),肌纤维高度群组化(C;ATPase染色,pH4.2)

表2 不同疾病阶段sALS患者骨骼肌小组样萎缩构成比较〔n(%)〕

表3 不同疾病阶段sALS患者骨骼肌群组化构成比较〔n(%)〕
2.4 PR与骨骼肌病理改变的关系29例患者中,出现小组样萎缩患者25例(86.2%),出现靶纤维的患者12例(41.4%),出现群组化的患者26例(89.7%)。缓慢进展组(n=15)和快速进展组(n=14)出现小组样萎缩、群组化及靶纤维改变的患者分布无统计学差异(P>0.05)。结果见表4。
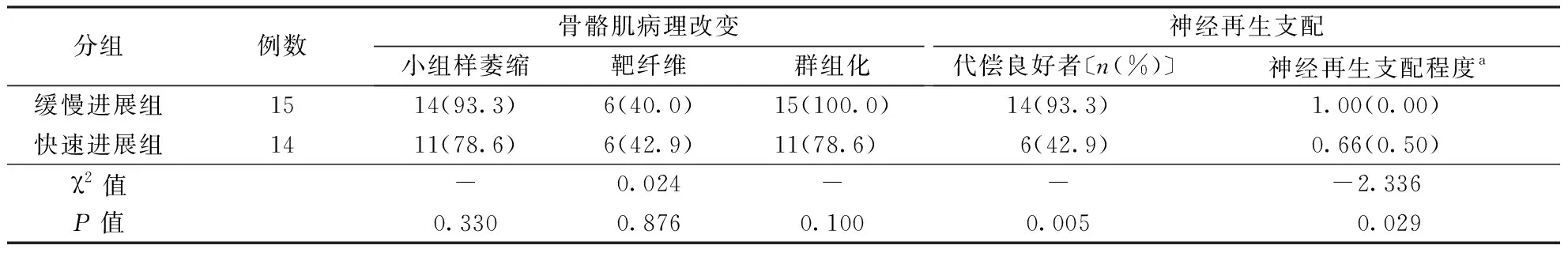
表4 两组sALS患者骨骼肌病理改变特点〔n(%)〕
2.5 神经再生支配代偿程度与PR的关系缓慢进展组神经再生支配代偿程度良好者占比高于快速进展组,神经再生支配代偿程度更高(P<0.01,P<0.05)。结果见表4。
3 讨论
该研究发现,无论是症状前期还是症状期,sALS患者Ⅰ、Ⅱ型肌纤维均存在失神经损害(角形萎缩肌纤维呈小组样分布)及神经再生支配(靶纤维化及群组化)的病理改变,而症状前期患者及缓慢进展组患者骨骼肌纤维均存在群组化现象提示神经再生支配良好。不同疾病阶段sALS患者发生Ⅰ、Ⅱ型肌纤维萎缩及群组化者的构成比较无统计学差异。这与既往部分研究结果相符,也印证了ALS是一种急、慢性失神经并存神经系统变性疾病。此外,该研究结果显示,不同PR患者间出现小组样萎缩、靶纤维及群组化的患者分布无统计学差异;进一步研究发现疾病进展缓慢患者的神经再生支配的程度明显升高,提示神经再生支配程度较失神经对ALS患者的疾病进展的影响可能更大。在患者失神经程度无统计学差异的情况下,神经再生程度高的患者,其骨骼肌萎缩无力症状更轻,ALSFRS-R评分下降少,PR更慢[9-10]。电生理研究显示运动单位数目估计(motor unit number estimation,MUNE)下降快的患者ALSFRS-R评分下降也快[11-12],表明神经再生支配与ALS的疾病进程相关。
既往研究结果显示,SOD1G93A小鼠存在选择性运动单位丢失,支配Ⅱ型肌纤维的运动神经元更易发生变性,且这种选择性损害在ALS小鼠终身存在,而支配Ⅰ型肌纤维的运动神经元则会再生代偿支配失神经的骨骼肌[13]。上述现象可能与支配运动单位的运动神经元有关,支配快运动单位的运动神经元的胞体大,轴索直径宽,神经支配率高,对能量的需求量大,进而导致其抗损伤能力弱[14]。然而一项针对6例小样本ALS患者的尸检研究发现,ALS患者角形萎缩肌纤维可累及两型,有轻度的肌纤维群组化,并非选择性Ⅱ型运动单位受累,偶可见轻度Ⅰ型或Ⅱ型肌纤维占优势[15]。该研究发现,在sALS患者的不同临床阶段不存在Ⅱ型运动单位更易受损的情况,这与Hegedus等[13]研究结果显示的SOD1G93A小鼠Ⅱ型肌纤维选择性受累且受累程度更重的结果不符。其原因可能与ALS发病机制复杂而SOD1G93A小鼠模型发病机制较单一有关。SOD1G93A小鼠的发病机制主要是氧化应激障碍,其出现选择性Ⅱ型肌纤维的运动单元丢失可能与两型肌纤维的活性氧代谢相关,Ⅱ型肌纤维中的H2O2含量是Ⅰ型纤维的3倍[16-17],但Ⅰ型肌纤维中的超氧化物歧化酶1型[18]及过氧化氢酶[19]的活性较Ⅱ型肌纤维的活性更高。因此,当SOD1基因突变致超氧化物歧化酶功能障碍时,Ⅱ型肌纤维更易遭受氧化应激损伤。该研究未发现Ⅱ型肌纤维更易受损及Ⅰ型肌纤维明显代偿增多现象。
综上所述,该研究发现sALS患者骨骼肌并无选择性肌纤维受累现象,并且神经再生支配代偿程度越高的患者疾病进展更加缓慢,提示可从促进骨骼肌神经再生支配的角度着手,探索延长ALS患者生存期的药物靶点。
