晒烟品种塘蓬烟抗白粉病基因的等位性测定和序列分析
2021-09-26林世锋王仁刚潘飞任学良龙明锦王自力
林世锋,王仁刚*,潘飞,任学良,龙明锦,王自力
1 贵州省烟草科学研究院,烟草行业分子遗传重点实验室,贵阳市观山湖区龙滩坝路29号 550081;
2 上海农科种子种苗有限公司,上海市闵行区北翟路2901号 201106
烟草白粉病俗称“上硝”、“发白”或“下霜”,该病在烟草生长的中后期普遍发生,其病原菌主要侵染烟草叶片,严重时也蔓延至茎、叶柄、花梗、蒴果等多个部位,造成烟苗整体素质下降,体内重要防御酶活性改变[1]。发病部位通常从下部叶开始,逐渐向上蔓延,严重时叶片全部脱落,仅剩叶脉[2]。此病最显著的特征是在叶片正反两面和病茎上着生一层白粉,发病较轻的叶片在其调制过程中病斑仍会继续扩大,叶片薄如纸状,易破碎呈糊片,缺乏弹性,严重时烟叶失去烘烤价值。据报道,烟草白粉病菌除危害烟草外,还能侵染胡萝卜科、茄科、菊科、蔷薇科、豆科和旋花科等多种植物,给防治带来一定困难[3]。因此,采用遗传学方法从遗传本质上提高烟草对白粉病的抗性,开展抗病育种是防治烟草白粉病最经济、有效,且对环境与人畜安全的方法。目前,一些抗白粉病品种已在国内外培育和种植(如Kutsaga E1、Kutsaga 110、Tsukuba 1、台烟7号),其中大多数抗病品种的抗性是由两个隐性基因控制的,其抗性基因来源于栽培品种Kokubu(syn. Kou-fan)[4]。
Mildew resistance locus O(MLO)蛋白是植物特有的一类蛋白家族,其中的部分成员是白粉病菌成功侵染寄主植物的必要因子[5]。一个或多个MLO基因的功能缺失突变可赋予植物对白粉病菌广谱且持久的抗性。已知烟草品种Tsukuba 1和Kutsaga E1的白粉病抗性均来源于烟草品种Kokubu,2016年,Fujimura等[4]通过比较烟草白粉病抗病品种(Tsukuba 1)和感病品种(K326)中NtMLO1/2基因的cDNA和gDNA序列,发现在抗病品种Tsukuba 1中上述同源基因发生突变,随后研究者采用单链构象多态性方法(single-strand conformation polymorphism,SSCP)对抗病品种Tsukuba 1与感病品种Xanthi的杂交F2群体的基因型和分离比率进行了分析。结果显示F2群体抗感植株符合双隐性基因控制的质量性状1:15的分离比率,且所有抗病植株的基因型为NtMLO1/2基因双突变纯合子。同样,将NtMLO1/2基因分别在抗病品种Kokubu中过表达,转基因植株都表现出与野生型相同的感病水平。上述结果表明,NtMLO1/2基因为烟草白粉病隐性抗病基因,即感白粉病基因,来源于Kokubu的白粉病抗性是由NtMLO1/2两个同源基因的隐性突变所导致。除此之外,研究显示日本抗白粉病烟草品种Izumi和Maru-ha与Kokubu具有相同的NtMLO1和NtMLO2基因突变序列[4]。
我国晒晾烟资源之丰富,为其他国家所不及,其中在白粉病抗性方面最为著名的是广东廉江县的晒烟品种“塘蓬烟”[6],但到目前为止针对塘蓬烟的白粉病抗性机制未见深入报道。本研究通过等位性测验了解塘蓬烟与已知抗病材料之间的抗性位点异同,利用PCR克隆技术获得塘蓬烟NtMLO1/2基因的cDNA和gDNA序列信息。结果显示,塘蓬烟白粉病抗性同样由(隐性)突变NtMLO1/2基因控制,其中NtMLO2基因的mRNA发生外显子重复突变,形成一个新的可变剪接变异体。本研究从分子水平阐述了地方烟草品种塘蓬烟的抗白粉病机制,其结果不仅丰富了烟草抗白粉病基因资源信息,而且为日后抗性基因资源的深入研究和合理利用提供了参考依据。
1 材料与方法
1.1 试验材料
抗白粉病烟草品种塘蓬烟、Kutsaga E1和感白粉病烟草品种K326及其他供试烟草种质资源均由贵州省烟草科学研究院品种选育三室提供。以Kutsaga E1、K326作母本和塘蓬烟作父本进行杂交获得各自F1代杂交种材料,用于塘蓬烟中白粉病抗性基因的等位性检测。
1.2 白粉病菌人工接种
用于抗性鉴定的烟草白粉病致病菌二孢白粉菌(Erysiphe cichoracearum DC)由贵州省烟草科学研究院品种选育三室分离和保存。抗白粉病测试采用常规孢子抖落接种法[7-8]。
1.3 烟草基因组DNA的提取
采用AxyPrep基因组DNA小量制备试剂盒(Axygen)提取烟草基因组DNA,并通过紫外分光光度法(Nanodrop)和琼脂糖凝胶电泳法初步检测基因组DNA的提取质量。
1.4 烟草RNA提取和cDNA合成
采用Invitrogen公司的Trizol试剂盒提取总RNA。cDNA第一链的合成按照TaKaRa公司的PrimeScriptTMⅡ 1st Strand cDNA Synthesis Kit说明书进行操作。
1.5 烟草NtMLO1和NtMLO2基因的特异分子标记检测
根据文献报道[9]合成NtMLO1和NtMLO2突变型等位基因的共显性分子标记引物(表1),对塘蓬烟NtMLO1和NtMLO2等位基因进行PCR扩增试验。
1.6 烟草NtMLO1和NtMLO2基因的全长序列扩增
设计合成NtMLO1和NtMLO2基因全长序列扩增引物(表1),以烟草cDNA或基因组DNA为模板扩增NtMLO1和NtMLO2基因全长序列。PCR扩增体系:TaKaRa LA Taq酶0.25 μL,10×LA Taq BuferⅡ2.5 μL,dNTP Mix 2 μL,正 向 引 物(10 μmol/L)1 μL,反向引物(10 μmol/L)1 μL,模板1 μL,加入ddH2O补平到25 μL。PCR扩增程序:94℃预变性3 min,94℃变性30 s,94℃变性30 s,52℃退火30 s,72℃延伸1 min(30个循环),最后72℃延伸10 min。PCR产物电泳检测,送上海生工TA克隆测序。
1.7 烟草资源中NtMLO2基因SNP位点的遗传多态性分析
根据塘蓬烟中检测到的3个NtMLO2基因SNP位点(S1679,S3659,S3713)序列设计共显性分子标记引物(表1),对数个晒烟和烤烟品种进行PCR扩增试验,以分析烟草资源中3个SNP位点的遗传多态性,探讨3个SNP位点在塘蓬烟NtMLO2基因转录本可变剪接过程中是否发挥作用。
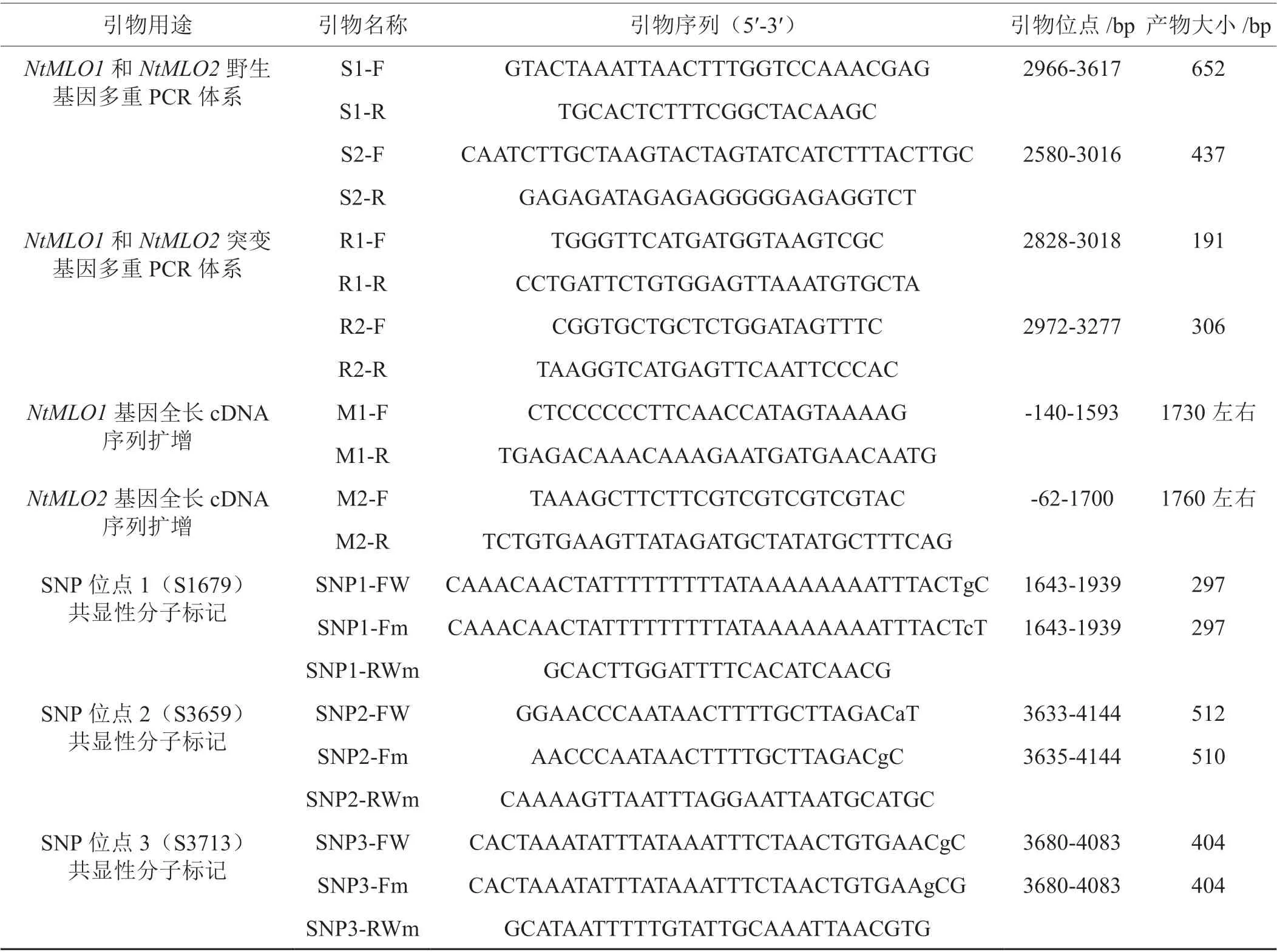
表1 本研究所用引物序列Tab. 1 Primers used in this study
2 结果
2.1 塘蓬烟中白粉病抗性基因的等位性检测
已知烤烟品种Kutsaga E1的白粉病抗性是由NtMLO1和NtMLO2基因的双隐性突变所导致[4]。为检测抗白粉病晒烟品种塘蓬烟与Kutsaga E1对白粉病抗性间的等位性关系,利用塘蓬烟与Kutsaga E1及感病品种K326配制抗抗及抗感杂交组合,通过常规孢子抖落接种法进行鉴定。结果显示,塘蓬烟与Kutsaga E1配制抗抗组合的F1代均表现为抗病,而塘蓬烟与K326配制抗感组合的F1代均表现为感病(图1)。此外,对塘蓬烟与K326构建的500个单株的F2群体所进行的白粉病抗性鉴定结果显示,群体内抗病单株为30株,感病单株为470株,抗感分离比约为1:15。上述结果表明,塘蓬烟与Kutsaga E1的白粉病抗性基因间具有等位性,白粉病抗性同样由两个相互独立的隐性基因控制,即推断塘蓬烟的白粉病抗性是由感病基因NtMLO1和NtMLO2的双隐性突变造成的。

图1 烟草杂交组合(F1)及其亲本苗期接种白粉病菌后叶片症状表现Fig.1 Leaf symptoms of tobacco F1 hybrid combinations and their parents inoculated with the powdery mildew fungus at seedling stage
2.2 NtMLO1和NtMLO2基因的特异分子标记检测
利用建立的多重PCR方法[9],对NtMLO1和NtMLO2基因已报道的2个突变位点进行检测。结果显示,抗病品种Kutsaga E1在突变基因多重PCR体系中产生191 bp和306 bp的特异性条带,在野生基因多重PCR体系中无条带,感病品种K326在野生基因多重PCR体系中产生437 bp和652 bp的特异性条带,在突变基因多重PCR体系中无条带,符合多重PCR体系扩增的预期结果;与抗病品种Kutsaga E1不同的是,抗病品种塘蓬烟在突变基因多重PCR体系中只产生一条代表NtMLO1突变型等位基因的191 bp的特异性条带,在野生基因多重PCR体系中产生一条代表NtMLO2野生型等位基因的437 bp的特异性条带,推测塘蓬烟中NtMLO1基因的突变类型与已报道的基因突变类型一致,NtMLO2基因的突变类型与已报道的基因突变类型不同,需要做进一步的研究。
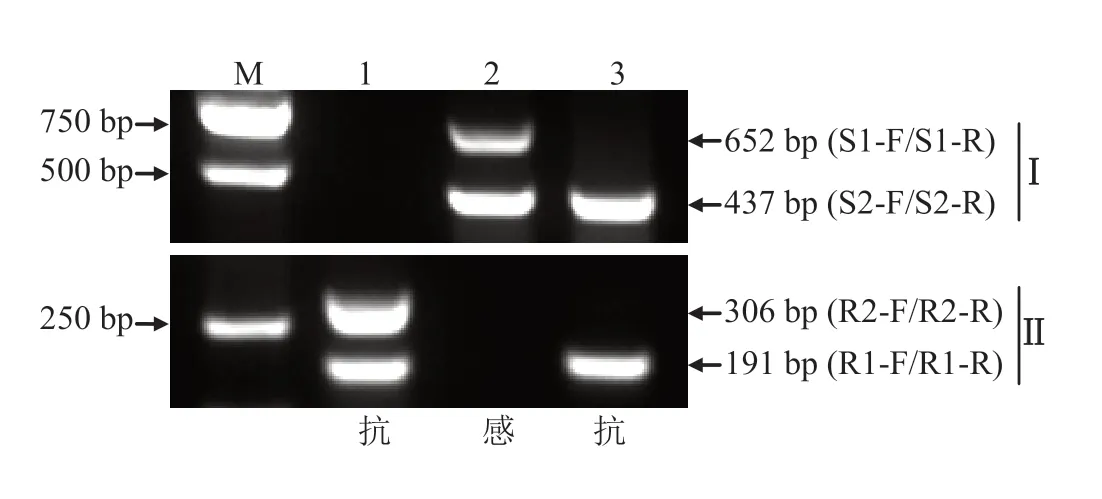
图2 塘蓬烟中NtMLO1和NtMLO2基因的多重PCR检测结果Fig.2 Multiplex-PCR assay of NtMLO1 and NtMLO2 genes of tobacco variety Tangpeng
2.3 NtMLO1和NtMLO2基因的cDNA序列克隆及分析
以塘蓬烟及对照品种K326的cDNA为模板,利用全长基因引物进行PCR扩增得到NtMLO1/2基因条带,见图3。纯化目的片段,连接T载体,转化,随机挑取40个阳性克隆进行测序。结果发现,与文献报道的抗病品种Tsukuba 1相同,塘蓬烟NtMLO1基因的转录本出现了外显子8跳跃(del5,deletion of exon 8)、内含子7保留(add,insertion of intron 7)和内含子6可变的3′剪接位点(del3、del4)等3种可变剪接方式(图4a);不同的是,塘蓬烟NtMLO2基因的转录本上出现了1个重复的外显子6序列(add,insertion of exon 6)(图4b),推测可能的机制是反式剪接将两个相互独立的mRNA上的外显子连接成为一个转录本(图4c),而文献报道在抗病品种Tsukuba 1中NtMLO2基因转录本的可变剪接方式是内含子6出现可变的5′剪接位点。
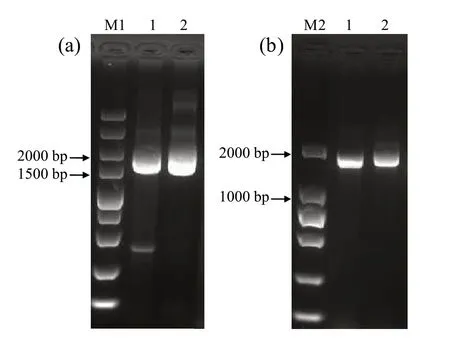
图3 烟草NtMLO1/2基因的全长cDNA序列的PCR扩增Fig.3 PCR amplification of the full-length cDNA sequences of NtMLO1/2 genes in tobacco
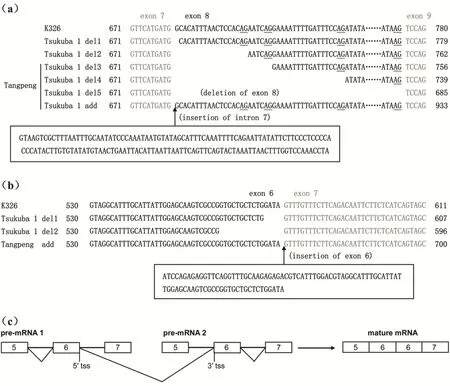
图4 来自K326、Tsukuba 1和塘蓬烟的NtMLO1/2基因的cDNA序列比对Fig.4 Alignment of the full-length cDNA sequences of NtMLO1/2 genes from K326, Tsukuba 1 and Tangpeng
2.4 NtMLO1和NtMLO2基因的DNA序列克隆及分析
通过对塘蓬烟NtMLO1基因全长核苷酸序列的克隆测序,发现在该基因内含子7的3’端末尾的两个核苷酸AG突变为TA(图5a),这一点与文献报道白粉病抗病品种Tsukuba 1一致,推断该突变是造成塘蓬烟中NtMLO1基因转录本发生错误剪接的原因。同时,通过对塘蓬烟NtMLO2基因全长核苷酸序列的克隆测序,发现塘蓬烟和Tsukuba 1一样,在基因内含子5和6中存在三个碱基发生替换突变(S1679,S3659,S3713)(图5b),但与Tsukuba 1不同的是塘蓬烟在内含子6中并未发生两个碱基AG的缺失突变,至于三个碱基的替换突变是否是造成塘蓬烟NtMLO2基因转录本发生错误剪接的根本原因还不得而知。
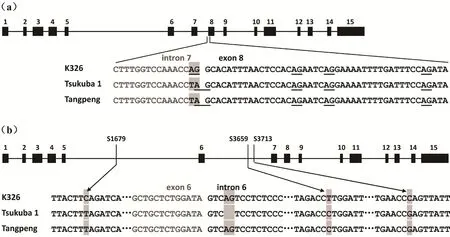
图5 来自K326、Tsukuba 1和塘蓬烟的NtMLO1/2基因的基因组DNA序列比对Fig.5 Alignment of the full-length genomic DNA sequences of NtMLO1/2 genes from K326, Tsukuba 1 and Tangpeng
为了检测塘蓬烟NtMLO2基因内含子5和6中存在的三个突变碱基是否是晒烟和烤烟间存在的普遍差异,我们根据碱基差异设计共显性分子标记引物对一些晒烟和烤烟进行PCR扩增,发现相对于烤烟品种,三个碱基的突变在晒烟中普遍存在(图6),对这些晒烟品种NtMLO2基因的cDNA扩增测序结果显示,这些晒烟品种中NtMLO2基因没有发生错误剪接。由此看来,塘蓬烟NtMLO2基因内含子5和6中存在的三个SNP位点可能不是其转录本发生可变剪接的根本原因,这一问题有待于进一步深入研究。
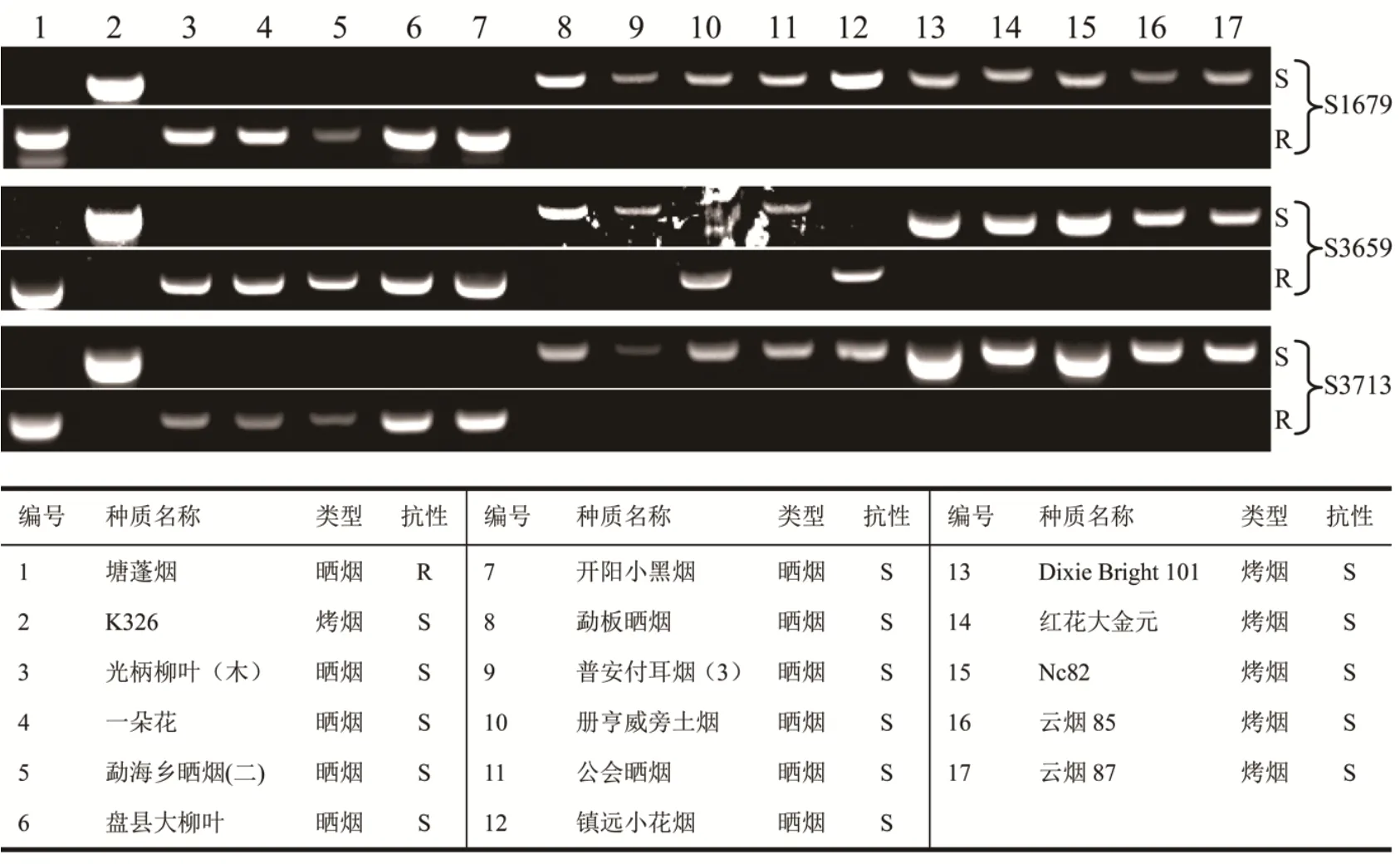
图6 烟草种质资源中NtMLO2基因的三个SNP位点的遗传多态性分析Fig.6 Genetic polymorphism analysis of three SNP loci in NtMLO2 gene in tobacco germplasm resources
3 讨论
等位性测验是通过杂交试验对杂交后代性状的分离情况进行分析,以确定基因之间的等位性[10-11]。本研究中,利用塘蓬烟的花粉与烟草白粉病感病品种K326杂交获得的F1代植株显示出感病性,表明塘蓬烟的白粉病抗性由隐性基因控制,进一步对F2代分离群体进行抗病性鉴定,结果显示抗感分离比约为1:15,初步断定塘蓬烟的白粉病抗性由两个独立遗传的隐性基因控制,这一点与文献报道的在白粉病抗病品种Kokubu和Tsukuba 1中白粉病抗性由双隐性基因控制结果一致[4]。利用塘蓬烟的花粉与烟草白粉病抗病品种Kutsaga E1杂交获得的F1代植株显示出抗病性,表明塘蓬烟的白粉病抗性基因与Kutsaga E1的感病基因NtMLO1/2具有等位性,即塘蓬烟的白粉病抗性同样由感病基因NtMLO1/2控制。进一步利用针对已开发的报道的NtMLO1/2突变类型等位基因开发的共显性分子标记检测塘蓬烟的突变位点,结果显示在野生基因多重PCR体系中产生一条代表NtMLO2野生型等位基因的437 bp的特异性条带,但在突变基因多重PCR体系中并未产生代表NtMLO2突变型等位基因的306 bp的特异性条带,表明NtMLO2基因的DNA序列在塘蓬烟中突变类型与已报道的突变类型不同,但或者不能转录,或者转录后生成无功能的基因产物。
可变剪接,又称选择性剪接,是指mRNA前体通过不同的剪接方式(选择不同的剪接位点)产生不同的mRNA剪接异构体的过程[12-13]。可变剪接方式主要包括外显子跳跃(exon skipping,ES)、内含子保留(intron retention,IR)、可变的5′端位点(alternative 5′splice site,A5SS)、可变的3′端位点(alternative 3′splice site,A3SS)、互斥外显子(mutually exclusive exon,MEX)等5种基本剪接方式[14]。在本研究中,我们发现与抗病烟草品种Tsukuba 1一样, 在塘蓬烟中NtMLO1基因同样具有3种剪接方式:外显子跳跃(del5,deletion of exon 8)、内含子保留(add,insertion of intron 7)、可变的3′端位点(del3、del4),不同的是,与烟草品种Tsukuba 1相比,塘蓬烟NtMLO1基因缺少2个转录本异构体(del1、del2),这可能与我们在进行NtMLO1基因cDNA克隆测序时挑取的阳性克隆数量较少(40个),而del1和del2的表达量又相对较低有关。至于发生上述可变剪接的原因可能与基因内含子7的3’端剪接位点发生突变(AG→TA)有关,该突变破坏了前体RNA内含子7剪接的信号序列(GT-AG法则),导致下游外显子8中AG位点的错误剪接(del1、del2、del3、del4、del5),或整个内含子7未被剪接(add),但无论哪种剪接方式依然遵循GT-AG法则(图4、图5)。以上提及的可变剪接方式均为顺式剪接,即加工过程发生在同一个mRNA前体分子中。与Tsukuba 1中NtMLO2基因发生可变的5′端位点(del1、del2)剪接方式不同的是,在塘蓬烟中NtMLO2基因的转录本发生了外显子重复突变(add,insertion of exon 6),应用顺式剪接机制不能解释这一现象,推测可能的机制是反式剪接将两个相互独立的mRNA上的外显子连接成为一个转录本,反式剪接并不像顺式剪接那样常见,但或许又是一种mRNA的可变剪接机制[15]。
国内外研究表明,各类型烟草中都存在有抗白粉病的品种[16],其中针对Kokubu、Kutsaga E1、Kutsaga 110、Ibusuki、Izumi、Maru-ha、Tarumizu、E2和TT7等9个抗白粉病烤烟品种的研究显示,这些烤烟品种的白粉病抗性均是由NtMLO1和NtMLO2基因的内含子区域突变造成转录本异常剪接引起的,且基因突变类型完全一致[4,17],到目前为止,研究人员已经针对这些特定的基因突变类型设计了多种分子标记用于烟草抗病育种[9,17-18]。塘蓬烟为我国广东省廉江县的晒烟品种,报道显示其对白粉病具有免疫能力,是由隐性基因控制的[16,19],但到目前为止针对塘蓬烟白粉病抗性基因更加深入的研究未见报道。本研究通过系列试验证明塘蓬烟白粉病抗性同样是由感白粉病基因NtMLO1和NtMLO2发生异常剪接引起的,其中NtMLO1基因的剪接方式与已报道的抗白粉病烤烟品种一致,而NtMLO2基因的剪接方式显示出明显差异,这就造成了已开发的分子标记并不适用于塘蓬烟白粉病抗性基因的筛选,也为塘蓬烟与其他抗白粉病烤烟品种之间的遗传关系打上了一个问号。
4 结论
以抗病品种Kutsaga E1和感病品种K326为亲本,对晒烟品种塘蓬烟的白粉病抗性位点等位性进行检测,结果表明,抗病品种塘蓬烟与Kutsaga E1的抗性位点等位,即抗性由感白粉病基因NtMLO1/2控制。序列分析表明,塘蓬烟NtMLO1基因的突变类型与Kutsaga E1相同,内含子7的3’端碱基AG变为TA,造成mRNA发生可变剪接;NtMLO2基因的突变类型与Kutsaga E1不同,转录本发生外显子重复突变,形成一个新的可变剪接变异体。总体而言,本研究从分子水平阐述了地方烟草品种塘蓬烟的抗白粉病机制,其结果不仅丰富了烟草抗白粉病基因资源信息,而且为日后抗性基因资源的深入研究和合理利用提供了参考依据。
