本氏烟转录因子bZIP60多克隆抗血清的制备及其应用
2021-09-26张浩庄新建郭枭徐红梅贺振张坤
张浩,庄新建,郭枭,徐红梅,贺振,张坤
扬州大学园艺与植物保护学院,江苏扬州文昌中路567号,225000
内质网(Endoplasmic reticulum,ER)是植物细胞重要的具备膜和管道系统的细胞器,是分泌蛋白、膜蛋白合成、糖基化修饰的场所[1]。ER具有极强的内稳态,但仍然有很多因素(病毒和细菌侵入等)导致内稳态失衡,未折叠或错折叠蛋白蓄积,膜双层结构组成紊乱,进而引起内质网应激(ER stresses)[2]。当内质网蛋白的折叠受到逆境等因素干扰时,未折叠蛋白和错误折叠蛋白就会大量积累,细胞就会启动一种非常保守的机制——未折叠蛋白应答(Unfolded Protein Response,UPR)通路激活[3]。植物细胞主要通过两条通路来感受和传导内质网压力,其中一条通路由S1P/S2P-bZIP17/bZIP28介导,而另一条通路由IRE1-bZIP60mRNA介导[4]。
NbbZIP60是一个含有跨膜结构域且定位于内质网膜的转录因子,而NbIRE1则是一种内质网I型跨膜蛋白,在细胞质侧有激酶和RNase结构域[5]。在正常情况下,NbbZIP60蛋白能定位于内质网膜上;bZIP60转录的初级转录物(pri-mRNA) 具有保守的茎环结构,在逆境胁迫(如高温,病原菌侵染等)下,该结构能被定位于内质网的IRE1剪接,而产生阅读框移码,从而编码不含跨膜结构域,但携带有核定位信号的NbbZIP60成熟蛋白。该蛋白在核转运复合物的作用下能被转运到细胞核内,从而启动下游分子伴侣基因的转录[6]。在沉默bZIP60时, 普通烟(Nicotiana attenuata)更易感烟草赤星病(Alternaria alternata);在TuMV侵染拟南芥(Arabidopsis)时能显著诱导bZIP60的剪切[7];在沉默NbbZIP60时,马铃薯X病毒(potato virus X,PVX)更易扩散到本氏烟(Nicotiana benthamiana)的上部叶;IRE1-bZIP60可以限制PVX在本氏烟中的侵染[8]。
鉴于本氏烟作为研究植物病毒的模式植物,本研究拟克隆本氏烟bZIP60基因,通过原核表达纯化NbbZIP60重组蛋白并制备其特异性抗血清,制备的bZIP60抗体可以检测DTT喷施过的本氏烟中bZIP60蛋白的表达,对bZIP60蛋白剪切与非剪切两种形式蛋白的定量能直接反应本氏烟UPR反应激活的强度。后续在病毒侵染本氏烟的条件下对UPR进行研究时,可以对本氏烟bZIP60蛋白的表达进行检测,为探索bZIP60的相关功能和作用机制研究奠定基础。
1 材料与方法
1.1 材料
原核表达载体pET28(+)a、大肠杆菌DH5α菌株、BL21菌株来自中国农业大学李大伟教授的馈赠;pMD19-T质粒、RTase M-MLV、5 × M-MLV Buffer、dNTP Mixture、RNase Inhibitor 、Nco I限制性内切酶、Xho I 限制性内切酶等购自于宝生物工程(大连)有限公司;FastPure Gel DNA Extraction Mini Kit试剂盒,2 × Taq Master Mix、180 kDa Protein Marker、RNA-easyTM Isolation Reagent Kit购自于南京诺唯赞生物科技有限公司;Ni -NTA 亲和层析介质购自南京金斯瑞生物科技有限公司;PMSF、DTT购自上海生工生物工程股份有限公司;IPTG购自北京索莱宝科技有限公司。NbbZIP60多克隆抗血清由扬州大学植物病毒学实验室保存。本氏烟(Nicotiana benthamiana)培育在扬州大学植物病毒学恒温室;生长条件为在(24 ± 1)℃,光周期为 16/8 h,其中16 h四级光照,8 h黑暗处理。
1.2 NbbZIP60基因扩增及原核表达载体构建
登录本氏烟数据库网站(https://solgenomics.net/tools/blast)查询并获得可能的NbZIP60基因序列,按照获得的本氏烟bZIP60基因合成引物bZIP60-Nco I/F: 5’-CATGCCATGGNcoITTGGATGACATCGATGATATCG-3’ ,bZIP60-Xho I/R:5’-CCGCTCGAGXhoIAGACTCCTGC-TTGGTCAT ACAAG-3’;按照RNA-easyTM Isolation Reagent Kit说明书的方法来提取本氏烟叶片的总RNA。以提取的本氏烟叶片总RNA为模板,bZIP60-Xho I/R作为引物,使用逆转录酶M-MLV,于42℃条件下合成cDNA;用上述合成的cDNA为模板,按设计的正反引物进行PCR扩增本氏烟的bZIP60基因。PCR产物经1% 琼脂糖凝胶电泳分离并回收纯化,用Nco I和Xho I对纯化片段与载体进行酶切反应,随后于16℃连接。连接产物转化大肠杆菌DH5α。经菌落PCR 验证阳性克隆后并测序,从中选择测序结果正确的克隆进行后续的研究,并将该质粒命名为pET28a-bZIP60。
1.3 蛋白表达和SDS-PAGE分析
将pET28a-bZIP60质粒转化大肠杆菌BL21(DE3),挑取单菌落接种于5 mL含卡那霉素(100 μg/mL)的LB液体培养基中,37℃摇床培养过夜。活化菌液按1:100加入50 mL含卡那霉素(100 μg/mL)的LB液体培养基中,37℃培养至OD600为0.6。分别在28℃和37℃下进行诱导,每个温度取2管,其中一管加IPTG至终浓度为1 mmol/L,诱导培养4 h。取2 mL诱导培养物,12 000 rpm离心30 s收集菌体。加入100 μL SDS-PAGE Loading Buffer,沸水煮10 min,12 000 rpm离心10 min。取5 μL上清进行SDS-PAGE电泳检测。电泳结束后,通过考马斯亮蓝R-250对凝胶进行染色,检测分析融合蛋白的表达情况。
1.4 NbbZIP60蛋白的Ni柱纯化
通过预实验确定蛋白表达后,在1 L液体LB培养基中按1:100加入10 mL活化菌液,37℃培养至OD600为0.6,用1 mmol/L IPTG于18℃诱导18 h。然后离心收集菌体,用40 mL含20 mmol/L Tris-HCl (pH 7.0)、500 mmol/L NaCl、10%甘油的蛋白buffer重悬,加蛋白酶抑制剂PMSF至终浓度为1 mmol/L,超声波破碎,离心收集上清和沉淀备用。上清用High Affinity Ni-NTA Resin进行纯化。取5 mL High Affinity Ni-NTA Resin过5倍柱体积蛋白buffer,上清过柱子5遍,之后分别用10 mL含40 mmol/L、60 mmol/L、80 mmol/L、100 mmol/L、200 mmol/L、300 mmol/L咪唑的蛋白缓冲液进行洗脱,取上清、沉淀、穿柱液以及各浓度的洗脱液等体积加入SDS-PAGE Loading Buffer,使用SDS-PAGE电泳来检测蛋白的洗脱情况。使用超滤管对将含靶标蛋白的洗脱液进行离心浓缩,分装后液氮速冻,-80℃超低温冰箱保存备用。
1.5 NbbZIP60蛋白抗血清的制备
以诱导表达的特异的NbbZIP60蛋白为抗原,参照张超等[8]的方法,分4次在第1 d、22 d、36 d、50 d免疫新西兰大白兔, 最后一次注射10 d后,自大白兔颈动脉取血,5000 r·m-1离心10 min,经过2次离心后收集 NbbZIP60抗血清30 mL。
1.6 Western blot免疫印迹检测
将待检测蛋白样品进行SDS- PAGE电泳,将蛋白质转移至硝酸纤维素膜上;随即转入10 mL 封闭液 (10 mL TBST缓冲液+0.5 g脱脂奶粉),37℃反应1 h;在封闭液中加入1:10000的抗血清,37℃反应1 h,随后使用1×TBST缓冲液洗脱3次,每次10 min;随后将膜置入含有AP-IgG二抗的TBST缓冲液(1 : 5 000),37℃反应45 min;1×TBST洗脱3次,每次10 min;在避光条件下,将膜放至含有165 μg/mL BCIP和330 μg/mL NBT底物的碱性磷酸酯酶缓冲液中显色至条带清晰。
1.7 抗血清效价测定
提取DTT喷施过的本氏烟叶片总蛋白,采用Western blot的方法对NbbZIP60的抗血清进行效价测定。梯度稀释NbbZIP60抗血清,稀释倍数为1000、2000、5000、8000、10000和20000,测定其效价。
1.8 抗血清的灵敏度分析
以DTT喷施过的本氏烟叶片和原核表达纯化的NbbZIP60为材料,使用Western blot来对抗血清的灵敏度进行分析。称取本氏烟叶片0.2 g,组织粉碎研磨后加入200 μL SDS-PAGE Loading Buffer,制备蛋白电泳样品,即以1:1稀释样品。继续使用SDSPAGE Loading Buffer来制备梯度稀释的电泳样品,稀释倍数依次为5、10、50、100、200、300、500、1000,NbbZIP60特异性抗血清以1:2000 稀释,进行western blot 检测。另取已知浓度原核表达纯化的NbbZIP60蛋白,分别取50、40、30、20、10、8、6、4、1 ng蛋白上样,NbbZIP60抗血清以1:5000稀释进行Western blot检测。
2 结果与分析
2.1 NbbZIP60的诱导表达、纯化
将构建成功的原核表达载体pET28a-bZIP60转化大肠杆菌BL21(DE3),筛选阳性克隆,并经过1 mM的IPTG诱导表达,SDS-PAGE电泳显示在35 kDa附近位置出现与预期大小一致的融合蛋白条带,表明NbbZIP60重组蛋白在大肠杆菌中能正确表达。剩余菌体经蛋白悬浮缓冲液悬浮后,通过超声波细胞破碎仪破碎,将上清和沉淀分别取出,并进行SDSPAGE电泳,实验结果显示靶标融合蛋白主要是以可溶的状态存在于破碎后的上清液中(图2)。选择阳性菌株,经过大量发酵培养后,在18℃条件下诱导蛋白表达,菌体经破碎后,利用Ni-NTA亲和层析介质对上清液中的靶标蛋白进行纯化。SDS-PAGE电泳分析表明,在沉淀和上清中都检测到NbbZIP60融合蛋白的存在(图2),说明通过该原核表达技术诱导表达的NbbZIP60融合蛋白是一个部分可溶性蛋白。进一步通过Ni-NTA亲和层析介质进行NbbZIP60融合蛋白的纯化,使用100 mmol/L、300 mmol/L咪唑进行洗脱时,与介质结合的非特异性蛋白的量较少,目的蛋白纯度相对较高,使用200 mmol/L的咪唑洗脱时获得的蛋白浓度最高。因此,结果表明利用Ni-NTA亲和层析介质纯化NbbZIP60融合蛋白时,咪唑浓度为200 mmol/L洗脱缓冲液为最佳浓度。
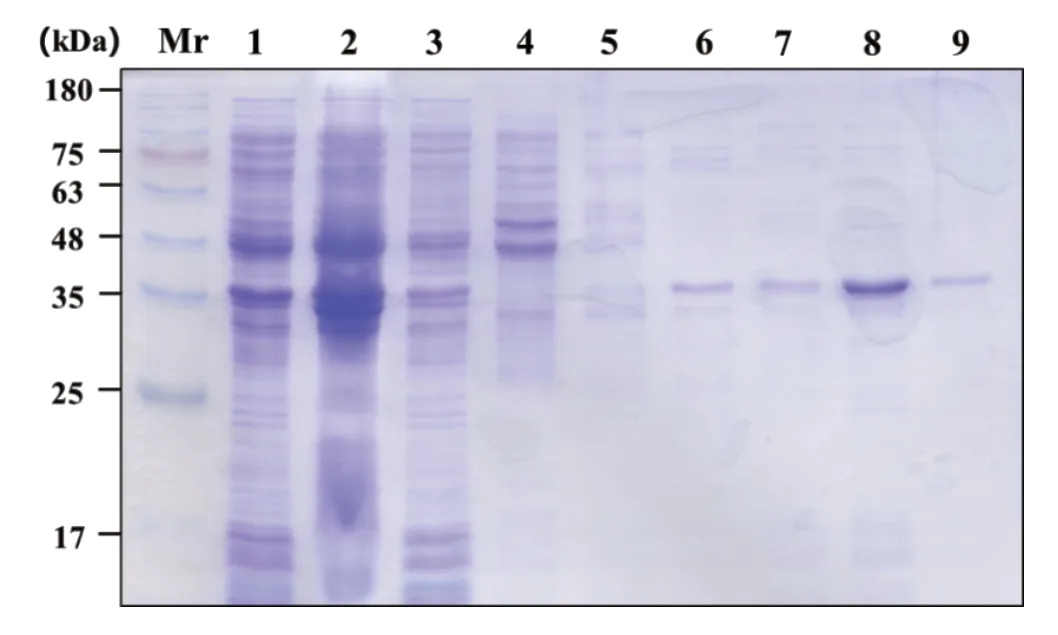
图1 原核表达本氏烟 bZIP60蛋白的SDS-PAGE图Fig.1 SDS-PAGE analysis of NbbZIP60 expression in Escherichia coli
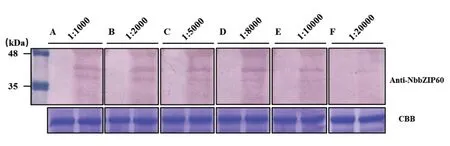
图2 本氏烟 bZIP60抗血清效价的检测Fig.2 Determination of antibody titer of NbbZIP60
2.2 抗血清效价的测定
成功制备了NbbZIP60血清抗体后,通过Western Blot对抗血清效价进行测定。当血清抗体稀释不同浓度时,均能检测到目的蛋白(图3)。通过Western Blot对本氏烟进行检测分析发现,当抗血清按比例稀释到1:20000时,制备的抗血清仍然能够特异地检测到目的蛋白(图3),说明制备的抗血清效价良好。
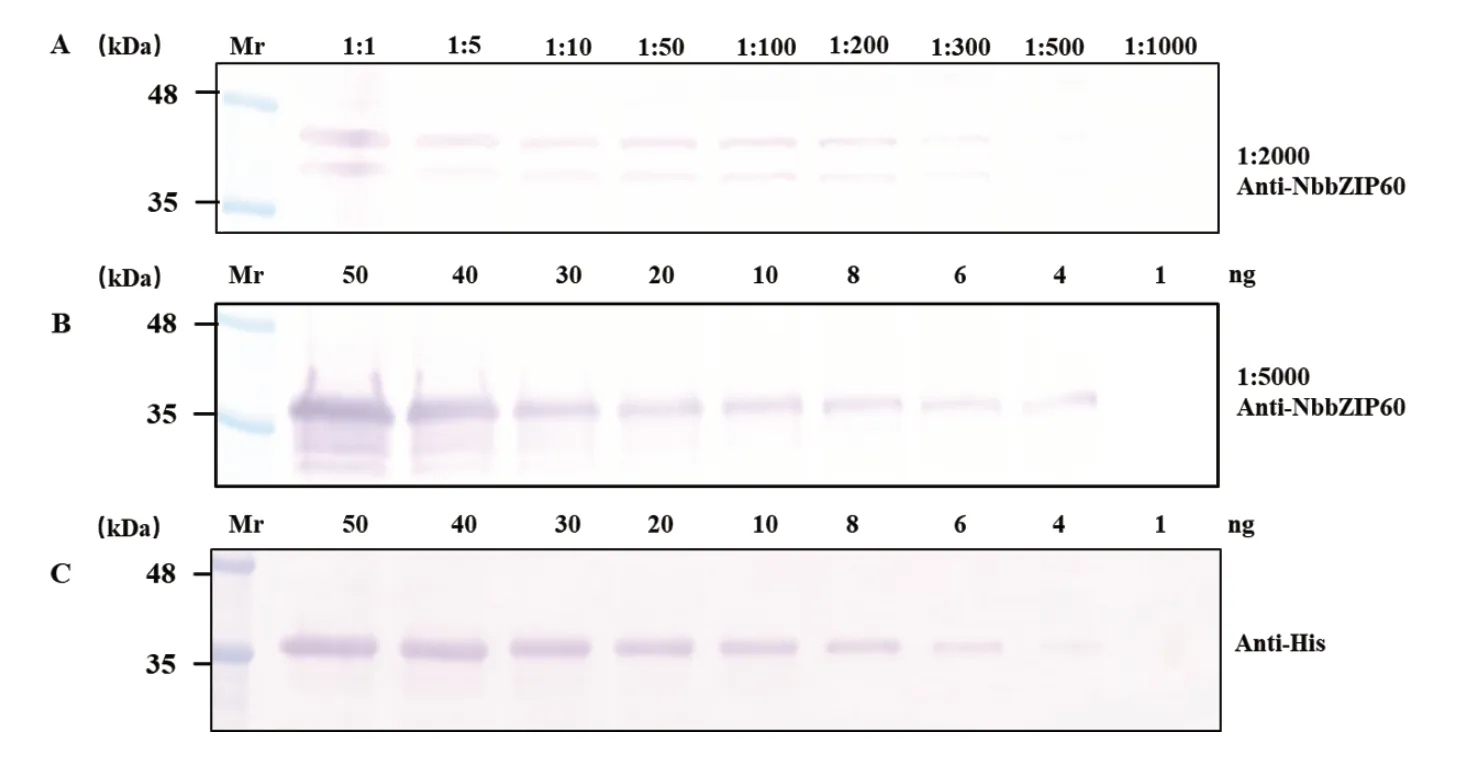
图3 Western blot分析本氏烟 bZIP60抗血清灵敏度图Fig.3 Sensitivity of NbbZIP60 antiserum determined by Western blot
2.3 抗血清灵敏度的检测鉴定
为了分析多克隆抗血清的检测灵敏性,分别以本氏烟叶片和原核表达蛋白为材料,梯度稀释样品进行Western blot检测。当抗血清稀释倍数为1:2000时,0.2 g本氏烟叶片的总蛋白稀释500倍后反应呈阳性(图4-A),而以1:5000稀释的抗血清可以检测到大约4 ng原核表达蛋白(图4-B),说明制备的抗血清具有较强的灵敏度。同时,通过His抗体对纯化的蛋白进行检测(图4-C),结果进一步验证了制备的抗血清具有较强的灵敏度。
2.4 Western blot 免疫印迹分析本氏烟总蛋白
为了进一步验证制备的抗体是否能够用于检测本氏烟中UPR机制中bZIP60蛋白,提取本氏烟总蛋白进行Western blot检测。Western blot结果显示,产生了两条特异性条带(图4),表明制备的抗体可以特异地与本氏烟中的bZIP60蛋白结合,可以检测到本氏烟中两种形式的bZIP60蛋白,为后续开展bZIP60调控植物防御胁迫的分子机理提供了研究基础。
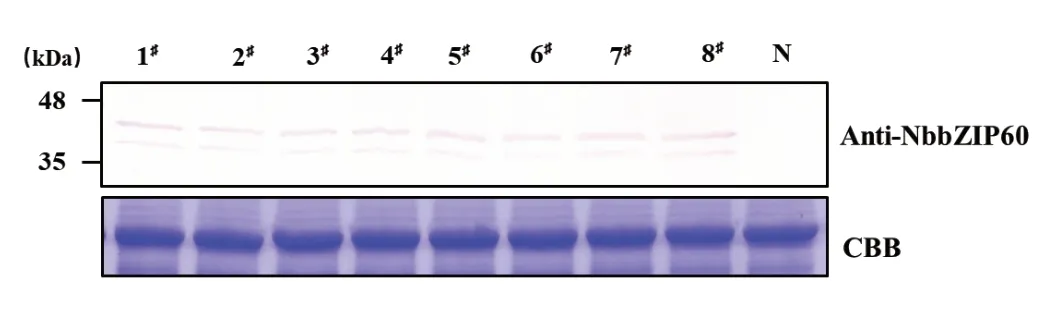
图4 本氏烟bZIP60抗血清特异性的Western blot 分析Fig.4 Western blot analysis of the specificity of NbbZIP60 antiserum
3 结论
本研究利用大肠杆菌表达系统,成功表达可溶性的重组bZIP60蛋白,并制备了高效价的多克隆抗体,能够检测出本氏烟中表达的bZIP60蛋白, 为进一步研究bZIP60基因在植物发育和抗逆性中的功能奠定了基础。
