基于PI3K/Akt/mTOR信号通路探讨玉屏风散对肥大细胞脱颗粒的影响
2021-09-26韦薇覃骊兰李莉郑伟灏
韦薇 覃骊兰 李莉 郑伟灏
过敏性疾病(allergic disease)反复发作且难以根治已经成为全球最受关注的公共卫生问题之一[1]。据世界变态反应组织统计,近30年来,过敏性疾病的发生率至少增加了3倍,目前全球总患病率已达22%。近年来,特异性生物标志物、信号与蛋白相关机制是过敏学科的研究热点[2]。肥大细胞是过敏性疾病发病的主要效应细胞,存在于机体的大多数组织如皮肤、呼吸道、黏膜、腹腔中,被抗体激活的肥大细胞脱颗粒后产生的炎性介质与细胞因子会参与多种炎症免疫性疾病如过敏反应、哮喘等,所以肥大细胞脱颗粒机制在过敏性疾病的发展进程中起到关键性作用[3-7]。研究发现调控白细胞介素信号与磷脂酰肌醇-3-激酶(phosphatidylinositol 3-kinases, PI3K)/蛋白激酶B (protein kinase B,PKB/Akt)信号通路,与治疗过敏性疾病密切相关[8-10]。目前,现代医学治疗此病主要以控制疾病症状为主,无法有效缓解反复发作,而且副作用明显[11],而中医药治疗过敏性疾病有着独特的优势,疗效显著,且副作用较小。现代研究表明玉屏风散在治疗哮喘、鼻炎、荨麻疹等过敏性疾病都有显著疗效[12-14],且玉屏风散可以显著减轻肥大细胞脱颗粒,可以通过抑制肥大细胞脱颗粒相关作用机制来治疗过敏性疾病[15-17]。因此,本研究通过建立体外肥大细胞脱颗粒模型,来验证玉屏风散发挥抗过敏反应的作用是否与肥大细胞脱颗粒作用机制和PI3K/Akt/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)信号通路有关。
1 材料与方法
1.1 药物与试剂
玉屏风散浸膏:根据2015版《中华人民共和国药典(一部)》玉屏风项下提取方法,按3∶1∶1比例取黄芪600 g、防风200 g、白术200 g,将200 g防风予以碎断,加4倍量的水浸泡2小时,蒸馏提取5小时,另收集蒸馏后的水溶液,将蒸馏后的药渣与600 g黄芪、200 g白术一起煎煮2次,第一次1.5小时,第二次1小时,合并煎液,过滤,滤液浓缩至适量,加适量乙醇至含醇量70%,搅拌,静置,过滤,滤液加压回收乙醇,加入挥发油及蒸馏后的水溶液,浓搅拌,静置,取上清液,过滤,滤液浓缩得156.611 g浸膏量(1 g浸膏含6.3852 g生药),置-20°冰箱保存备用。
黄芪、防风、白术(广西仙茱中药科技有限公司,批号:20190101、2019040、20190602);胰酶(武汉贝茵莱生物科技有限公司,批号:52419);CCK-8(新赛美生物科技有限公司,批号:N9091085);小鼠单抗PI3K(武汉三鹰生物技术有限公司,批号:60225-1-Ig),兔多抗p-PI3K(Abcam公司,批号:Ab182651);兔多抗Akt(Bioss公司,批号:Bs-0115R);p-Akt(Affinity公司,批号:AF0016);兔多抗mTOR(武汉三鹰生物技术有限公司,批号:20657-1-AP);p-mTOR(CST公司,批号:5536t);β-氨基己糖苷酶(β-hexosaminidase, β-Hex)、组胺、白细胞介素(interleukin,IL)-4、IL-13、血小板激活因子(platelet activating factor, PAF)酶联免疫分析试剂盒(武汉贝茵莱生物科技有限公司,批号:202004);Trizol(Ambion公司,批号:15596-026);HRP标记羊抗兔二抗(武汉博士德生物工程有限公司,批号:BA1054)。
1.2 细胞株与分组
小鼠肥大细胞瘤P815购自中国科学院干细胞库,编号:SCSP-516。细胞状态为部分悬浮、部分贴壁生长。使用高糖伯克改良伊格尔培养基(Dulbecco modified Eagle medium,DMEM)培养基,含10%胎牛血清(fetal bovine serum,FBS),1%双抗。培养于37℃、5%CO2培养箱中,待细胞密度达到80%~90%时,调整相应的细胞数量进行传代,取对数生长期的细胞用于后续实验。将P815细胞随机分为4组:空白组、模型组、玉屏风散高剂量组、玉屏风散低剂量组。
1.3 仪器设备
细胞恒温培养箱(美国Thermo公司);生物安全柜(美国Thermo公司);倒置显微镜(日本奥林巴斯科技公司);Epoch2T型吸收光酶标仪(美国BioTek仪器有限公司);全自动细胞计数仪(伯乐生命医学产品有限公司);离心机(湖南湘仪实验室仪器开发有限公司)。
1.4 CCK-8测定P815细胞存活率
将玉屏风散浸膏用不含血清高糖DMEM培养基按稀释为1.5625 μg/mL、3.125 μg/mL、6.25 μg/mL、12.5 μg/mL、25 μg/mL、50 μg/mL、100 μg/mL 7个浓度梯度,置于4℃冰箱保存。取对数生长期的P815细胞,用DMEM培养液(无血清)按1×105/mL密度接种于96孔板,每孔100 μL。设置空白组(培养基)、对照组(细胞、培养基)、给药组(细胞、培养基、玉屏风散),每组设置5个复孔。饥饿处理24小时使其同步化后,吸走每孔内原培养液,给药组分别加入100 μL含终浓度(1.5625 μg/mL、3.125 μg/mL、6.25 μg/mL、12.5 μg/mL、25 μg/mL、50 μg/mL、100 μg/mL)的玉屏风散DMEN培养液,空白组、对照组加入等体积无药DMEM培养液,置于恒温培养箱继续孵育。24小时后,吸走各孔内培养液,每孔加入含10% CCK-8的培养液,37℃,5% CO2继续孵育1.5小时,利用酶标仪测定各孔在波长450 nm 处的吸光度(optical delnsity,OD)值,重复3次[18-19]。
计算各浓度组细胞存活率,细胞存活率%=(实验组吸光度-空白组吸光度)/(对照组吸光度-空白组吸光度)×100%。
1.5 酶联免疫吸附法检测β-Hex、组胺等炎性因子水平
取对数生长期的P815细胞计数,用无血清培养基稀释成5×105/mL 密度的单细胞悬液,接种到6孔板上,设置空白组、模型组、玉屏风散高剂量组(25 μg/mL)、玉屏风散低剂量组(12.5 μg/mL),每组设置3个复孔,每孔2 mL,置 37 ℃,5% CO2细胞培养箱中,培养24小时。待细胞至80%融合度,于细胞空白组加入等体积DMEM培养液;细胞模型组用等体积DMEM培养液代替受试药物,玉屏风散高、低剂量组分别加入不同浓度的药物,继续培养在 37℃,5% CO2饱和湿度的细胞培养箱中,在药物作用6小时后,模型组、玉屏风散高剂量组与玉屏风散低剂量组加入500 μL胰蛋白酶(终浓度1 μg/mL)刺激,空白组加入等体积的磷酸缓冲盐溶液(phosphate buffer saline,PBS),分别收集刺激l小时后的细胞上清液与细胞,上清液用来检测β-氨基己糖苷酶(β-hexosaminidase, β-Hex)、组胺、IL-4、IL-13、PAF等细胞因子的分泌情况,孔板壁上的细胞用于后续提取蛋白[20]。细胞上清液严格按照酶联免疫分析试剂盒操作步骤,记录各细胞因子吸光度值。
1.6 Western blot法检测PI3K、Akt、mTOR蛋白及其磷酸化的表达
将1.5步骤收集到的6孔板细胞,使用PIPA裂解液进行裂解提取蛋白,蛋白定量变性后,各蛋白以上样量40 μg使用SDS-PAGE凝胶进行电泳分离,电转至PVDF膜,使用5%脱脂牛奶封闭,1%的BSA封闭磷酸化蛋白,一抗4℃孵育过夜,二抗室温孵育2小时,采用凝胶成像系统拍照,用IPP对灰度值进行分析,使用GAPDH作为内参。
1.7 实时荧光定量PCR法检测PI3K、Akt、mTOR蛋白表达量
收集1.5收集到的细胞,使用 Trizol 法提取细胞总 RNA ,并反转录成 cDNA,以 cDNA 为模板,进行实时荧光定量PCR(real-time quantitative PCR, qRT-PCR)实验检测各组细胞的PI3K、Akt、mTOR在mRNA水平上的表达,引物序列如表1。相对表达量运用2-ΔΔCt法计算。

表1 引物序列
1.8 统计学处理

2 结果
2.1 玉屏风散对P815细胞存活率的影响
对比其他组,玉屏风散在25 μg/mL浓度以下时,P815细胞存活率达到80%以上,无明显抑制作用,50 μg/mL浓度以上存活率低于80%,50 μg/mL与100 μg/mL浓度两组对比其他5组有显著差异,差异有统计学意义(P<0.01)。如图1。

图1 不同浓度玉屏风散对P815细胞存活率比较
2.2 玉屏风散对β-Hex、组胺等炎性因子水平的影响
胰酶刺激P815肥大细胞脱颗粒后,对比空白组,模型组细胞上清液中的β-Hex、组胺、IL-4、IL-13、PAF浓度都有显著上升,差异有统计学意义(P<0.01);对比模型组,玉屏风散高剂量组与玉屏风散低剂量组的β-Hex、组胺、IL-4、IL-13、PAF浓度显著降低,差异有统计学意义(P<0.01)。如表2。
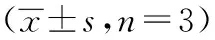
表2 玉屏风散对各炎性因子浓度的影响
2.3 玉屏风散对PI3K、Akt、mTOR及其磷酸化蛋白表达的影响
与空白组比较,模型组、玉屏风散高剂量组和玉屏风散低剂量组PI3K、Akt、mTOR表达变化都无明显差异(P>0.05)磷酸化后的p-PI3K、p-Akt、p-mTOR表达变化有显著差异,且差异有统计学意义(P<0.01);与模型组比较,玉屏风散高剂量组p-PI3K、p-Akt、p-mTOR表达显著降低,差异有统计学意义(P<0.01),玉屏风散低剂量组p-PI3K无明显变化,p-Akt、p-mTOR表达显著降低,差异有统计学意义(P<0.05)。如表3、图2。
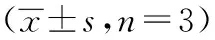
表3 玉屏风散对PI3K、Akt、mTOR及其磷酸化蛋白表达的影响
2.4 玉屏风散对PI3K、Akt、mTOR蛋白表达量的影响
胰酶刺激P815肥大细胞活化脱颗粒后,与空白组比较,模型组PI3K、Akt、mTOR基因的相对表达量显著升高,差异具有统计学意义(P<0.01);与模型组比较,玉屏风散高剂量组与玉屏风散低剂量组PI3K、Akt、mTOR基因的相对表达量显著降低,差异具有统计学意义(P<0.01,P<0.05)。如表4。

注:A 空白组;B 模型组;C 玉屏风散高剂量组;D 玉屏风散低剂量组
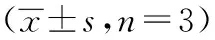
表4 玉屏风散对PI3K、Akt、mTOR蛋白表达量的影响
3 讨论
实验结果表明,玉屏风散可以降低肥大细胞中β-Hex、组胺、IL-4、IL-13、PAF炎性因子水平,并对PI3K、Akt、mTOR蛋白的表达有调节作用,说明了玉屏风散是通过抑制肥大细胞活化脱颗粒释放炎性因子来减轻过敏反应,其作用机制与PI3K/Akt/mTOR信号转导通路有关。
过敏性疾病在新生儿到老年人的各个年龄阶段都可能会发生,主要包括皮肤过敏反应、呼吸道过敏反应、消化道过敏反应等。过敏反应发病机制主要由免疫球蛋白介导,抗原(Ag)可以通过交联的免疫球蛋白(immunoglobulin,Ig)E结合肥大细胞上的特异性亲和受体(FcεRI),激活肥大细胞内部进行一系列磷酸化反应和炎症因子合成,使细胞内钙离子浓度升高,导致肥大细胞脱颗粒化并释放组胺、β-Hex、前列腺素(prostaglandins,PGs)和白三烯(leukot-rienes,LTs)、PAF等炎性介质;Ag也可以通过交联的IgG结合肥大细胞上的特异性亲和受体(FcγRIII)刺激肥大细胞产生PAF。PAF可凝聚和活化血小板使之释放组胺等,增强过敏反应,PAF和组胺主要通过诱导平滑肌收缩和增加血管通透性引起过敏反应症状[21-25]。另一种现代研究认为,过敏反应是一种由辅助型T细胞2(T helper 2 cell,Th2)细胞因子引发的免疫系统失调疾病,Th2细胞主要产生IL-4、IL-5、IL-6、IL-10及IL-13等细胞因子,介导体液免疫应答[26]。IL-4、IL-13与过敏反应密切相关,IL-4、IL-13可以激活B细胞产生IgE。研究表明,哮喘、变应性鼻炎发作过程中被活化的免疫细胞会释放IL-4、IL-13等炎性介质,引起支气管收缩、血管通透性增加等炎症反应[27]。IL-4可以启动肥大细胞分化,IL-13可促进IL-4的作用,两者共同作用,促使并加重炎症的形成与发展。因此,抑制这几种炎症性因子是治疗过敏性疾病的有效途径。
PI3K/Akt/mTOR信号通路是参与炎症的发生、发展的重要信号通路,也是重要的细胞内途径之一。PI3K是一种胞内磷脂酰肌醇激酶,能够调节众多细胞内信号级联的激活,以及多种炎症介质功能的发挥, 在PI3K下游的直接作用靶点是蛋白激酶Akt,也是最关键的靶酶,负责传递PI3K相关的生物信息。PI3K 的脂类激酶活性,可以催化Akt磷酸化,磷酸化的Akt从细胞质转移到细胞膜上,通过直接和间接两种途径激活底物mTOR蛋白,调节下游细胞生长、增殖和炎症靶基因的表达[28]。在靶细胞水平上,通过PI3K可诱导合成内皮型一氧化氮合酶(endothelial nitric oxide synthase, eNOS),由eNOS催化产生的一氧化氮可加剧过敏反应。有研究表明,通过影响PI3K的表达,抑制Akt与mTOR的磷酸化水平,可以减轻炎症反应的发生与发展[29-30]。
肥大细胞脱颗粒试验是过敏反应模型常用的一种方法。彭博[31]在相同刺激条件下比较P815和RBL-2H3细胞激活后脱颗粒反应差异,结果发现P815细胞是活化后脱颗粒时间出现更早、程度更高的细胞。人皮肤肥大细胞在体外释放类胰蛋白酶是一种新型的肥大细胞特性,而被释放的类胰蛋白酶再通过特异性受体激活相邻的肥大细胞,通过相关机制再次诱导相邻肥大细胞组胺释放,从而产生肥大细胞的“瀑布效应”[32]。隋丽[5]和吴贤波[20]在体外培养P815细胞后,均采用胰蛋白酶激发诱导肥大细胞脱颗粒来检测相关分子机制。
玉屏风散最早记载于《丹溪心法》,由黄芪、防风、白术三味药组成,具有益气固表、扶正祛邪之功效。其用药量精少而配伍严谨,白术健脾益气,脾旺则土可生金,使肺气充足,卫阳以固,与黄芪为伍,则益气固表之力更宏,故用以为臣。防风走表,祛风以散风邪,合黄芪、白术则益气散邪,为佐使之用。本方中黄芪得防风则固表不留邪,防风得黄芪,祛邪不伤正,实为补中有散,散中寓补之方[33]。许多药理学研究表明了玉屏风散可通过调节机体免疫功能和相关通路以发挥临床疗效,并初步探索了玉屏风散通过多种作用机制与相关信号通路对机体产生的抗炎抑菌、免疫调节、稳定微生态环境及抗肿瘤、抗纤维化等功能。但是对玉屏风散作用机制的研究仍不够系统、深入,玉屏风散作为治疗过敏性疾病的经典方剂,如果可以阐明其抗过敏作用机制,将会为中医药防治过敏性疾病提供更多新思路。
