培元抗癌汤联合替加氟对小鼠H22肝癌细胞生长的抑制作用
2021-09-22司海龙马仰仰马一鸣肖海娟王惠玲
司海龙,马仰仰,马一鸣,张 洁,肖海娟,方 瑜,王惠玲
(陕西中医药大学,陕西 咸阳 712046)
恶性肿瘤已成为影响人类健康和生命的重大疾病,随着研究的深入,肿瘤微环境(Tumor microenvironment,TME)逐渐被人们认识[1-2]。TME是由多种基质细胞及细胞因子构成的复杂生物学系统,影响着肿瘤发展进程中的多种生物学行为,为肿瘤增殖、血管生成、侵袭、转移提供了良好的物质条件[3]。中医药在重塑肿瘤相关微环境及控制肿瘤复发、转移等方面有着重要优势[4]。癌相关成纤维细胞(Cancer associated fibroblasts,CAFs)是TME中最主要的基质细胞之一,在肿瘤发展过程中起着重要作用[5]。研究表明α平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)作为癌相关成纤维细胞(Cancer associated fibroblasts,CAFs)表达的特征性蛋白标志物,常用以CAFs检测[6]。而波形蛋白(Vimentin)作为细胞骨架蛋白的一类Ⅲ型中间丝蛋白,在临床病理学鉴别肿瘤细胞分化起源过程中被广泛的作为标志物[7]。因此可以通过检测α-SMA、Vimentin蛋白表型间接检测CAFs,从而反映其在肿瘤微环境变化和对肿瘤发生、发展、转移及预后的影响。CAFs可以分泌多种趋化因子,趋化因子由可溶性及分子量较小的细胞因子样蛋白构成,分泌的CXCL1、CXCL2、CXCL8以及CAFs可以诱导肿瘤形成,促进肿瘤细胞增殖、转移及血管新生[8-10]。研究发现,下调CXCL可以显著抑制肿瘤细胞生长及转移[11]。培元抗癌汤是陕西省名中医李仁廷教授根据30余年中医药治疗恶性肿瘤临床经验所研制。前期临床研究证实培元抗癌汤联合FOLFOX4方案化疗治疗中晚期肝癌,疗效优于单纯FOLFOX4方案化疗[12]。前期动物实验研究表明培元抗癌汤通过干预不同的因子,抑制H22肝癌细胞生长,提高免疫功能。本研究在前期研究基础上,以H22荷瘤小鼠为载体,应用现代生物学技术与方法,观察培元抗癌方联合替加氟片对肿瘤生长及转移的抑制作用,检测CAFs及相关细胞因子CXCL1、CXCL2、CXCL8的表达,探讨培元抗癌汤治疗肝癌的作用机理,为培元抗癌方治疗恶性肿瘤提供现代生物学依据。
1 材料与方法
1.1 实验材料
1.1.1 实验动物及细胞株:肝癌细胞株H22,由陕西中医药大学实验中心提供;昆明种雄性小鼠40只,体重18~22 g,购于西安交通大学医学院实验动物中心,合格证号SCXK(陕2017-003);在陕西中医药大学动物实验中心进行饲养,室内平均温度(23±2)℃、平均湿度(55±10)%,饲养1周后造模。
1.1.2 实验药物与试剂:替加氟片(国药准字H20066150,规格50 mg/片)。培元抗癌汤组成:西洋参、黄芪、炒白术、莪术、白花蛇舌草、茯苓各15 g,郁金、厚朴、法半夏、焦山楂各12 g,方中中草药购于陕西中医药大学附属医院。蛋白Marker(北京全式金生物技术有限公司),兔多抗Gapdh(杭州贤至生物有限公司),兔单抗CXCL2(Invitrogen公司),兔多抗CXCL8(Affinity公司),兔多抗CXCL1、α-SMA、Vimentin(三鹰生物公司),HRP标记羊抗兔二抗(武汉博士德生物工程有限公司)。
1.1.3 实验仪器:电泳仪电源(北京六一仪器厂)、DYY-7C垂直电泳槽(北京六一仪器厂)、DYCZ-24DN电转仪(北京六一仪器厂)、水平摇床(海门其林贝尔仪器制造有限公司)、pH计(德国Metter-Toledo GmbH公司)、酶标仪(Thermo公司)。
1.2 实验方法
1.2.1 H22腹水型瘤株悬液制备:在无菌环境下,将鼠源性肝癌细胞株H22注入Balb/c小鼠腹腔内,荷瘤10 d;荷瘤小鼠腹水异常增加时,处死小鼠并收集腹水,在22 ℃条件下,30 min内用0.9%氯化钠溶液洗3次,再用0.9%氯化钠溶液调整浓度为1×106/ml癌细胞悬液,通过台盼蓝染色证实H22细胞存活率>95%,置癌细胞悬液于冰盘中待用。
1.2.2 造模分组、给药及取材:40只健康小鼠腋下接种瘤细胞悬液进行造模,小鼠腋下出现瘤体视为成功,从造模成功的小鼠中挑选24只,随机分为三组。替加氟片小鼠用药量计算:替加氟片成人用量为1000 mg/d(体重按60 kg计算),则小鼠每日替加氟灌胃量应为1000 mg/60 kg×9.01×0.02 kg=3 mg。将替加氟片研磨至粉末,加蒸馏水配制成15 mg/ml的混悬液,灌胃0.2 ml/d。培元抗癌汤小鼠用药量计算:培元抗癌汤中各药物重量之和为138 g,小鼠每公斤体重用药量计算为:138 g/60 kg×9.01×0.02 kg=0.4 g,中药用药浓度为2 g/ml,灌胃0.2 ml/d。模型组:予0.9%氯化钠溶液0.2 ml/只,灌胃。替加氟组:予浓度为15 mg/ml替加氟溶液0.2 ml/只,灌胃。中西结合组:予浓度为4 g/ml中药汤剂0.1 ml/只,灌胃,浓度30 mg/ml替加氟溶液0.1 ml/只,灌胃。每日用药1次,连续用药14 d。用药后第15日,小鼠脱臼处死,在超净工作台上,解剖剥离小鼠腋下的瘤体,除去瘤体周围的组织,0.9%氯化钠溶液冲洗,并测量其大小、重量,计算抑瘤率。
1.2.3 观察各组小鼠一般情况:观察每组小鼠进食、饮水、毛色以及活动状况,测试其反应度,是否出现腹泻、消瘦或死亡等不良情况并做记录。
1.2.4 计算各组小鼠抑瘤率:小鼠全部脱臼处死后,取瘤组织称重并计算抑瘤率。抑瘤率=[(模型组平均瘤重-药物干预组平均瘤重)]/模型组平均瘤重×100%。
1.2.5 各组小鼠α-SMA、Vimentin、CXCL1、CXCL2、CXCL8蛋白表达检测:把少量瘤组织放于匀浆器球状部位,剪碎,加裂解液(含苯甲基磺酰氟)在匀浆器中进行匀浆,严格按照BCA蛋白定量测试盒说明书操作,测定蛋白质浓度。放入沸水中水浴10 min,冷却后在-20 ℃冰箱存放。以RIPA裂解液调整蛋白浓度,5×还原样品缓冲液滴加后调整样品终浓度2 mg/ml。配制好含有5%脱脂奶粉的TBST,将转膜完成的PVDF膜放入其中,室温,置于摇床上晃动2 h。加入稀释过的相应一抗,PVDF膜浸泡其中,4 ℃下孵育过夜,缓慢晃动。按照1∶50000的比例稀释相应的辣根过氧化物酶,用以标记二抗,PVDF膜浸泡其中,37 ℃下孵育2 h,缓慢晃动。TBST充分洗涤PVDF膜5~6次、5 min/次。配制好发光溶液并滴至PVDF膜上,用X线胶片压片,再加入显影液、定影液,最后冲洗胶片;扫描胶片,用Band Scan软件分析胶片灰度值,计算α-SMA、Vimentin、CXCL1、CXCL2、CXCL8蛋白表达量。
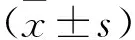
2 结 果
2.1 各组小鼠一般情况比较 干预后,模型组小鼠瘤体逐渐增大,进食、饮水量日益减少,毛色暗黄,对外界刺激反应逐渐下降,数只小鼠蜷缩在一起,活动明显减少。替加氟组与模型组小鼠比较,进食、饮水量明显增多,体重增加,可见腋下瘤体,但瘤体未明显增大,毛色正常,对于外界刺激反应相对灵敏。中西结合组小鼠进食、饮水状况良好,体重有所增加,腋下瘤体明显小于其他组,对外部刺激反应敏感,活动无明显异常。
2.2 各组小鼠瘤体重量及抑瘤率比较 见表1。替加氟组、中西结合组瘤体重量低于模型组,差异有统计学意义 (均P<0.05);中西结合组瘤体重量低于替加氟组,差异有统计学意义(P<0.05)。中西结合组抑瘤率高于替加氟组(P<0.05)。

表1 各组小鼠瘤体重量及抑瘤率比较
2.3 各组小鼠α-SMA、Vimentin蛋白表达比较 替加氟组、中西结合组小鼠α-SMA、Vimentin蛋白表达低于模型组,差异有统计学意义(均P<0.05);中西结合组较替加氟组的α-SMA、Vimentin蛋白表达低,差异有统计学意义(均P<0.05)。见表2(图1)。
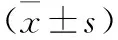
表2 各组小鼠α-SMA、Vimentin蛋白表达比较

1:模型组;2:替加氟组;3:中西结合组
2.4 各组小鼠CXCL1、CXCL2、CXCL8蛋白表达比较 替加氟组、中西结合组小鼠CXCL1、CXCL2、CXCL8蛋白表达低于模型组,差异有统计学意义 (均P<0.05)。中西结合组的CXCL1、CXCL2、CXCL8蛋白表达较替加氟组低,差异有统计学意义(均P<0.05)。见表3(图2)。
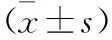
表3 各组小鼠CXCL1、CXCL2、CXCL8蛋白表达比较
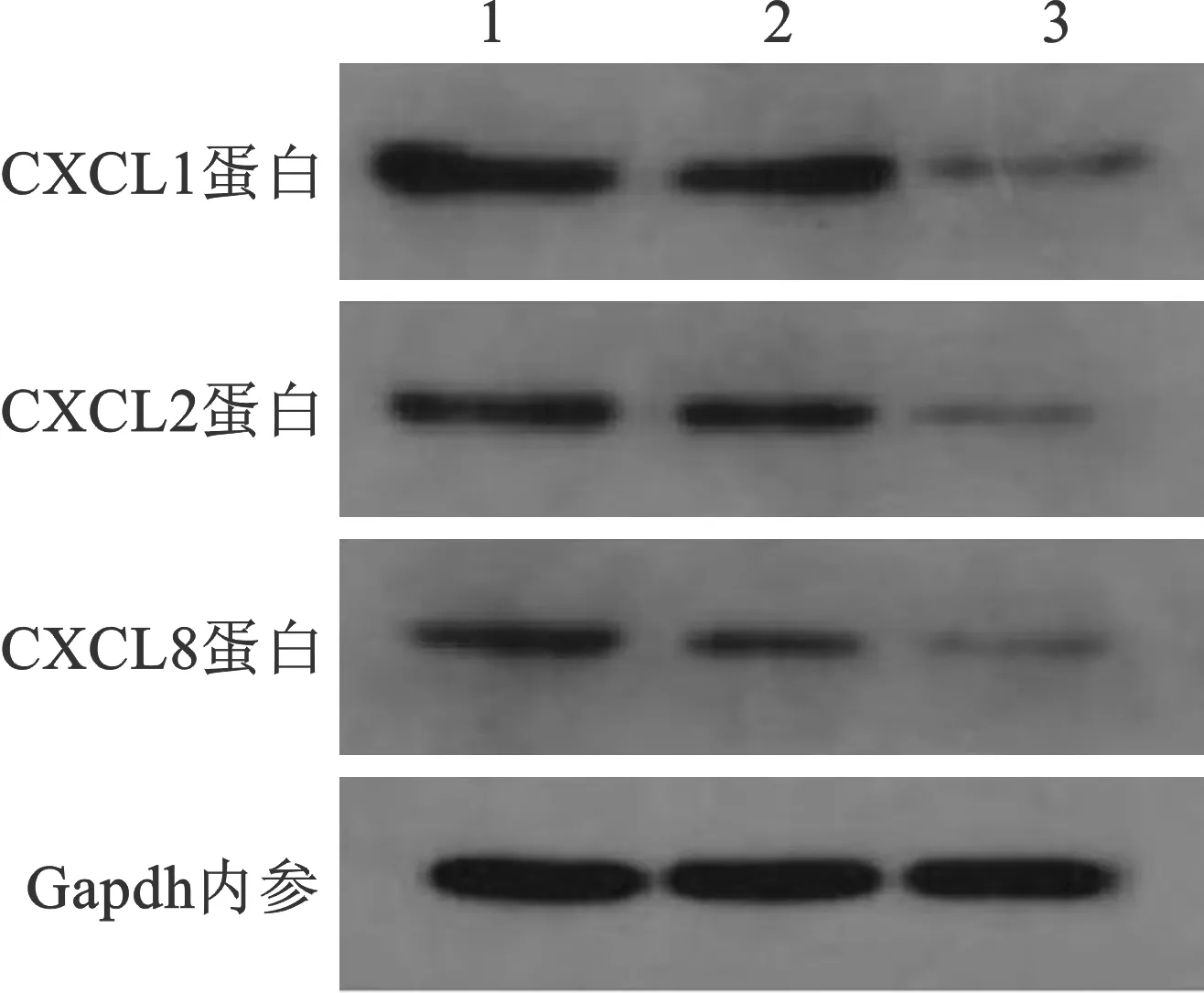
1:模型组;2:替加氟组;3:中西结合组
3 讨 论
目前,恶性肿瘤的发病率和病死率呈上升趋势,严重威胁人类健康,且我国属肝癌高发地区,年发病率和病死率均超过全球总数的50%[13-14]。中医认为肝癌的发生,受正气内虚、外感邪毒、内伤七情、饮食失宜等多重因素共同作用,导致脏腑气血运行失常、气滞痰凝血瘀,相互搏结,湿热久蕴,渐成肝积。培元抗癌汤由西洋参、郁金、黄芪、炒白术、莪术、白花蛇舌草、茯苓、厚朴等药物组成,全方以培元祛邪,标本兼治,诸药合用,祛邪而不伤正。CAFs是肿瘤微环境中参与肿瘤生长、转移最重要的细胞成分之一,CAFs既能直接刺激肿瘤细胞的生长,又能间接提高癌细胞的侵袭力,以上作用通过CAFs自身分泌的细胞因子、趋化因子、促炎介质等实现,在肿瘤形成阶段起重要作用。α-SMA起支撑细胞的作用,参与真核细胞微丝结构的形成,有研究证实肝癌的分化程度与α-SMA的表达有关[15],恶性程度高的低分化肝癌中α-SMA表达最高。Vimentin作为细胞骨架蛋白之一,是一种特异性分布于间质细胞的中间丝蛋白,Vimentin和α-SMA为癌相关成纤维细胞的标志性蛋白,其表达与CAFs数量和活性程度相关。研究表明CAFs促进肿瘤细胞生长、血管生成,CXCL可促进其增殖、迁移[16]。研究发现不仅肝癌细胞可以分泌CXCL1,促进癌细胞侵袭,CXCL1在黑色素瘤、卵巢癌、结直肠癌、胃癌、乳腺癌、食管癌等多种恶性肿瘤生长和侵袭转移等方面起到决定性作用。另有研究证实 CXCL2对肝癌细胞生长、发展和侵袭转移起关键作用[17]。CXCL8是一个被广泛研究的细胞因子,它能加速内皮细胞的增殖和迁移,抑制内皮细胞凋亡,促进肿瘤血管生成,CXCL8高表达与肝癌的发生、侵袭和转移显著相关[18-19]。因此抑制CAFs及其分泌的CXCL1、CXCL2、CXCL8可起到抑制肿瘤的作用。近年来,不断有研究发现复方中药能通过调节CAFs治疗恶性肿瘤[20]。本实验研究发现,培元抗癌汤联合替加氟干预肝癌模型后,其小鼠一般状态较好,优于其他各组,提示中药在改善生存质量方面有优势,这与临床中医药治疗恶性肿瘤疗效相一致。各用药组移植瘤瘤体重量明显低于模型组,中西结合组可明显抑制瘤体生长,提示中药联合化疗在控制肿瘤生长方面要优于单纯化疗,这可能与干预肿瘤微环境有关。中西结合组可明显降低α-SMA、Vimentin、CXCL1、CXCL2、CXCL8蛋白的表达,提示中西医联合用药可能通过抑制α-SMA、Vimentin、CXCL1、CXCL2、CXCL8水平,达到抑制肿瘤生长的目的。
