CBX3通过STAT3信号通路调控乳腺癌细胞增殖、迁移
2021-09-20杨清峰张发苏
徐 彬 杨清峰 汪 洋 刘 萍 张发苏
乳腺癌发病率和死亡率居女性恶性肿瘤之首,对女性的健康和生命构成严重威胁。随着早期检测技术的改善和乳腺癌治疗的进步,乳腺癌患者的生存期越来越长。五年存活率从1976年的75%上升到2017年的91%。尽管乳腺癌的诊断和治疗(包括根治性手术和辅助治疗)取得了进展,但由于侵袭性的临床生物学行为,导致晚期生存率仍然很低。因此,寻找新的治疗乳腺癌的靶点是非常重要的。
染色体盒蛋白同源物3(chromobox 3,CBX3)属于异染色质蛋白1(Heterochromatin Protein 1,HP1)家族,参与转录激活或抑制、细胞分化和生长、表观遗传修饰。最近的一些研究已经确定了CBX3在不同类型的人类癌症中的表达和作用。CBX3在人结直肠癌中表达增加,促进了肿瘤细胞的体内外增殖,这与其对结直肠癌细胞中CDKN1A的调控有关。Liang Y K等通过CCLE、ONCOMINE、Xena公共数据中心和Kaplan-Meier plotter等一系列数据库的分析,报道了CBX家族成员对乳腺癌患者的预后价值。结果发现,CBX家族成员的mRNA表达在乳腺癌组明显高于正常对照组。生存分析显示,CBX3 mRNA高表达与所有乳腺癌患者的无复发生存(RFS)恶化相关。说明在乳腺癌发生发展中发挥重要作用,而其可能涉及到的下游机制,有待进一步研究。本研究旨在探讨CBX3在乳腺癌组织中的表达,及其对乳腺癌细胞增殖、迁移的影响,并初步研究其下游作用机制,以期为乳腺癌治疗提供新的思路。本研究首次探讨CBX3在乳腺癌中的功能作用和预后价值。利用基因高表达和沉默技术检测CBX3是否可以通过调控STAT3的表达发挥对乳腺癌细胞增殖、迁移的影响。
1 材料与方法
1.1 数据库分析 本研究通过TCGA官方数据库下载1222例非配对乳腺癌及癌旁组织、112例(年龄41~71岁,全部为女性、安徽省妇幼保健院乳腺科乳腺癌患者)配对乳腺癌及癌旁组织中患者的基因表达数据。利用perl软件和R语言软件整合乳腺癌表达谱数据,分析CBX3基因在乳腺癌组织和配对癌旁组织中的表达情况。
1.2 试剂与仪器 正常人乳腺上皮细胞株MCF-10A,乳腺癌细胞株MDA-MB-231购自广州赛库生物科技有限公司,乳腺癌细胞株MCF-7、SKBr3来自医学遗传中心实验室;DMEM培养基购于美国Hyclone公司;Trizol试剂、ECL显色液、脂质体 Lipofectamine TM2000转染试剂购于美国Invitrogen公司;CBX3过表达质粒及siRNA由上海吉玛公司设计合成;MTT试剂购于美国 Sigma公司;Transwell小室购于碧云天生物技术有限公司;GAPDH、CBX3、E-cadherin、Vimentin、N-cadherin、Jak2、p-Jak2、STAT3、p-STAT3一 抗及辣根过氧化物酶标记的羊抗兔/鼠二抗均购于Abbkine科技有限公司。
1.3 细胞培养 正常人乳腺上皮细胞MCF-10A,培养于含10%胎牛血清和100 U/mL青霉素,100 μg/mL链霉素的RPMI-1640培养基,乳腺癌细胞株MDA-MB-231、MCF-7、SKBr3分别培养于含有10%胎牛血清和100 U/mL青霉素,100 μg/mL链霉素的DMEM培养基,5% CO、37 ℃条件培养箱中传代培养,以进行后续实验。
1.4 细胞转染及分组 取对数生长期细胞,于转染前24 h将细胞以30×10个/孔接种于6孔板;转染时按照脂质体Lipofectamine TM2000转染试剂说明书,MCF-7细胞分别转染高表达质粒,记作CBX3、NC(细胞转染阴性对照组)、空白对照组(未转染的MCF-7细胞);siRNA记作si-CBX3、si-NC、空白对照组(未转染的MCF-7细胞),转染时加入相应试剂并混合均匀,将细胞培养基换为无血清培养基,5% CO、37 ℃条件培养箱培养6 h后更换新鲜培养基,然后进行后续实验。实验分组:Control组(未转染的空白对照组)、NC组、CBX3组;Control组(未转染的空白对照组)、si-NC组(细胞转染阴性对照NC)、si-CBX3组。
1.5 Western Blot检测 转染48 h的细胞加入预冷的RIPA裂解液提取总蛋白,BCA法测定蛋白浓度;加入蛋白上样缓冲液,调整蛋白为相同浓度,95 ℃煮沸5 min使蛋白变性;10% SDS-PAGE电泳分离蛋白,分离后的蛋白转移至PVDF膜,5%脱脂奶封闭2 h;一抗(CBX3、GAPDH、E-cadherin、Vimentin、N-cadherin、JAK2、p-JAK2、STAT3、p-STAT3)按1:1000稀释,4 ℃摇床孵育过夜,二抗1:5000稀释,摇床孵育2 h;ECL发光试剂,暗室曝光拍照,以Image J软件分析目的蛋白,GAPDH为内参计算蛋白的灰度值,以其比值为蛋白的相对表达水平。
1.6 MTT法检测 待检测细胞用胰蛋白酶消化,以5×10个/mL细胞悬液,每孔200 μL,加入96孔板中,DMEM培养基培养,细胞贴壁后,分别以24、48、72 h加入MTT溶液20 μL混匀,继续孵育4 h;每孔加 DMSO 150 μL,培养30 min;酶标仪检测490 nm处的吸光值(OD值),计算细胞增殖抑制率,抑制率=(1-实验组OD值)/对照组OD值×100%。
1.7 克隆形成实验 转染24 h后收集细胞,进行细胞计数后,将500个细胞接种于6孔板内,在5%CO、37 ℃条件培养箱培养2周后,弃去培养基,加入4%多聚甲醛,室温固定20 min,结晶紫染色10 min后,拍照。
1.8 Transwell实 验 细 胞 以2×10个/mL加 入Transwell小室,上室加入新鲜无血清DMEM培养基100 μL,下室加入含有10% FBS的DMEM培养基600 μL,培养48 h后下室用多聚甲醛固定15 min,结晶紫染色10 min;显微镜下观察,随机选取5个高倍视野,计算迁移细胞数。
1.9 统计学方法 采用SPSS22.0 统计学软件进行数据分析,GraphPadPrism进行图片的制作。两组间数据比较采用t
检验,多组间比较采用单因素方差分析。P
<0.05为差异有统计学意义。2 结 果
2.1 TCGA数据库分析CBX3在乳腺癌组织的表达水平 TCGA数据分析显示,在非配对样本中,CBX3在乳腺癌组织的蛋白表达水平明显高于癌旁组织,差异有统计学意义(见图1,P
<0.001)。而在配对样本中,与癌旁组织相比,乳腺癌组织中CBX3的蛋白表达水平明显增加,差异有统计学意义(P
<0.001)。见图1。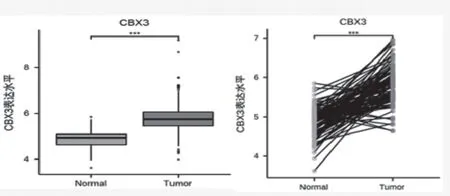
图1 TCGA数据库分析CBX3在与乳腺癌组织与癌旁组织中的表达水平
2.2 CBX3在乳腺癌细胞中的表达 Western Blo检测结果显示,与正常乳腺上皮细胞MCF-10A相比较,乳腺癌细胞MDA-MB-231、SKBr3、MCF-7中,CBX3蛋白表达水平均升高(见图2,P
<0.001),选择表达水平最高的MCF-7细胞进行后续实验。
图2 CBX3在正常人乳腺上皮细胞和乳腺癌细胞中的表达
2.3 CBX3基因高表达和沉默后的表达水平分析 Western Blot检测显示,与Control、si-NC组比较,si-CBX3组MCF-7细胞中CBX3的蛋白表达水平显著降低(P
<0.05)。见图3A。与Control、NC组比较,CBX3组MCF-7细胞中CBX3蛋白表达水平显著升高(P
<0.05)。见图3B。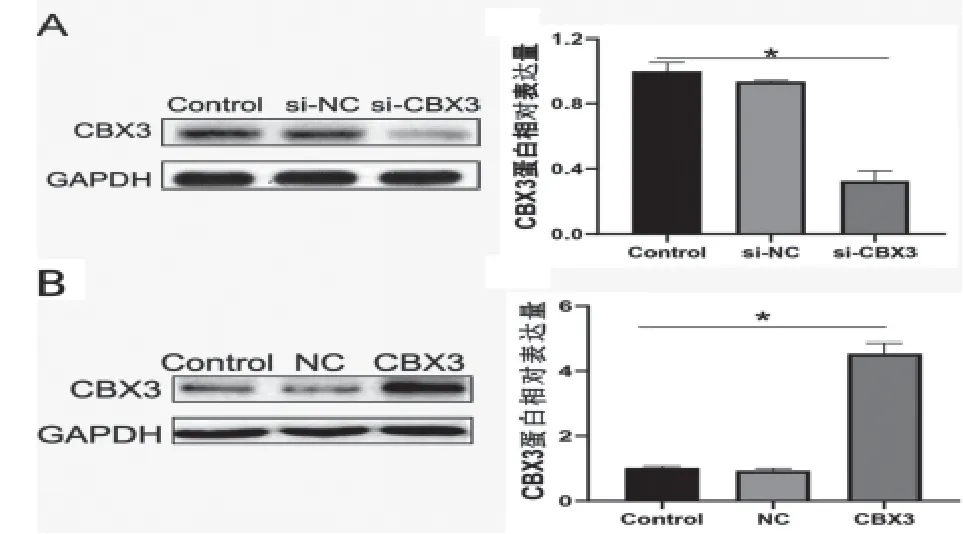
图3 转染过高表达质粒及siRNA 48 h后MCF-7细胞中CBX3的表达
2.4 CBX3基因对乳腺癌细胞增殖的影响 克隆形成实验检测显示,转染si-CBX3后的MCF-7细胞形成的细胞集落数目少于对照组(P
<0.05)。见图4A;MTT检测显示,与si-NC组比较,si-CBX3组乳腺癌细胞株MCF-7细胞24、48、72h增殖抑制率显著升高(P
<0.05)。见图4B。同样的,过表达CBX3后,CBX3组MCF-7细胞形成的细胞集落数目明显多于对照组(P
<0.05)。见图4C;MTT检测显示,与NC组比较,CBX3组MCF-7细胞24、48、72 h增殖抑制率显著下降(P
<0.05)。见图4D。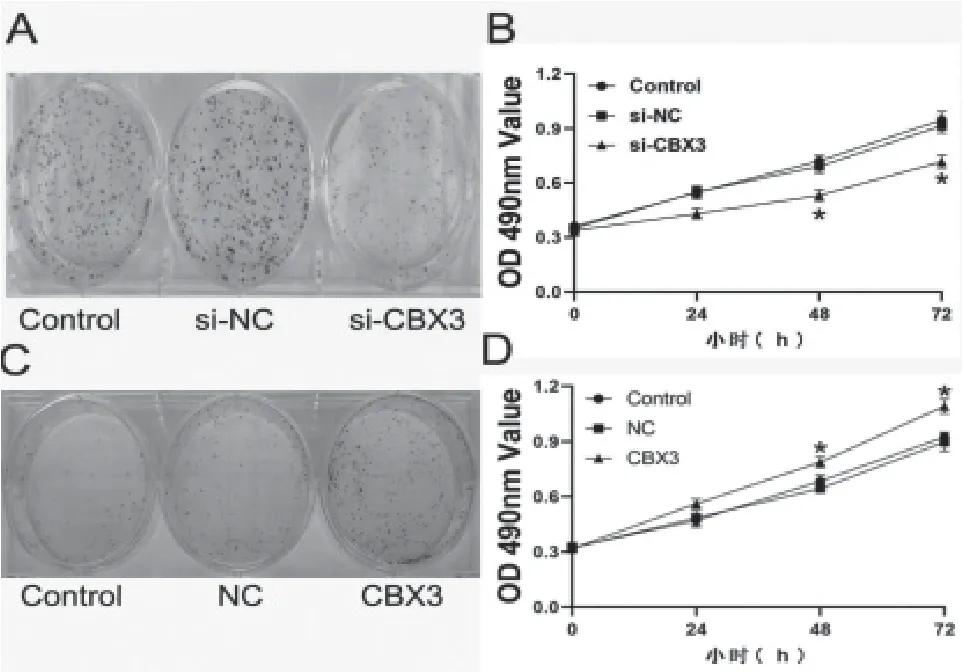
图4 CBX3基因对乳腺癌细胞增殖的影响
2.5 CBX3基因对乳腺癌细胞迁移的影响 Transwell实验显示,与si-NC组比较,si-CBX3组乳腺癌细胞株MCF-7细胞的迁移细胞数目显著降低(P
<0.05)。见图5A;高表达CBX3后,与NC组比较,CBX3组MCF-7细胞的迁移细胞数目显著增高(P
<0.05)。见图5B。
图5 CBX3对细胞迁移能力的影响
2.6 CBX3基因对上皮细胞-间质细胞转化(EMT)的影响 Western Blot检测结果显示,与si-NC组比较,si-CBX3组MCF-7细胞中E-cadherin蛋白表达水平显著升高,而N- cadherin、Vimentin蛋白表达水平下降明显(P
<0.05)。见图6A。过表达CBX3后,与NC组相比,CBX3组MCF-7细胞中E-cadherin蛋白水平显著下降,而N-cadherin、Vimentin蛋白表达水平明显升高(P
<0.05)。见图6B。
图6 CBX3对上皮间质转化的影响
2.7 CBX3基因对STAT3信号通路的影响 Western Blot检测显示,与si-NC组比较,si-CBX3组MCF-7细胞中p-JAK2、p-STAT3蛋白水平显著降低(P
<0.05)。见图7A。过表达CBX3后,与NC组相比,CBX3组MCF-7细胞中p-JAK2、p-STAT3蛋白水平显著升高(P
<0.05)。见图7B。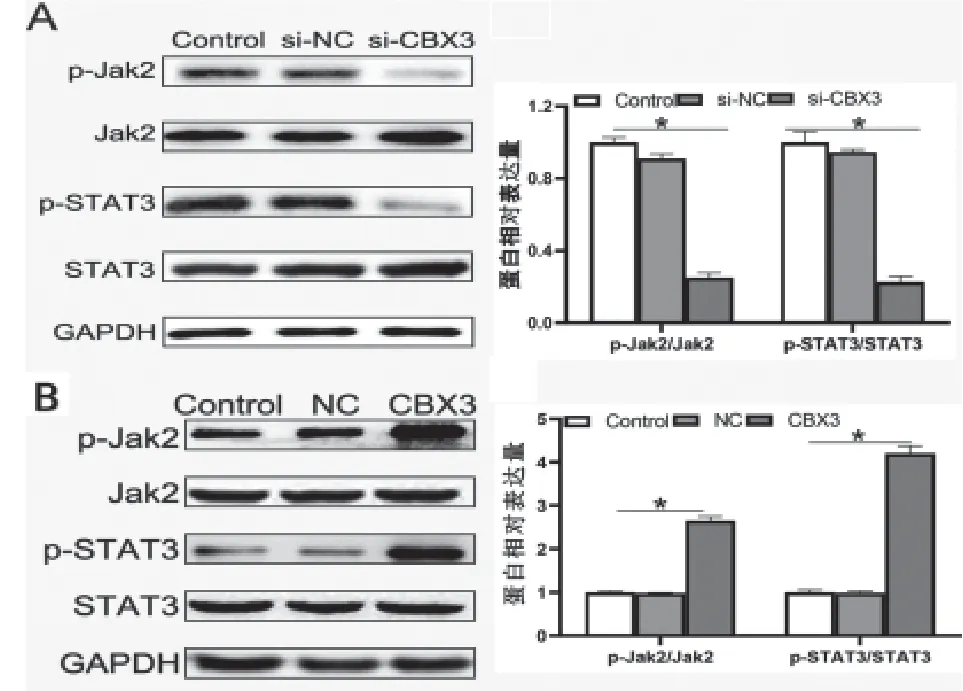
图7 CBX3对STAT3信号通路的影响
3 讨 论
随着癌症发病率的增加,人类从未停止探索癌症的有效治疗方法和预后生物标志物。CBX3属于HP1家族,也被称为染色质结合蛋白,包含一个N端染色质结构域和一个C端染色质阴影结构域。HP1蛋白通过直接与甲基化H3K9(组蛋白H3在赖氨酸9处带甲基)的启动子区结合,调控异染色质、基因表达和发育过程。一般来说,CBX3编码的异染色质蛋白1γ(HP1γ)是HP1的相似物,在多种癌症中发挥多种生物学功能,并与预后相关。
目前一些研究发现,HP1的CBX 2/3/4/7/8基因表达物、可促进宫颈癌细胞的增殖、迁移和侵袭;在宫颈癌的发生发展中发挥癌基因的作用;可活化宫颈癌细胞JAK/STAT3信号通路,上调Bcl-2、STAT3、p21、p-STAT3(ser727)蛋白的表达,促进宫颈癌细胞增殖、迁移、侵袭。JAK/STAT3信号通路抑制剂AG490可显著下调CBX表达、减少宫颈癌细胞增殖、迁移、侵袭。已有研究报道,CBX3的异常表达与各种癌症的预后密切相关。进一步的实验也证实了CBX3能够抑制多种癌细胞系的发展。因此,它是一个潜在的癌症治疗靶点。Chang S C等的研究发现CBX3在非小细胞肺癌(NSCLC)中高表达 。因此,我们推测CBX3的高表达是NSCLC患者预后不良的一个预测因素。在细胞周期方面,CBX3在舌鳞状细胞癌中被证实可促进G1/S细胞周期的转变。CBX3不仅在恶性肿瘤的发生发展过程中起着至关重要的作用,而且成为肿瘤患者可靠的预后指标和潜在的靶向治疗位点。然而,CBX3在乳腺癌的预后和进展中的作用尚未得到充分的证实。
通过对人乳腺癌组织及细胞中CBX3基因表达的检测,我们发现CBX3在乳腺癌组织及细胞中的表达水平显著升高。我们进一步通过转染的方法,高表达及下调CBX3基因在体外的表达水平,来探究CBX3基因对乳腺癌细胞MCF-7的增殖、迁移是否有影响。结果表明,沉默CBX3表达后,si-CBX3组MCF-7细胞中CBX3的蛋白水平显著降低;细胞增殖抑制率显著升高。相反地,高表达CBX3表达后,MCF-7细胞中CBX3的蛋白水平显著升高。细胞增殖抑制率明显下降。提示CBX3的表达与乳腺癌细胞的增殖具有现状相关性。Chen L Y等的研究发现CBX3过表达诱导了胰腺癌细胞的迁移和侵袭,并导致了小鼠原位胰腺癌肿瘤的体内生长。与该研究结果一致的是,沉默CBX3表达后,细胞迁移抑制率显著升高,Vimentin、N-cadherin水平显著下降,E-cadherin水平明显升高;高表达CBX3后,细胞迁移率显著升高,Vimentin、N-cadherin水平升高,E-cadherin水平明显下降,提示体外抑制CBX3的表达,乳腺癌细胞的迁移能力受到抑制。
目前已经发现,JAK2/STAT3信号通路在多种肿瘤发生发展中发挥重要作用。据报道,JAK2/STAT3信号参与调节膀胱癌、肝癌、宫颈癌、乳腺癌、食管鳞癌细胞的迁移、侵袭和转移。基本转录因子3主要通过刺激JAK2/STAT3信号通路来加速胃癌发展。LncRNA HOST2下调可通过弱化JAK2和STAT3的磷酸化水平来抑制细胞迁移和侵袭。这些数据指出了JAK2/STAT3信号通路的激活在癌症进展过程中的重要作用。同样,在我们的研究中,CBX3敲低导致JAK2/STAT3通路失活,从而减缓乳腺癌的进展;CBX3过表达激活JAK2/STAT3通路,从而促进乳腺癌的进展。
综上所述,我们的研究结果表明,CBX3在人类乳腺癌的预后和进展中具有重要意义。CBX3在人乳腺癌组织和细胞中高表达。此外,应用JAK/STAT3信号通路抑制剂AG490等下调CBX3的表达,可通过抑制STAT3信号通路、抑制乳腺癌的肿瘤发生、侵袭、迁移。因此,CBX3可以作为乳腺癌患者潜在的独立预后生物标志物。
