大剂量奥施康定联合华蟾素治疗癌痛的效果观察
2021-09-19领兄王儒帅
领兄 王儒帅


【摘要】目的: 观察大剂量奥施康定(剂量超过80mg/12h)联合华蟾素胶囊治疗癌性疼痛的效果。方法: 自2018年3月至2020年3月选取符合入组标准的62例恶性肿瘤伴重度癌性疼痛患者为研究对象,并随机均分为观察组和对照组,每组31例。两组患者除进行常规的抗癌治疗外,观察组患者采用奥施康定联合应用华蟾素胶囊镇痛治疗,对照组患者则单用奥施康定治疗。治疗1个月后,比较两组患者止痛效果、KPS及临床疗效。结论: 对恶性肿瘤伴有癌痛患者采取华蟾素胶囊联合奥施康定进行止痛治疗,能有效改善患者生活治疗,减轻疾病痛苦,降低止痛药物副作用发生率。
【关键词】华蟾素胶囊; 盐酸羟考酮缓释片; 大剂量; 癌痛
恶性肿瘤是世界上最常见的十大疾病之一,其发病率及死亡率都较高而且容易出现并发症,随着治疗水平的提高,对于恶性肿瘤并发症的治疗也在进一步完善,其中最需要解决的就是肿瘤患者的癌痛问题,癌性疼痛会显著降低中晚期患者生活质量,增加患者对治疗的抵触情绪以及严重的心理负担,甚至可能影响到患者的下一步治疗。数据表明,初诊癌症患者约有25%会伴有疼痛症状,而中晚期患者的癌性疼痛发生率可达2/3以上,其中重度癌痛患者占疼痛患者的30%,可见癌性疼痛发生率高伴随时间长,是困扰癌症患者及其家属的头等问题,所以WHO所提倡的癌症综合治疗规划中四项重点任务之一就是积极治疗癌痛。尤其对于严重癌痛患者的疼痛缓解程度是治疗过程中面临的首要问题,大剂量以及多种类联合使用止痛药物都会增加便秘、恶心、呕吐以及嗜睡等不良反应,甚至增加患者家庭的经济负担。华蟾素作为我国抗肿瘤中成药物中的优秀代表,主要有效成分为蟾毒色胺、蟾毒色胺内盐、去羟基蟾毒色胺等物質,在既往研究中表现出了出色的抗癌止痛作用。本研究寄期望于大剂量止痛药物联合华蟾素治疗癌性疼痛有可观的缓解作用,同时可减少大剂量止痛药物导致的不良反应,现研究结果如下。
资料与方法
1 入组标准
1.1 纳入标准 年龄≥18 周岁;有明确的病理学或细胞学确诊为中晚期癌症;有使用盐酸羟考酮缓释片镇痛的治疗指征;既往≥1月连续服用盐酸羟考酮缓释片的过程中,存在剂量≥80 mg/12h的情况;患者基本生命体征平稳;患者本人及患者家属(监护人)同意该实验并签署知情同意书。
1.2 排除标准 已知对羟考酮或华蟾素中的任何成分过敏者; 已知有任何禁止使用阿片类药物的情况;已知患者有精神、心脑血管疾病病史;已知患者肝肾功能明显异常;医生认为不适合进行此观察的其他原因。
2 一般资料
选择自2018年3月至2020年3月内蒙古医科大学附属医院肿瘤内科收治的62例恶性肿瘤伴重度癌性疼痛患者为研究对象,随机将分为观察组(O组)和对照组(C组),组中无未成年级残障人士,两组患者一般资料无显著统计学意义( P>0. 05),具有可比性。表1
3 方法
3.1治疗前记录患者的年龄、性别、肿瘤诊断、肿瘤分期情况、疼痛部位、疼痛性质、既往阿片耐受情况以及止痛副作用。
3.2确定大剂量止痛药物最低剂量:大剂量吗啡定义为吗啡缓释片日剂量≥300 mg,按照最新癌症疼痛管理药学专家共识提供的羟考酮与吗啡剂量换算,可定义大剂量盐酸羟考酮缓释片日剂量≥150mg, 即≥75mg Q21h,因大多数医院受到毒麻药物“一品双规”的限制仅有10 mg和40 mg两种剂型,因此从临床实际出发,本研究将羟考酮日剂量调整为≥160 mg,即口服剂量≥80mg Q12h作为大剂量的标准。
3.3对照组处理:患者使用标准计量止痛药物治疗,无特殊情况不加用额外止痛方法,为统一标准使用盐酸羟考酮缓释片(生产厂家:BARD PHARMACEUTICALS LIMITED,批准文号:国药准字H10930078,规格:40mg)治疗,用法:40mg Po BID。
3.4观察组处理:在标准止痛治疗基础上患者加用华蟾素胶囊,本实验统一为(生产厂家:陕西东泰制药有限公司,批准文号:国药准字 Z20050846,规格:0.25g/粒)治疗,用法:0.5g Po TID。
3.5治疗周期:若无特殊情况发生,两组患者治疗疗程均为1月,1月后自动停止实验。
4 疗效标准
根据第6版《临床肿瘤内科手册》中疼痛效果评价,使用疼痛程度数字评估量表(numerical rating scales,NRS)对疼痛程度进行评估,经治疗后NRS≤3分患者的比例称为有效缓解率。见下图:
按主诉疼痛分级(verbal rating scale,VRS)评价治疗后缓解效果,完全缓解(CR):表示疼痛在治疗后完全化解,睡眠饮食正常化;部分缓解(PR):患者疼痛感觉减轻,基本可以安睡;轻度缓解(MR):表示治疗前后无明显变化,睡眠生活仍受疼痛影响;无效(NR):表示患者治疗后疼痛无缓解。
治疗前后分别使用卡氏功能状态评分标准(Karnofsky,KPS)评价患者健康状态。测试后评分≥80分为非依赖级,即生活可自理;50—79分为半依赖级,即生活半自理;<50分则为依赖级,生活不能自理。患者根据 KPS 量表自行填写或者由医师代填。
记录实验组与对照组治疗过程中的不良事件(如恶心、呕吐、嗜睡、便秘等)发生率。
5 统计学分析
数据均以SPSS 20.0(SPSS Inc. Chicago, USA)软件对数据进行统计学分析。计量资料以均数±标准差进行系统描述, 多组间比较采用单因素方差分析,两组间比较采用t检验,不同时间点比较采用重复测量方差分析,计数资料以率表示。以P﹤0.05 为有统计学意义。
结果
1.两组患者临床疗效比较
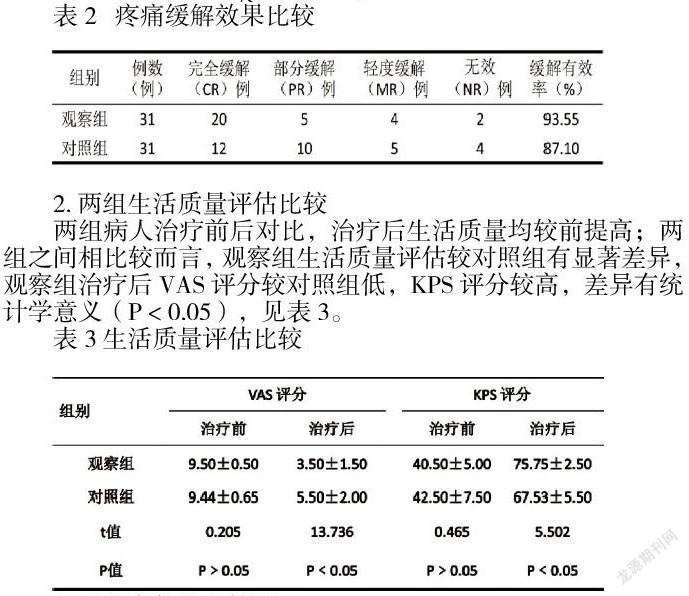
观察组患者临床治疗的有效率显著高于对照组,两组比较差异有统计学意义( χ2=5.3051, P=0.024)。见表 2
2.两组生活质量评估比较
两组病人治疗前后对比,治疗后生活质量均较前提高;两组之间相比较而言,观察组生活质量评估较对照组有显著差异,观察组治疗后VAS评分较对照组低,KPS评分较高,差异有统计学意义(P﹤0.05),见表3。
3.不良事件发生情况
主要不良事件包括便秘、呕吐和焦虑。两组结果表明, 便秘是发生率最高的不良事件(实验组发生率为23.53%,对照组发生率为29.41%;P﹤0.05) ,实验组便秘发生率低于對照组,且有统计学意义。呕吐、焦虑的总发生率为 6. 54% 和 0. 93%,两两之间t检验表明,P﹥0.05,两组之间呕吐与焦虑无明显统计学意义。
讨论:
临床上,晚期癌痛的发病原因包括肿瘤直接性疼痛、肿瘤间接性疼痛和治疗性疼痛。而疼痛的的原因主要是由于肿瘤压迫、侵犯血管、神经、内脏、骨骼,侵犯脑组织造成颅压增高,甚至由于疾病进展造成病理性骨折、空腔脏器的穿孔、梗阻以及压疮等,以上情况约占癌性疼痛临床原因的84.6%。严重的疼痛造成患者生活质量下降明显,情绪更易受到负面影响,甚至会影响到实施既定的治疗计划。强阿片类止痛药物是目前效果最强的止痛类药物,临床上常用于中重度癌性疼痛的治疗,但对于晚期重度癌痛患者,大剂量使用止痛药物会导致其副作用发生机率增高,对药物产生耐受力、使消化系统异常,甚至影响到患者的免疫系统与认知功能。
随着祖国中医药事业的蓬勃发展,越来越多优秀的中草药被发现并研究,其中之一具有代表性的就是华蟾素。华蟾素是从蟾蜍科动物中华大蟾蜍的干皮提取分离的主要药物活性成分,具有清热解毒、止痛祛瘀、通便等功效。有大量研究表明,华蟾素及其主要衍生物蟾蜍灵在体外和体内对多种癌细胞具有抗癌作用。潜在的抗癌分子机制主要涉及抗增殖,凋亡诱导,抗转移,抗血管生成,上皮-间充质转化抑制,抗炎,Na / K-ATPase活性靶向,类固醇受体共激活因子家族抑制等。在抑制结肠癌的侵袭和转移过程中,华蟾素通过抑制Wnt/-catenin信号传导途径,如转移和EMT相关基因MMP9,MMP2,N-钙粘蛋白均明显下调,治疗后而E-钙粘蛋白的表达上调,从而抑制结直肠癌的上皮间充质化以及肿瘤转移,从而提高了患者预后。华蟾素联合紫杉醇治疗肺癌时,可抑制紫杉醇诱导的TRPV1上调和脊髓星形胶质细胞活化以及降低脊髓TNF-α和IL-1β的产生有关,从而可以降低周围性神经炎的发生机率。华蟾素在联合铂类药物时,可有效减少铂类药物的毒副作用,改善患者的生活质量。华蟾素可修复肠道炎性损伤,逆转肠道营养不良并增强肠屏障完整性;此外,它也与某些特定微生物群(如变形杆菌和拟杆菌)的变化与肠道平衡的重建和肠道功能的恢复密切相关。此外华蟾素提取的11种吲哚生物碱在免疫调节和减轻癌症引起的疼痛方面有显著作用,该成分可直接作用于中枢神经调节痛阈,可在短期内缓解疼痛,改善生活质量和减少便秘,恶心和呕吐,头晕,嗜睡,厌食和其他不良反应。
本研究结果显示,实验组治疗后较治疗前疼痛缓解率(93.55%)明显强于对照组(87.10%)的数据结果,差异有统计学意义(P<0.05),其中观察组完全缓解率较对照组高;治疗后,观察组VAS数据低于对照组,而KPS数据比对照组高,差异有统计学意义(P<0.05);且实验组中患者便秘情况明显较对照组轻,表明实验组止疼痛治疗同时药物副作用小。说明对于中晚期癌痛患者使用大剂量奥施康定联合华蟾素治疗,能明显提高临床镇痛效果,降低大剂量止痛药物副作用,在保证患者疗效的前提下,使患者生活质量得到明显改善。
恶性肿瘤的镇痛治疗一直以来都是医学界备受关注的热门研究方向,近些年来随着祖国中医药事业的蓬勃发展,中西医联合治疗恶性肿瘤的显著效果逐渐被大众接受。本实验结果论证了大剂量奥施康定联合华蟾素治疗疗效优于单药使用大剂量奥施康定镇痛治疗,但鉴于该研究中样本量偏少,研究结果可能存在一定差异性,值得进一步扩大临床试验研究论证。
参考文献:
[1]中华人民共和国国家卫生健康委员会.癌症疼痛诊疗规范(2018年版)[J].临床肿瘤学杂志,2018,23 (10): 937-944
[2]石远凯,孙燕.临床肿瘤内科手册[M] 北京:人民卫生出版社,2018:200-230
[3]陈祥,王勇,张进科,等.107例大剂量盐酸羟考酮缓释片治疗中重度癌痛的有效性和安全性研究[J].临床肿瘤学杂志,2020,25(02):167-171
[4]Zhan Xiang,Wu Huan,Wu Hong, et al. Metabolites from Bufo gargarizans (Cantor, 1842): A review of traditional uses, pharmacological activity, toxicity and quality control.[J]. Journal of ethnopharmacology,2020,(246):357-365
[5]Xiyuan Ba,Jiali Wang,Shiyang Zhou, et al. Cinobufacini protects against paclitaxel-induced peripheral neuropathic pain and suppresses TRPV1 up-regulation and spinal astrocyte activation in rats[J]. Biomedicine & Pharmacotherapy,2018,(108):756-760
[6]Xu Jing,Qian Shu-Shu,Chen Yao-Guo, et al. [Systematic review and Meta-analysis of efficacy and safety of Huachansu in treating cancer-related pain].[J]. China journal of Chinese materia medica,2019,44(12):107-113
[7]Wang Jie,Cai Han,Liu Qiaoli, et al. Cinobufacini Inhibits Colon Cancer Invasion and Metastasis via Suppressing Wnt/ β -Catenin Signaling Pathway and EMT.[J]. The American journal of Chinese medicine,2020,(24): 703-718
[8]Xu Yong,Han Di,Feng Fan-Chao et al. Meta-analysis of Cinobufacini Injection combined with platinum-contained first-line chemotherapy in treatment of non-small cell lung cancer.[J] .Zhongguo Zhong Yao ZaZhi, 2019,(44): 4728-4737
[9]Bai Yongfeng,Wang Siwei,Xu Wenkai et al. Cinobufacini ameliorates experimental colitis via modulating the composition of gut microbiota.[J] .PLoS ONE, 2019,(14): 223-231
[10]Qi Fanghua,Wang Jinjing,Zhao Lin et al. Cinobufacini inhibits epithelial-mesenchymal transition of human hepatocellular carcinoma cells through c-Met/ERK signaling pathway.[J] .Biosci Trends, 2018, (12): 291-297
[11]Zhang Xing,Yuan Yuan,Xi Yupeng et al. Cinobufacini Injection Improves the Efficacy of Chemotherapy on Advanced Stage Gastric Cancer: A Systemic Review and Meta-Analysis.[J] .Evid Based Complement Alternat Med, 2018,(10): 362-340
[12]Li Qian,Jiang Chuanwu,Wang Yan et al. Resibufogenin suppresses tumor growth and inhibits glycolysis in ovarian cancer by modulating PIM1.[J] .Naunyn Schmiedebergs Arch. Pharmacol., 2019, (392): 1477-1489
[13]Huang Jihan,Chen Feiyu,Zhong Zhangfeng et al. Interpreting the Pharmacological Mechanisms of Huachansu Capsules on Hepatocellular Carcinoma Through Combining Network Pharmacology and Experimental Evaluation.[J] .Front Pharmacol, 2020, (11): 4-14
作者簡介:领兄(1994-04),女,蒙古族,内蒙古通辽市,在读硕士,主要从事肿瘤学临床相关研究
