添加支链氨基酸的肠外营养支持对肝硬化肝癌大鼠肝部分切除术后营养状态、免疫功能以及肝脏再生的影响
2021-09-18许鹏刘海鹰黄瑜芳杨庆玲
许鹏 刘海鹰 黄瑜芳 杨庆玲

摘 要:目的:添加支链氨基酸(branch chain amino acid,BCAA)的肠外营养支持对肝硬化肝癌大鼠肝部分切除术后营养状态、免疫功能以及肝脏再生的影响。方法:30只SD大鼠模型构建肝硬化肝癌,采用 Higgins 法进行肝中叶部分切除。随机分成观察组和对照组。对照组术后在基础饲料基础上给予8.5%复方氨基酸注射液(18AA-Ⅱ)(Novamin)的肠外营养;观察组采用常规饮食基础上给予10%复方氨基酸(安平)注射液(Hepa)的肠外营养。5 d后,留取血清检测营养学指标和免疫学指标变化;苏木精-伊红(hematoxylin eosin,HE)染色观察各组大鼠肝组织病理改变,Fuelgen染色检测各组大鼠肝组织中DNA的含量变化,免疫组化和Western blot检测各组大鼠肝组织中PCNA和Ki-67蛋白的表达。结果:与对照组相比,观察组大鼠血清营养学指标、免疫学指标以及组织病理明显改善,DNA含量以及PCNA和Ki-67蛋白的表达水平明显升高,差异均有统计学意义(P<0.05)。结论:对肝硬化肝癌大鼠肝部分切除后添加BCAA的营养支持明显有助于改善其营养和免疫状态,促进肝再生。
关键词:支链氨基酸;肝硬化肝癌;肝部分切除;营养状态;免疫功能;肝脏再生
肝硬化和肝癌(DHC)经常在临床上合并出现,常导致患者营养不良以及免疫能力低下。外科切除是目前治疗DHC的常用手段,但是手术会导致患者的营养以及免疫状态更加恶化,诱发患者急性肝衰歇,影响肝再生,危及生命[1]。目前圍术期的营养支持在改善DHC营养状态方面发挥了积极作用,但是营养支持对于免疫功能和肝脏再生方面的研究报道较少[2]。支链氨基酸(BCAA)包括亮氨酸(Leu)、异亮氨酸(Ile)和缬氨酸(Val),主要是细菌、真菌和植物合成,由于人体不能自主合成,而必须从食物中摄取,所以被称为必需氨基酸。因其在结构以及功能的特殊性使得BCAA在医药、食品等方面应用广泛。研究表明,BCAA在机体内不仅参与蛋白质代谢、调控糖类和脂肪代谢,并且BCAA能促进机体内相关蛋白的合成,识别细胞表面的氨基酸转运载体,介导氨基酸信号分子的转运[3]。研究表明,BCAA的肠外营养(PN)支持对改善创伤性患者的代谢有积极作用[4]。Ericksen R E等[5]研究表明,BCAA营养在肝癌肝切除术后的肝再生中发挥重要作用。但未见BCAA的PN支持在DHC术后中的作用的报道。本研究通过构建大鼠DHC 模型,探讨BCAA的PN支持对DHC术后营养状态、免疫功能以及肝再生的作用,以期为临床提供科学依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 12~15周龄的SPF级SD大鼠,共计40只,体重为280~320 g,北京维通利华实验动物技术有限公司,动物质量合格证许可证号:SYXK(京)2017-0022;依照我院实验动物管理办法,室温下标准饲料、自由饮水、分笼(4笼)适应性饲养1周后用于实验。
1.1.2 主要试剂与仪器 复方氨基酸注射液(18AA-Ⅱ)(Novamin,8.5%:250 mL/瓶,内含18种氨基酸,华瑞制药有限公司,国药准字H10980029,批号:1828374);复方氨基酸(安平)注射液(Hepa,10%:500 mL/瓶,内含20种氨基酸,德国B.Braun Melsungen AG生产,批准文号:H20171149,批号:201828464)。苏木精-伊红(HE)试剂盒,Sigma公司;二喹啉甲酸(BCA)蛋白浓度测定试剂盒、3,3-二氨基联苯胺(DAB)化学发光试剂盒,美国Selleck公司;增殖细胞核抗原(PCNA)和细胞核相关抗原ki-67(Ki-67)抗体,美国PALL公司;冰冻切片包埋剂,美国樱花公司;Fuelgen染色试剂盒、免疫组化试剂盒、Western blot试剂盒,美国abcam公司。
苏净Airtech超净工作台,北京六一仪器厂;LEICAEG1150组织包埋机,德国Leica公司;Nikon Ti-U/Ti-s荧光显微镜,型号:H-7650,日本三菱公司;5810R 型高速离心机,日本岛津公司;E-Gel Imager凝胶成像仪,美国Beckma公司。
1.2 方法
1.2.1 肝硬化肝癌大鼠模型的构建[6] 所有大鼠经适应性喂养后,以0.13 mL/100 g剂量皮下注射60% CCl4,每日1次,连续5 d,期间以5%乙醇作为大鼠唯一饮用水,连续40 d,构建肝硬化大鼠模型。待动物稳定7 d后在B超引导下在大鼠肝右叶处注入浓缩的Walker-256癌细胞混悬液50 mL,筛选种植瘤直径在0.5~0.8 cm的大鼠用于后续研究。本研究中有10只未成功,共计30只大鼠成功造模。
1.2.2 分组 将成功造模的30只大鼠随机分成2组:观察组和对照组。采用基础饲料喂养,自由饮水,连续喂养9 d后,依照Higgins法进行手术切除带瘤的大鼠肝中叶(约为其肝脏的35%),缝合伤口,医用酒精消毒,定期换药。PN均从切肝手术第1天开始。依据文献[7]每日均给予两组大鼠171.5 kal/kg非蛋白质热量(热氮比值维持在140∶1),其中氮含量1.22 g/kg,选用 20%中-长链脂肪乳剂提供40%的热量。对照组大鼠氮源由 8.5% Novamin提供,BCAA 占 18.2%,观察组大鼠氮源由10% Hepa提供,BCAA 占33.0%。实验过程中大鼠的输液速度为3 mL/h,持续进行5 d。
1.2.3 各组大鼠营养学指标的测定 术后第6天,将大鼠经腹静脉采血5 mL,离心后获得血清,立即转入-30 ℃低温冰箱保存。50%血清标本在1周内严格按照试剂盒要求检测血红蛋白(Hb)、总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白(LDL)含量。
1.2.4 各组大鼠免疫指标的测定 50%血清标本采用流式细胞仪检测各组大鼠血清中T细胞亚群(CD4+、CD8+)水平,同时免疫散射比浊法检测各组大鼠血清中免疫球蛋白(IgG、IgM)的含量。
1.2.5 HE染色观察各组大鼠肝组织病理改变 采集完毕后将大鼠断头处死,无菌剥离大鼠的肝组织。将90%的肝组织迅速转移到惰性气体罐中,-80 ℃低温冰箱独立保存待测,留取10%肝组织以多聚甲醛固定,石蜡包埋,制成切片后HE 染色,观察各组大鼠肝组织的病理改变。
1.2.6 Fuelgen染色检测各组大鼠肝组织中DNA的含量变化 从冰箱中取出10%各组大鼠肝组织,5%多聚甲醛固定,梯度酒精脱水30 min,石蜡包埋,切片,中性树脂封片,荧光显微镜进行观察,每组切片6个不同的视野,并通过Image-Pro 6.2软件处理图像,统计分析肝组织中DNA含量的变化。
1.2.7 免疫组化检测各组大鼠肝组织中PCNA和Ki-67蛋白的表达 取出10%大鼠肝组织,固定包埋并切片,用二甲苯和梯度乙醇脱蜡后置于柠檬酸盐缓冲液中进行修复,以充分暴露抗原决定簇。然后用3%的双氧水室温下浸泡10 min,封闭,分别加稀释好的一抗4 ℃过夜孵育,次日冲洗干净,分别加入适量生物素标记的二抗室温孵育30 min,清洗。加适量DAB作用2~5 min后用去离子水终止反应,苏木素复染1.5~2 min,清洗后于乙醇梯度脱水,二甲苯浸泡并干燥后用中性树胶封片,镜检观察并记录实验结果,每个样本独立重复测量3次。
1.2.8 Western blot检测各组大鼠肝组织中PCNA和Ki-67蛋白的表达水平 从冰箱中取出10%各组大鼠肝组织,采用常规方法提取目标蛋白PCNA和Ki-67,经BCA试剂盒测定蛋白浓度后,准确量取50 μg,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),结束后,将样品蛋白经湿转法转至PVDF转膜上,加入10%脱脂奶粉封闭3 h,以1∶1 500比例稀释后,维持4 ℃过夜孵育,洗涤加入辣根过氧化物酶(HRP)标记的二抗孵育3 h,增强化学发光ELC显色30 min,经曝光、显影、定影后,以GAPDH为内参来表示蛋白的表达水平。
1.3 统计学分析
数据分析采用软件SPSS 16.0,符合正态分布的计量资料采用平均数±标准差进行表示,多组间比较采用单因素方差分析,两两间比较采用独立t检验,P<0.05表示具有统计学意义。
2 结果与分析
2.1 各组大鼠营养学指标比较
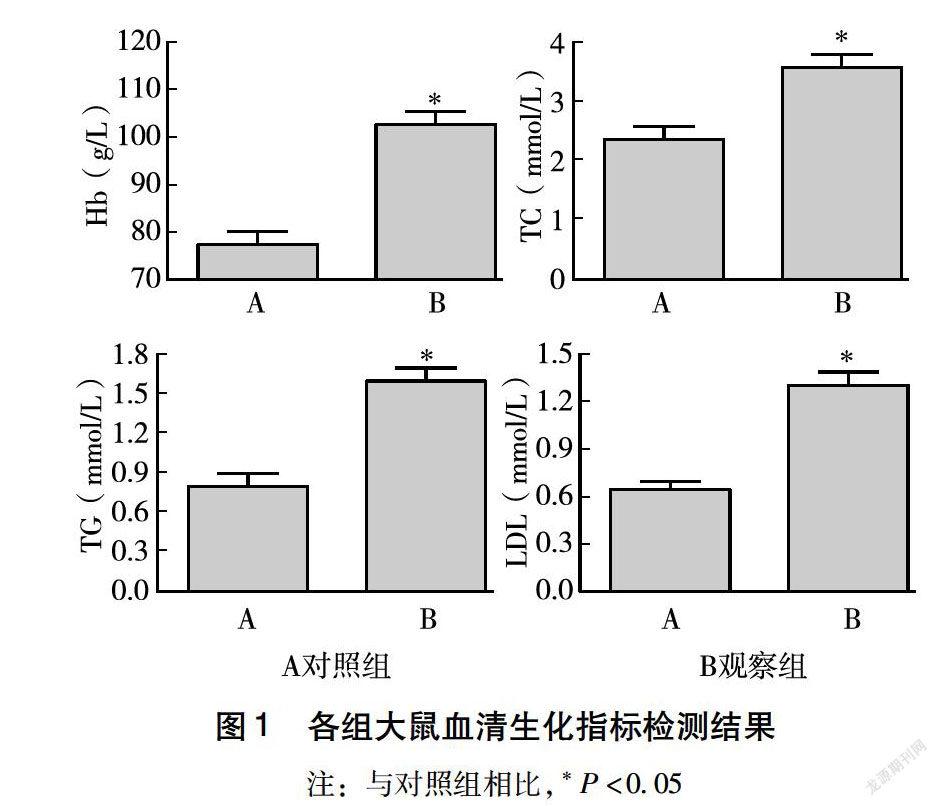
如图1所示,与对照组相比,观察组大鼠血清中Hb、TC、TG、LDL含量明显升高(P<0.05),说明观察组大鼠营养指标明显改善。
2.2 各组大鼠免疫指标的比较
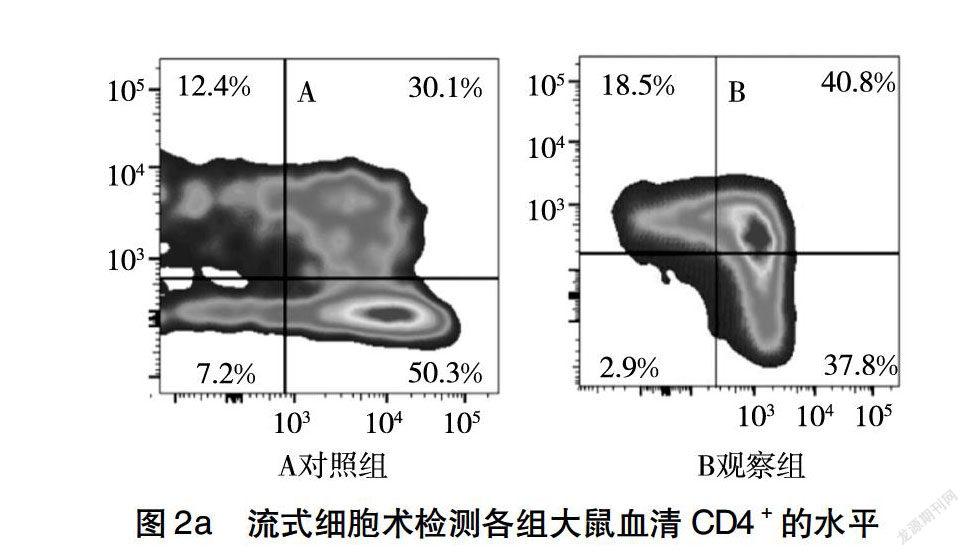
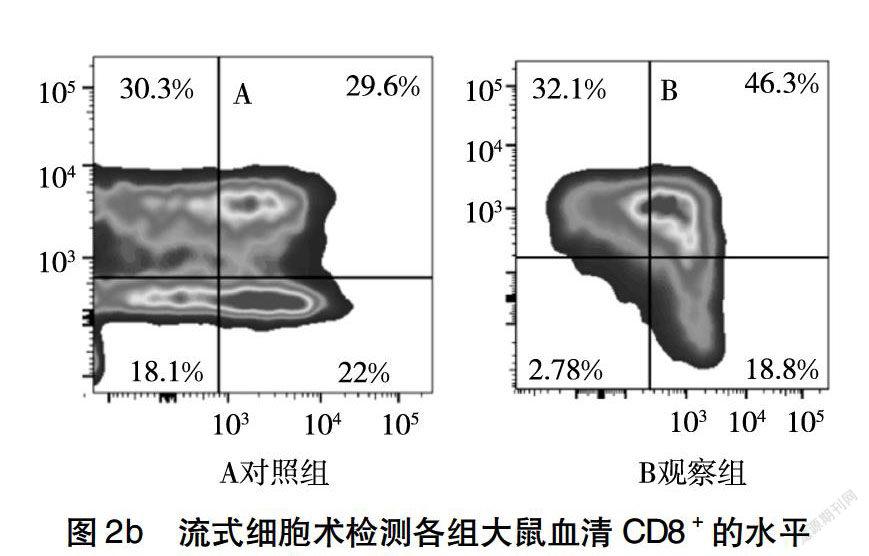
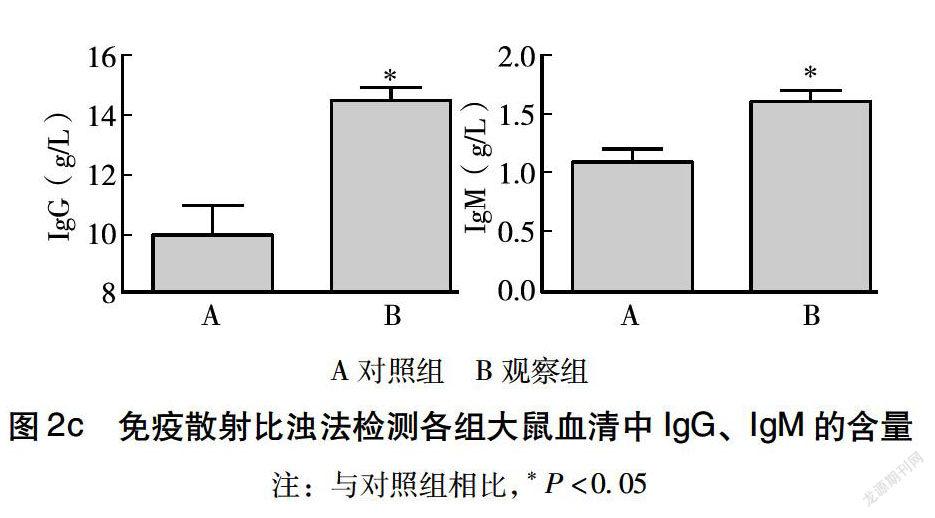
如图2所示,与对照组相比,观察组大鼠血清中细胞免疫指标CD4+和CD8+,体液免疫指标IgG和IgM含量明显升高(P<0.05),说明观察组大鼠免疫性能明显改善。
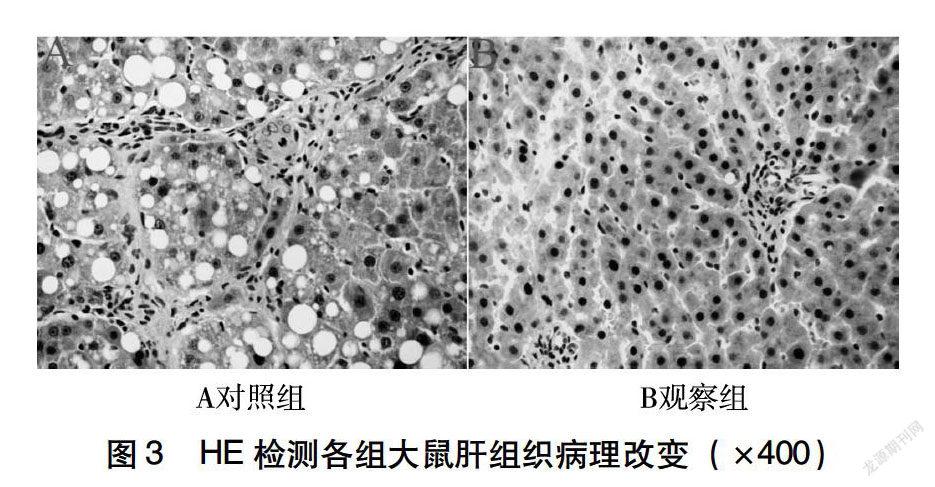
2.3 HE染色观察各组大鼠肝组织病理改变
如图3所示,对照组大鼠肝细胞性状不规则,排列呈蜂窝状或网状,细胞内大量脂滴填充,核仁形状不规则,核膜或凹陷或缺失,细胞内出现水样变性或气球样变性,细胞出现点状坏死或小灶点坏死;观察组大鼠肝细胞形状趋于规则,肝细胞水样变性或气球样变性明显减轻,小灶点坏死面积明显减小。
2.4 Fuelgen染色检测各组大鼠肝组织中DNA的含量变化
如图4所示,与对照组相比,观察组大鼠肝组织中DNA含量明显升高(P<0.05),表明观察组大鼠肝组织再生良好。
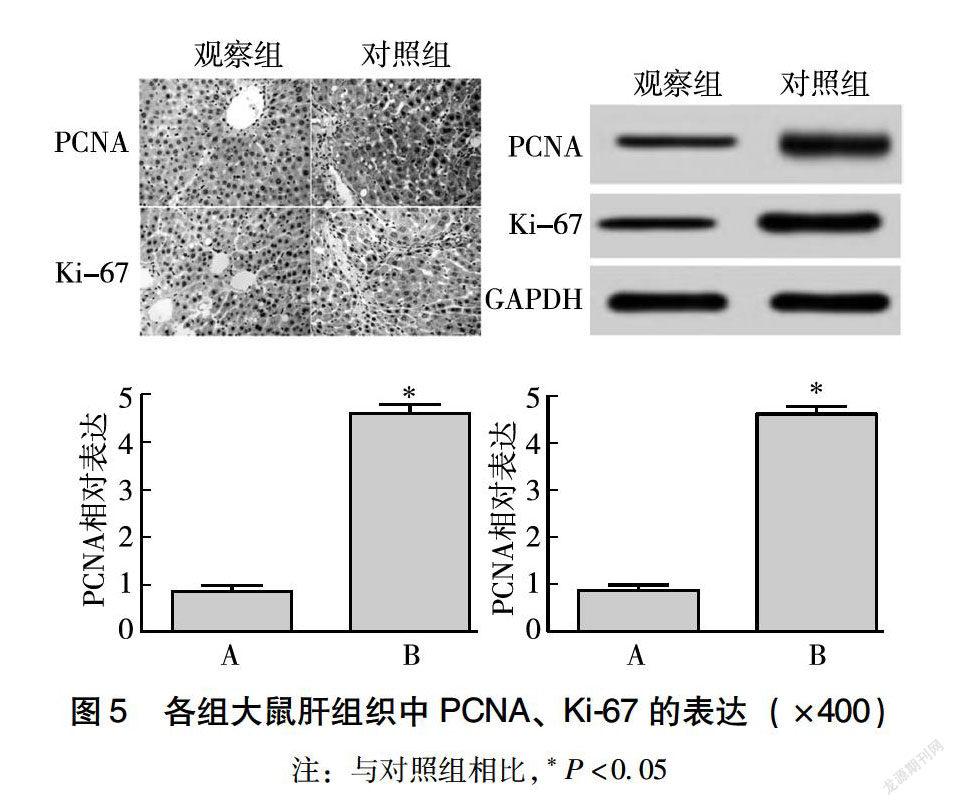
2.5 各组大鼠肝组织中PCNA和Ki-67蛋白的表达
如图5所示,与对照组相比,观察组大鼠肝组织中PCNA和Ki-67的表达明显升高(P<0.05)。
3 讨论
肝脏是具有强大再生能力的器官。肝切除是治疗DHC的首选手段,但研究表明,肝硬化诱发的肝损伤严重影响术后患者的免疫状态、肝功能和肝再生,以及由肝硬化导致的较为严峻的营养状态(尤其是蛋白质能量代谢不良)会诱发不同程度的危及生命的并发症出现[8]。因此,研究DHC术后的营养支持对促进患者术后肝功能的恢复和肝脏再生具有重要意义。
进行肝切除手术时,患者不可避免出现大量出血现象,同时在术中的缺血再灌注损伤和部分肝组织的切除会导致机体进行应激反应,如全身炎症反应综合征等,一方面导致患者物质、能量代谢加剧,蛋白质被急剧消耗,另一方面患者由于摄入不足、消化吸收障碍导致的蛋白质合成能力下降,致使患者出现严重的低蛋白血症、营养状态不佳,严重影响患者的术后康复[9]。如果不能及时纠正,补充蛋白质的摄入量,极有可能导致患者的多器官衰歇危及生命。术后针对患者进行必要而及时的营养支持能有效地减轻患者机体内的负氮现象,维持患者主要器官的必要功能,降低术后感染、出血、免疫低下等并发症的出现概率[10]。Raghupathi S[11]研究得出,对围术期的胃肠道肿瘤患者进行富氨基酸营养支持有助于其免疫以及营养状态的改善。Tajiri K等[12]研究证实,对肝硬化患者术后添加BCAA的PN支持能明显促进患者的肝功能的恢复和肝脏再生。本研究通过对DHC大鼠进行Higgins手术切除肝中叶后进行添加BCAA营养支持,结果发现,与对照组相比,观察组大鼠血清的营养指标、免疫学指标、肝组织学病理均明显改善。
肝再生过程是一个十分复杂的生理过程。DNA的合成、细胞的有丝分裂等过程均需要消耗体内大量的能量。研究显示,正常肝脏切除70%在1周后即可恢复原有体积,但是肝硬化肝脏则需35 d以上[13]。研究显示,肝硬化肝癌患者的肝组织存在代谢异常(尤其是氨基酸代谢)的现象,再加上患者术后进食以及消化困难、肿瘤细胞的消耗导致患者以体质量明显下降的营养不良,体内残肝再生缓慢[14]。刘发强等[15]研究显示,及时的营养支持能明显推动围术期的肝再生。研究显示,BCAA主要进行肝外代谢,能有效地缓解肝脏负担,同时又能高效地进行蛋白质的合成[16]。Holeek M[17]研究證实,对肝硬化患者进行部分肝切除术后给以富含BCAA的营养支持能促进肝细胞的修复和再生过程,降低复发率,增强患者的免疫功能,明显抑制肝癌等恶性事件的发生。PCNA是参与增殖细胞合成DNA的效应蛋白,Ki-67 是一种与细胞有丝分裂密切相关的核蛋白[18]。本研究先使用Fuelgen染色检测大鼠肝组织中DNA的含量变化,结果显示,观察组大鼠肝组织DNA的含量明显升高,接着采用免疫组化检测PCNA和Ki-67的表达,结果显示,观察组大鼠肝组织PCNA和Ki-67的表达的明显升高,说明观察组大鼠肝再生明显强于对照组。
综上所述,对肝硬化肝癌大鼠肝部分切除后添加BCAA的营养支持,明显有助于改善其营养和免疫状态,促进肝再生。但如何将BCAA的营养支持应用到临床上对肝硬化肝癌的治疗还待更深入的研究。◇
参考文献
[1]吴东波,唐红.肝硬化与肝癌癌前病变的研究进展[J].中华肝脏病杂志,2019,27(7):483-486.
[2]郭志学,宋新梅,劉博,等.Omega-3多不饱和脂肪酸、精氨酸和谷氨酰胺的胃肠外营养支持治疗对肝癌患者术后效果分析[J].河北医药,2019,41(6):847-850.
[3]Jackman S R,Witard O C,Philp A,et al.Branched-chain amino acid ingestion stimulates muscle myofibrillar protein synthesis following resistance exercise in humans[J].Frontiers in Physiology,2017,8(6):390-402.
[4]吴迪,张颖,向江侠.支链氨基酸对创伤患者代谢及预后影响的Meta分析[J].创伤外科杂志,2017,19(9):662-665.
[5]Ericksen R E,Lim S L,McDonnell E,et al.Loss of BCAA catabolism during carcinogenesis enhances mTORC1 activity and promotes tumor development and progression[J].Cell Metabolism,2019,29(5):1151-1165.
[6]刘诗泆,刘素兰,尹秋林.黄芪四君子汤联合不同营养方式对肝硬化肝癌大鼠肝部分切除术后营养状态与免疫功能的影响[J].中国老年学杂志,2016,36(23):5807-5809.
[7]金国贤,曲晓翰,郭庆,等.四君子汤联合肠内营养乳剂对肝硬化肝癌大鼠肝部分切除后免疫功能与营养状态的影响[J].解放军医药杂志,2016,28(3):81-84.
[8]Hamid M,Liu D,Abdulrahim Y,et al.Amelioration of CCl4-induced liver injury in rats by selenizing astragalus polysaccharides:Role of proinflammatory cytokines,oxidative stress and hepatic stellate cells[J].Research in Veterinary Science,2017,114(10):202-211.
[9]Fretland A,Dagenborg V J,Bjrnelv G M W,et al. Laparoscopic versus open resection for colorectal liver metastases[J].Annals of Surgery,2018,267(2):199-207.
[10]Ananieva E A,Van Horn C G,Jones M R,et al.Liver BCATm transgenic mouse model reveals the important role of the liver in maintaining BCAA homeostasis[J].The Journal of Nutritional Biochemistry,2017,40(2):132-140.
[11]Raghupathi S.Effects of perioperative enteral glutamine on surgical outcome in gastrointestinal cancer patients[J].International Surgery Journal,2019,6(3):903-908.
[12]Tajiri K,Shimizu Y.Branched-chain amino acids in liver diseases[J].Translational Gastroenterology and Hepatology,2018,3(6):47-58.
[13]周红,荚卫东,乔晓斐,等.多模式预防性镇痛在肝癌肝部分切除患者围手术期的应用[J].中华外科杂志,2017,55(2):141-145.
[14]Fasolato S,Trevellin E,Ruvoletto M,et al.SerpinB3 induces dipeptidyl-peptidase IV/CD26 expression and its metabolic effects in hepatocellular carcinoma[J].Life Sciences,2018,200(5):134-141.
[15]刘发强,王黎明,荣维淇,等.肝细胞癌肝部分切除术后营养支持的效果[J].中华肿瘤杂志,2018,40(10):787-792.
[16]Neinast M D,Jang C,Hui S,et al.Quantitative analysis of the whole-body metabolic fate of branched-chain amino acids[J].Cell Metabolism,2019,29(2):417-429.
[17]Holeek M.Branched-chain amino acid supplementation in treatment of liver cirrhosis:Updated views on how to attenuate their harmful effects on cataplerosis and ammonia formation[J].Nutrition,2017,41(9):80-85.
[18]Lee G S,Yang H G,Kim J H,et al.Pine(Pinus densiflora)needle extract could promote the expression of PCNA and Ki-67 after partial hepatectomy in rat[J].Acta Cirurgica Brasileira,2019,34(6):1-6.
Effects of BCAA Parenteral Nutrition on Nutritional Status,Immune Function and Liver Regeneration of Rats with Hepatic Cirrhosis and Hepatic Carcinoma After Partial Hepatectomy
XU Peng,LIU Hai-ying,HUANG Yu-fang,YANG Qing-ling
(Department of Nutrition,Cancer Hospital Affiliated to Guangzhou Medical University,Guangzhou 510095,China)
Abstract:Objective To study the effect of branch chain amino acid(BCAA)parenteral nutrition on nutritional status,immune function and liver regeneration of rats with hepatic cirrhosis and hepatic carcinoma after partial hepatectomy.Method Totaly 30 SD rat models with hepatic cirrhosis and hepatic carcinoma were successfully replicated.Partial hepatectomy was performed by Higgins method.Randomly divided into observation group and control group.The control group was given parenteral nutrition of 8.5% compound amino acid injection(18AA-Ⅱ)(Novamin)based on basic feed after operation,the observation group was given parenteral nutrition 10% compound amino acid(Anping)injection(Hepa)based on basic feed.After 5 days,the serum was taken to detect changes in nutritional and immunological indicators,hematoxylin eosin(HE)staining was used to observe the pathological changes of liver tissue and Fuelgen staining was used to detect the changes of DNA content in the liver tissue.The protein expression of PCNA and Ki-67 in liver tissue of each group were detected by immunohistochemistry and Western blot.Result Compared with the control group,the serum nutritional,immunological indicators and histopathology of the observation group were significantly improved.The DNA content and the expression levels of PCNA and Ki-67 protein were also significantly increased,the differences were statistically significant(P<0.05).Conclusion The nutritional support of BCAA after partial hepatectomy of hepatic cirrhosis and hepatic carcinoma rats can obviously improve the nutrition and immune status,and promote liver regeneration.
Keywords:branched chain amino acid;cirrhotic liver cancer;partial liver resection;nutritional status;immune function;liver regeneration
