猪源副流感病毒5型SH毒株全基因组测序及分析
2021-09-18姜宁郭禹汐李春秋苏明俊孔凡志孙东波
姜宁,郭禹汐,李春秋,苏明俊,孔凡志,孙东波
黑龙江八一农垦大学动物科技学院,黑龙江大庆163319
副流感病毒5型(parainfluenza virus 5,PIV5)为一种不分节段的单股负链RNA病毒,属副黏病毒科(Paramyxoviridae)、副黏病毒亚科(Paramyxovirinae)、腮腺炎病毒属(Rubulavirus)。1956年,PIV5作为原代猴肾细胞培养过程中的污染物被HULL等成功分离,随后被命名为猴病毒5型(simian virus,SV5)。尽管最早于猴肾细胞中被发现,但并无充分资料证明PIV5为猴源病毒[1]。因此,该病毒于2009年被国际分类委员会重新命名为PIV5,随后又更名为哺乳动物腮腺炎病毒5型[2]。
PIV5病毒粒子直径在50~200 nm之间,镜下观察多呈圆形或多形性。其基因组在副黏病毒中最小,长15 246 nt[3]。从3′到5′端分别为NP、V/P、M、F、SH、HN和L基因。目前PIV5广泛存在于自然界,大量物种被证实为其宿主[4-6]。本研究对本实验室保存的一株猪源PIV5 SH毒株进行全基因组测序及遗传进化分析,旨在丰富PIV5的分子生物学信息,为其后续研究奠定理论基础。
1 材料与方法
1.1 病毒、载体及菌株PIV5-SH毒株由黑龙江八一农垦大学猪病防制实验室保存;pGM-T载体购自天根生化科技(北京)有限公司;E.coliDH5α感受态细胞购自博迈德生物技术有限公司。
1.2 主要试剂 病毒RNA提取试剂盒和DNA凝胶回收试剂盒购自天根生化科技(北京)有限公司;RNA酶抑制剂、dNTP、反转录酶和2×premix预混液购自近岸科技(上海)有限公司;Ex Taq超保真聚合酶、DNA marker DL2000和琼脂糖购自TaKaRa生物技术(大连)有限公司。
1.3 引物设计及合成 根据GenBank中登录的猪源PIV5 KNU-11毒株(GenBank登录号:KC852177)基因组序列,使用Primer Premier 5.0软件设计10对引物(表1),引物由哈尔滨博仕生物技术有限公司合成。

表1 PIV5全基因组引物Tab.1 Primers for complete genome of PIV5
1.4 病毒基因组克隆及测序 用病毒RNA提取试剂盒提取病毒基因组RNA,使用随机引物反转录合成cDNA,以其为模板扩增各基因片段。PCR条件:94℃预变性1 min;94℃变性30 s,60℃退火1 min,72℃延伸2 min,共30个循环;72℃再延伸10 min。阳性扩增产物经电泳切胶后,按照凝胶纯化回收试剂盒说明书进行回收纯化。回收纯化产物与pGM-T载体连接后转化E.coliDH5α感受态细胞。阳性质粒送哈尔滨博仕生物技术有限公司测序。
1.5 序列分析及遗传进化树构建 将PIV5-SH毒株全基因组测序,测序结果进行拼接。拼接得到的病毒全基因组序列与GenBank中已登录的其他PIV5参考毒株进行序列比对及分析,应用DNAStar 6.0软件的MegAlign程序进行毒株的序列同源性比对,并使用MEGA 6.06软件中的NJ法进行PIV5全基因组序列及NP、F及HN基因进化树构建。
2 结果
2.1 PIV5-SH毒株序列的同源性 测得的PIV5-SH毒株基因组序列递交至GenBank,命名为SH/2015/1202(GenBank登录号:MK028670)。PIV5-SH毒株全基因组长15 246 nt,长度符合副黏病毒六碱基原则。其基因组由3′引导序列(55 nt)、NP基因(1530 nt)、V/P基因(669/1 177 nt)、M基因(1 134 nt)、F基因(1 656 nt)、SH基因(135 nt)、HN基因(1 698 nt)、L基因(6 768 nt)和5′尾随序列(31 nt)组成。病毒各基因之间由一段长短不一的间隔区(1~23 nt)连接,每个基因均有独立的转录起始及终止序列,彼此互不重叠,编码相应的蛋白质。其编码产生的蛋白分别为核衣壳蛋白(nucleocapsid protein,NP)、V蛋白(v protein,V)、磷酸化蛋白(phosphoprotein,P)、膜基质蛋白(matrix protein,M)、融合蛋白(fusion protein,F)、小疏水性蛋白(small hydrophobic protein,SH)、血凝素-神经氨酸酶(hemagglutinin-neuraminidase,HN)和聚合酶蛋白(RNA polymerase large protein,L)。
将测序得到的PIV5-SH毒株全基因组序列与GenBank数据库中已登录的其他PIV5参考株进行比较,结果显示,PIV5-SH株与传统毒株PIV5-W3A的NP、P、V、M、F、SH、HN和L基因的核苷酸序列同源性分别为99.2%、98.8%、98.5%、98.2%、98.7%、97.0%、98.4%、99.1%,推导的氨基酸序列同源性分别为99.2%、98.5%、98.2%、97.6%、98.3%、93.2%、97.5%、99.3%。将PIV5-SH株全基因组序列与腮腺炎病毒属内5株不同宿主来源的PIV5代表毒株序列进行比较,结果显示,其与猪源PIV5-SER株核苷酸序列同源性较高,为99.0%;与BC-14(牛源)、W3A(细胞源)、H221(犬源)和MEL(人源)的核苷酸序列同源性分别为98.9%、98.7%、98.6%和98.0%。各基因核苷酸及推导的氨基酸比对结果(表2)显示,不同毒株NP基因核苷酸序列同源性在98.0%~99.5%之间,氨基酸序列同源性在99.4%~98.4%之间;F及HN基因核苷酸序列同源性分别在98.1%~99.2%、97.8%~99.3%之间,推导的氨基酸序列同源性分别在98.1%~98.5%和98.1%~98.9%之间。部分猪源及犬源PIV5毒株由于SH基因易发生突变,常导致SH蛋白无法正常合成。同源性分析结果显示,PIV5-SH株并不存在这种情况,与W3A、H221、MEL 3株参考株SH基因的核苷酸序列同源性分别为97.0%、97.0%、96.3%。

表2 PIV5-SH毒株与参考毒株各基因序列同源性分析结果(%)Tab.2 Homology of gene sequence of PIV5-SH to that of reference strains(%)
2.2 系统进化树分析 基于获取的PIV5-SH毒株全基因组序列,选择GenBank中登录的24株PIV5参考株构建遗传进化树,结果显示,25株毒株形成GⅠ和GⅡ两个群,见图1。PIV5-SH毒株与韩国1株犬源PIV5(1168-1)、中国3株分别从孟加拉虎、东北虎及小熊猫体内分离的PIV5毒株(PIV5-HMZ、PIV5-SR、PIV5 ZJQ-221)亲缘关系较近,5株毒株形成独立分支,同属于GⅡ群,且与位于GⅡ群第4个分支的传统毒株PIV5-W3A亲缘关系较远。选择较为保守的NP基因与副黏病毒主要毒力基因F和HN分别构建遗传进化树,NP基因的遗传进化树结果显示,PIV5-SH株位于GⅡ群第4分支,与PIV5-HMZ、PIV5 CAN、PIV5 1168-1、PIV5-SR和PIV5 ZIQ-221毒株亲缘关系近,见图2;F及HN基因遗传进化树结果与NP基因基本一致,见图3和图4。
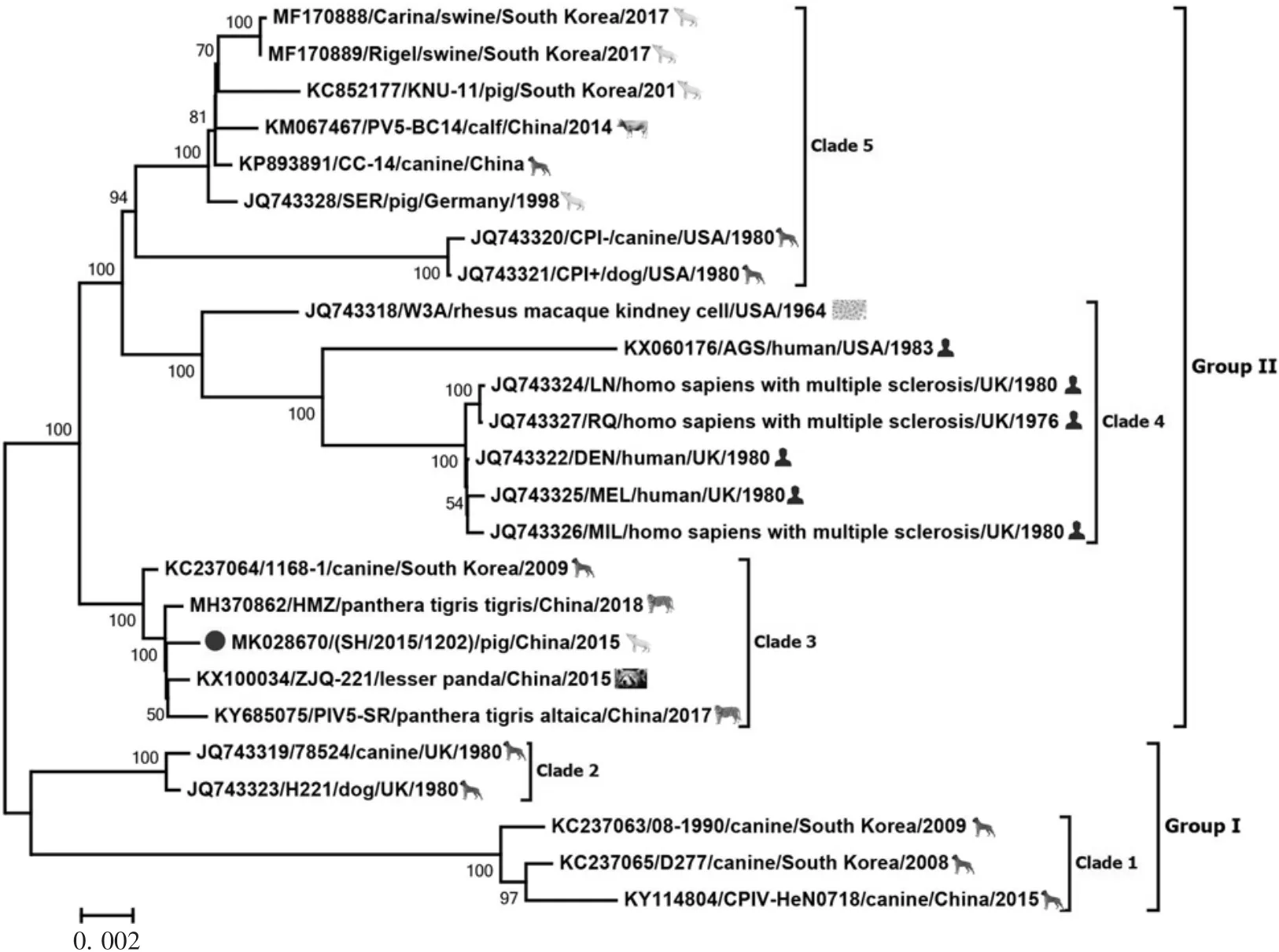
图1 PIV5全基因组系统进化树Fig.1 Phylogenetic tree of PIV based on complete genome
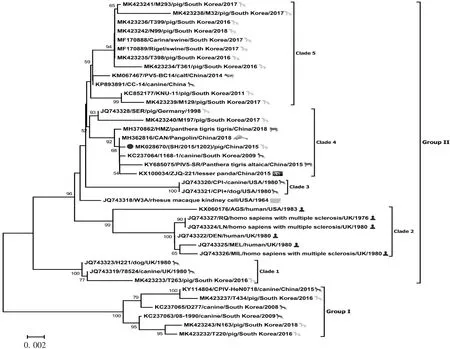
图2 PIV5 NP基因系统进化树Fig.2 Phylogenetic tree of PIV5 based on NP gene

图3 PIV5 F基因系统进化树Fig.3 Phylogenetic tree of PIV5 based on F gene
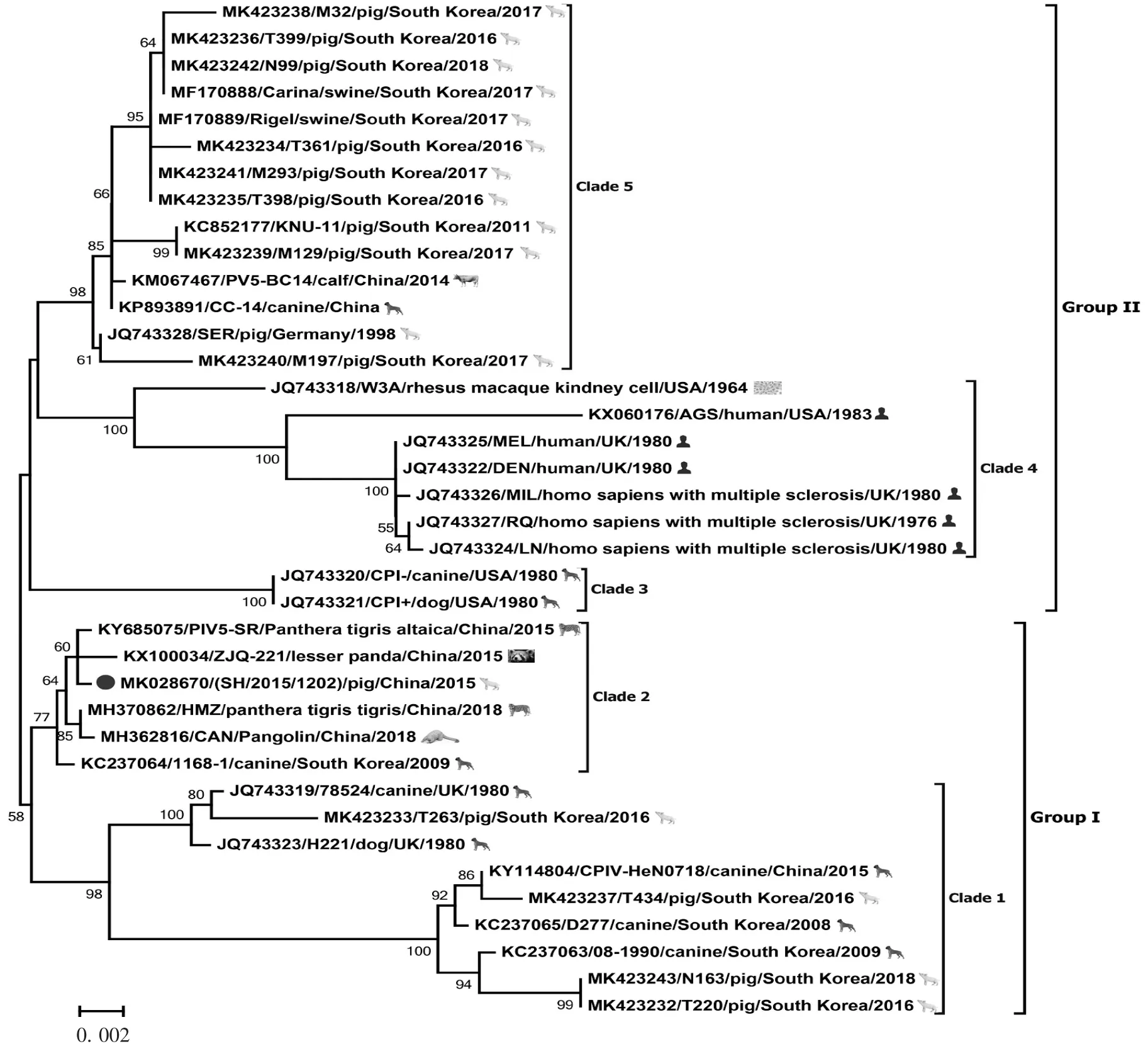
图4 PIV5 HN基因系统进化树Fig.4 Phylogenetic tree of PIV5 based on HN gene
3 讨论
1956年,PIV5作为细胞培养过程中的污染物被发现。一直以来,PIV5因其易污染培养基使得大量关于PIV5分离及致病性研究的报道屡遭质疑。随着反向遗传学技术的发展,PIV5因其感染方式直接、宿主范围广、遗传相对稳定、致病力低等特性备受关注,先后成为流感病毒、狂犬病病毒等重要病原的重组疫苗载体[7-13]。目前,PIV5广泛存在于自然界,可引起多种动物感染。据报道,PIV5在猪群中有较高的感染率,但相关的分子生物学及流行病学资料仍十分有限[14-15]。本研究利用RT-PCR方法,测序得到PIV5-SH毒株全基因组序列,其基因组长15 246 nt,结构式为3′-NP-V/P-M-F-SH-HN-L-5′。毒株的核苷酸数目、基因组结构均符合副流感病毒基因组结构特征。将PIV5-SH毒株基因组序列与其他PIV5代表毒株进行同源性比对,结果显示,这些PIV5毒株之间具有较高的同源性,核苷酸比对结果在98.0%~99.0%之间。且不同来源的分离株基因差异小,表现出一定的遗传稳定性。
2017年,ZHAI等[16]于广州动物园一只临床表现呼吸道症状的小熊猫体内分离出PIV5 ZJQ-221毒株。随后,PIV5-HMZ、PIV5-SR及PIV5 CAN毒株先后于该地区的孟加拉虎、东北虎及穿山甲体内被分离。基于全基因组构建的遗传进化树结果显示,PIV5-SH毒株与PIV5 1168-1、PIV5-HMZ、PIV5-SR和PIV5 ZJQ-221毒株具有较近的亲缘关系。以保守的NP基因构建遗传进化树,结果显示,PIV5-SH与PIV5 1168-1、PIV5-HMZ、PIV5-SR、PIV5 CAN和PIV5 ZJQ-221毒株同位于GⅡ群,共同组成GⅡ群第4分支。显示PIV5在不同动物之间存在广泛流行传播情况,其传播受地理位置限制。在LEE等[15]报道,除肺脏外,PIV5于感染动物的淋巴结及小肠组织中均有存在。本研究中的PIV5-SH毒株亦分离于腹泻猪肠组织样品,为进一步了解决定副黏病毒组织嗜性及致病力的毒力基因遗传变异情况,分别以F、HN基因构建遗传进化树,其分析结果与NP基因基本一致,显示PIV5在自然界中的遗传具有高度保守性。本研究对一株猪源PIV5-SH毒株进行病毒全基因组测序及遗传进化分析,序列比对及遗传进化树分析结果显示,PIV5-SH毒株与一株韩国犬源PIV5毒株1168-1及4株中国广州地区分离的PIV5-HMZ、PIV5-SR、PIV5 CAN及PIV5 ZJQ-221毒株亲缘关系近,且各毒株之间基因差异小,表现出一定的遗传稳定性。
