短发夹RNA沉默丝裂原活化蛋白激酶1对胃癌细胞生物学表型的影响及其分子机制
2021-09-18王转兄宋耀辉杜正平陈熙顾静李海龙
王转兄,宋耀辉,杜正平,陈熙,顾静,李海龙
1.甘肃中医药大学临床医学院临床检验诊断学教研室,甘肃 兰州730000;2.甘肃中医药大学基础医学院生理教研室,甘肃兰州730000
胃癌(gastric cancer,GC)是全球第五大常见恶性疾病,也是全球癌症相关死亡的第三大病因[1],其发病率和死亡率在东亚地区较高[2]。GC的发生是一个复杂的过程,涉及宿主、环境和细菌因子之间的相互作用,导致遗传和表观遗传水平的改变。尽管胃镜检查和常规肿瘤生物标志物筛查已得到广泛应用,但由于早期GC无特定症状,大多数患者诊断时已为晚期,失去了手术机会,且晚期GC患者的预后较差,5年生存率为5%~20%,中位总生存期为10个月[3]。预后不良主要是由于癌细胞的侵袭和转移,也是GC相关复发和死亡的主要原因[4]。因此,迫切需要有价值和实用的生物标志物来筛选具有高风险的GC患者,有利于早期诊断及为每个患者建立有效的治疗策略。
丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)是由丝氨酸-苏氨酸激酶组成的蛋白激酶。研究表明,MAPK在生物进化过程中高度保守,MAPK能独立地将细胞外信号转导至细胞内,以调节相关基因的表达,并参与细胞有丝分裂、增殖、炎症、侵袭和转移等生理过程[5]。MAPK/ERK途径是接收多种刺激的输入会聚信号节点,信号通过MAPK途径传递激活下游底物,启动相关基因的表达,从而引起细胞增殖、侵袭和转移等生物学行为的激活或转化[6]。研究表明,许多MAPK通路酶在女性生殖道癌、乳腺癌、卵巢癌和宫颈癌中均有异常表达[7-8],MAPK/ERK信号通路在GC细胞中被激活,PD98059通过抑制MAPK/ERK信号通路的活性可影响GC细胞的生物学功能。MAPK1也称为ERK2,是MAPK通路的亚家族。研究表明,MAPK1的激活与GC细胞的侵袭密切相关,在GC细胞系中敲低MAPK1表达可抑制细胞增殖、迁移及侵袭,诱导凋亡[9]。研究发现,miRNA可通过调节MAPK1来影响肿瘤的生物学行为[10];GC中miR-585下调可致MAPK1增加,从而促进GC的增殖和转移[11];miR-197和MAPK1在GC细胞中存在关联,且miR-197可通过直接靶向MAPK1诱导人GC细胞的凋亡,并降低其5-FU抗性[12]。MAPK1与GC的发生、发展密切相关。因此,本实验通过短发夹RNA(short hairpin RNA,shRNA)沉默SGC-7901及HGC-27细胞中的MAPK1,检测细胞增殖、迁移、侵袭能力和细胞周期、凋亡及其相关信号因子的表达情况,评价沉默MAPK1对GC细胞生物表型的影响及其作用机制。
1 材料与方法
1.1 细胞及病毒GC细胞SGC-7901和HGC-27、慢病毒LV-sh-Ctrl和LV-sh-MAPK1均购自上海吉凯基因科技有限公司。
1.2 主要试剂及仪器 高糖DMEM培养基购自兰州健顺生物科技有限公司;胎牛血清购自浙江天杭生物科技股份有限公司;青-链霉素、RIPA裂解液及蛋白酶抑制剂PMSF购自美国Solarbio公司;RNA裂解液RNAiso Plus及逆转录试剂盒购自日本TaKaRa Bio公司;兔抗人CDK1、CDK6、CCNB1、P53、BAX、Bcl-2、Caspase 3、C-Caspase 3、Caspase 9、C-Caspase 9多克隆抗体及HRP标记的山羊抗兔IgG购自美国GeneTex公司;兔抗MAPK1及GAPDH多克隆抗体购自上海YEASEN公司;流式细胞仪(型号FACSVerse)购自美国BD公司。
1.3 MAPK1在GC中表达的临床病理特征分析 应用TCGA数据库数据挖掘网站-UALCAN(http://ualcan.path.Uab.edu/index.html),提取GC患者MAPK1基因表达及与临床病理特征之间关系的数据,输入Graphpad软件,进行绘图,分析MAPK1在GC中表达的临床病理特征。
1.4 细胞培养 将SGC-7901和HGC-27细胞接种于含10%胎牛血清的DMEM培养基中,于37℃,5%CO2饱和湿度条件下培养,待细胞融合度达80%以上时,用0.25%胰酶消化,连续传3代,取第2代对数生长期细胞进行后续试验。
1.5 病毒感染 当SGC-7901和HGC-27细胞融合度达20%~30%时,按MOI=20分别感染慢病毒LVsh-MAPK1、LV-sh-Ctrl(分别为两种细胞的试验组及阴性对照组),于37℃培养12~16 h;更换为常规培养基,继续培养约72 h,镜下观察荧光细胞数。加入5 μg/mL嘌呤霉素,每隔3~4 d更换含嘌呤霉素的培养基,筛选感染稳定的细胞株进行后续试验。
1.6 GC细胞中MAPK1基因mRNA转录水平的检测采用RT-qPCR法。在Primer-Blast中登录http://blast.ncbi.nlm.nih.gov/网站,设计引物序列,MAPK1上游引物:5′-CGTTGGTACAGGGCTCCAGAA-3′,下游引物:5′-CTGCCAGAATGCAGCCTACAGA-3′,引物由宝生物工程(大连)有限公司合成。采用Trizol试剂提取各组细胞总RNA,逆转录合成cDNA,以其为模板进行PCR扩增。PCR扩增条件为:95℃预变性10 s,95℃变性10 s,60℃退火20 s,共40个循环。扩增后进行熔解曲线分析,内参基因为GAPDH,采用2-ΔΔCt法计算基因相对转录水平。
1.7 GC细胞中MAPK1蛋白表达水平的检测 采用Western blot法。用RIPA提取各组细胞总蛋白,经10%SDS-PAGE分离后,转移至PVDF膜上,用5%脱脂奶粉室温封闭1 h;加入兔抗MAPK1多克隆抗体及兔抗GAPDH多克隆抗体(1∶1 000稀释),4℃孵育过夜;用0.5%TBST洗涤3次,加入HRP标记的山羊抗兔IgG(1∶2 500稀释),37℃温育2 h;ECL法显色。
1.8 沉默MAPK1对GC细胞增殖能力影响的检测采用MTT法。将各组GC细胞按2×104个/mL加入96孔板,100 μL/孔,两种GC细胞均设空白对照组(不感染),每组设6个重复,于37℃,5% CO2细胞培养箱分别培养24、48、72 h;加入5 mg/mL的MTT溶液,20 μL/孔,继续培养4 h;弃培养基,加入DMSO溶液,150 μL/孔,避光振荡10 min,用酶标仪检测A490,并按下式计算细胞增殖率。试验重复3次。
细胞增殖率(%)=(试验组A490-空白对照组A490)/(阴性对照组A490-空白对照组A490)×100%
1.9 沉默MAPK1对GC细胞迁移能力影响的检测
1.9.1 细胞划痕愈合试验 将各组GC细胞按2.5×105个/mL加入6孔板,2 mL/孔,于37℃,5% CO2细胞培养箱中培养过夜;待细胞融合度达100%时,用200 μL枪头进行划痕,弃培养基,PBS洗涤3次,加入2 mL无血清培养基,继续培养48 h,于培养0及48 h时拍照。应用Image J软件检测划痕区面积值,并按下式计算细胞愈合率。试验重复3次。
愈合率(%)=(0 h细胞划痕面积-48 h细胞划痕面积)/0 h细胞划痕面积×100%
1.9.2 细胞Transwell小室试验 各组GC细胞经0.25%胰蛋白酶消化后,用无血清培养基重悬,浓度调节为5×105个/mL。将Transwell小室放入24孔板中,上室加入200 μL细胞悬液,下室加入500 μL含10% FBS的培养基,于37℃,5% CO2细胞培养箱培养24 h;弃小室内培养基,PBS洗涤3次,加入4%多聚甲醛,固定小室下侧细胞30 min;用0.1%结晶紫染色20 min,PBS洗涤3次,晾干,镜下观察计数。随机选取中央和四周5个视野,对迁移至Transwell下室的细胞进行计数。试验重复3次。
1.10 沉默MAPK1对GC细胞侵袭能力影响的检测采用细胞Transwell小室试验。将Transwell小室放入24孔板中,置于冰上,按50 μL/cm2加入4℃预冷的Matrigel基质,37℃放置30 min;将各组GC细胞用0.25%胰酶消化,用含无血清培养基重悬,浓度调节为5×105个/mL,加入Transwell小室内,继续培养24 h;固定染色,镜下观察计数。随机选取中央和四周5个视野,对迁移至Transwell下室的细胞进行计数。试验重复3次。
1.11 沉默MAPK1对GC细胞周期影响的检测 采用流式细胞术。将各组GC细胞用0.25%胰酶消化,收集细胞,预冷PBS洗涤2次,弃上清,加置1 mL预冷的70%乙醇,吹打混匀,4℃固定12 h;7 104×g离心5 min,预冷的PBS洗涤2次,加入PI和RnaseA,37℃避光温浴30 min,用流式细胞仪检测。试验重复3次。
1.12 沉默MAPK1对GC细胞凋亡能力影响的检测采用流式细胞术。将各组CG细胞用25%胰酶消化,收集细胞至离心管中,PBS洗涤2次,弃上清,用1×Binding Buffer重悬,每管加入5 μL AnnexinV-APC和10 μL 7-AAD,混匀,室温避光孵育15 min;每管加入380 μL预冷的1×Binding Buffer,用流式细胞仪检测。试验重复3次。
1.13 沉默MAPK1对GC细胞周期和凋亡相关分子表达影响的检测 采用Western blot法。用RIPA提取细胞总蛋白,经10% SDS-PAGE分离蛋白后,转移至PVDF膜上,用5%脱脂奶粉室温封闭1 h;加入兔抗人P53、CCNB1、CDK6、CDK1、Bax、Bcl-2、Caspase 3、Caspase 9、C-Caspase 3、C-Caspase 9、GAPDH多克隆抗体(1∶1 000稀释),4℃孵育过夜;用0.5%TBST洗涤3次,加入HRP标记的山羊抗兔IgG(1∶2 500稀释),37℃温浴2 h;ECL法显色。
1.14 统计学分析 应用SPSS 21.0统计软件进行统计学分析,计量资料以均值±标准差(±s)表示,组间两独立样本比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 MAPK1在GC中表达的临床病理特征分析与正常组织比较,MAPK1在原发性肿瘤中的表达明显升高(P<0.01);MAPK1在GC中的表达具有种族差异性,与正常组织比较,高加索人GC患者的表达量较高(P<0.01),而非裔美国人和亚洲人中GC患者的MAPK1表达量无明显差异(P>0.05);在肿瘤病理分级和分期中,与正常组织比较,MAPK1表达量在2级(P<0.01)、3级(P<0.01)及2期(P<0.05)、3期(P<0.01)、4期(P<0.01)明显升高。见图1。

图1 MAPK1在GC中表达的临床病理分析Fig.1 Clinical pathological analysis of MAPK1 expression in GC
2.2 慢病毒感染GC细胞的效果 各组GC细胞感染慢病毒后,荧光细胞数均占总细胞数的80%以上,见图2。SGC-7901-sh-MAPK1、SGC-7901-sh-Ctrl、HGC-27-sh-MAPK1及HGC-27-sh-Ctrl组细胞中MAPK1基因mRNA转录水平分别为0.25、0.98、0.20和0.95,MAPK1表达水平分别为0.37、1.00、0.18和0.99。SGC-7901-sh-MAPK1及HGC-27-sh-MAPK1组细胞中MAPK1基因mRNA转录及MAPK1表达水平均显著低于相应阴性对照组(t=-2.73~2.71,P<0.01)。见图3。
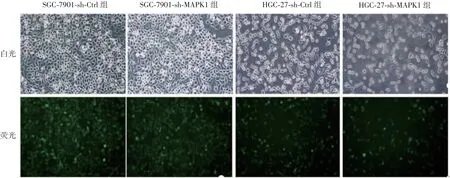
图2 各组GC细胞的镜下观察(×100)Fig.2 Microscopy of gastric cancer cells in various groups(×100)

图3 Western blot法检测各组CG细胞中MAPK1的表达Fig.3 Western blotting of MAPK1 expression in gastric cancer cells in various groups
2.3沉默MAPK1对GC细胞增殖能力的影响 各组CG细胞的增殖率随培养时间的延长逐渐升高,感染72 h后,SGC-7901-sh-MAPK1及HGC-27-sh-MAPK1组的细胞增殖率明显低于相应阴性对照组(t分别为2.63和2.69,P<0.01)。见图4。表明MAPK1下调可显著抑制SGC-7901及HGC-27细胞的增殖能力。
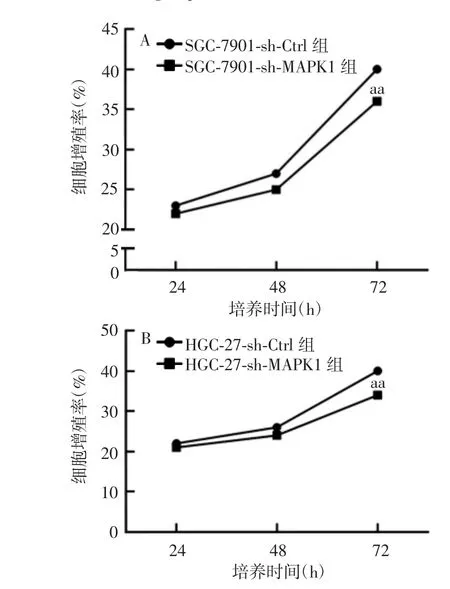
图4 各组CG细胞的细胞增殖率Fig.4 Proliferation rates of gastric cancer cells in various groups
2.4 沉默MAPK1对CG细胞迁移能力的影响
2.4.1 细胞划痕愈合试验SGC-7901-sh-MAPK1、SGC-7901-sh-Ctrl、HGC-27-sh-MAPK1及HGC-27-sh-Ctrl组细胞划痕愈合率分别为15%、66%、49%和77%。SGC-7901-sh-MAPK1及HGC-27-sh-MAPK1组显著低于相应阴性对照组(t分别为3.40和2.63,P<0.01)。见图5。表明MAPK1下调可抑制SGC-7901及HGC-27细胞的迁移能力。

图5 细胞划痕愈合试验检测沉默MAPK1对GC细胞迁移能力的影响(×100)Fig.5 Cell healing test for migration ability of gastric cancer cells after silencing MAPK1(×100)
2.4.2 细胞Transwell小室试验SGC-7901-sh-MAPK1、SGC-7901-sh-Ctrl、HGC-27-sh-MAPK1及HGC-27-sh-Ctrl组迁移细胞数分别为76、200、75和206。SGC-7901-sh-MAPK1及HGC-27-sh-MAPK1组细胞迁移数显著少于相应阴性对照组(t分别为2.67和2.80,P<0.01)。见图6。表明沉默MAPK1可降低SGC-7901及HGC-27细胞的纵向迁移能力。

图6 Transwell小室试验检测沉默MAPK1对CG细胞迁移能力的影响(×100)Fig.6 Transwell assay on migration ability of gastric cancer cells after silencing MAPK1(×100)
2.5 沉默MAPK1对CG细胞侵袭能力的影响SGC-7901-sh-MAPK1、SGC-7901-sh-Ctrl、HGC-27-sh-MAPK1及HGC-27-sh-Ctrl组侵袭细胞数分别为60、115、40和88。SGC-7901-sh-MAPK1及HGC-27-sh-MAPK1组侵袭细胞数显著少于相应阴性对照组(t分别为3.59和3.27,P<0.01)。见图7。表明沉默MAPK1可降低SGC-7901及HGC-27细胞的侵袭能力。
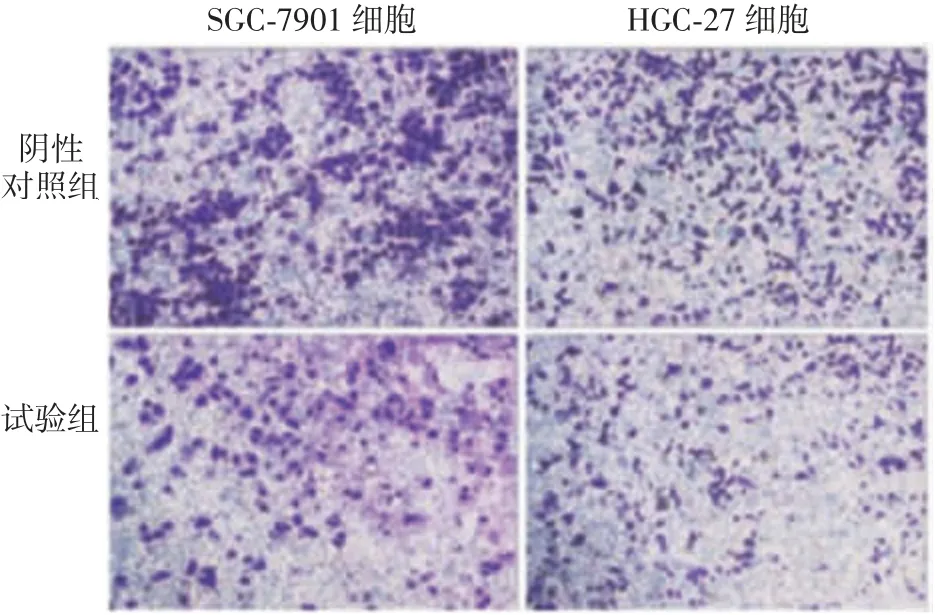
图7 Transwell小室试验检测沉默MAPK1对CG细胞侵袭能力的影响(×100)Fig.7 Transwell assay on invasion ability of gastric cancer cells after silencing MAPK1(×100)
2.6 沉默MAPK1对CG细胞周期的影响SGC-7901-sh-MAPK1及HGC-27-sh-MAPK1组处于G1期的细胞比例显著高于相应阴性对照组(t分别为3.56和4.80,P<0.01);处于S期、G2期的细胞比例显著低于相应阴性对照组(t=-3.82~2.73,P<0.01)。见图8和表1。表明MAPK1基因下调可使细胞滞于G1期,从而阻止细胞从G1期向S期发展,进而影响肿瘤细胞的增殖。
表1 各组CG细胞所处细胞周期的细胞数占比(%,±s,n=3)Tab.1 Proportions of gastric cancer cells at various cell phases in various groups(%,±s,n=3)

表1 各组CG细胞所处细胞周期的细胞数占比(%,±s,n=3)Tab.1 Proportions of gastric cancer cells at various cell phases in various groups(%,±s,n=3)
注:aa表示与相应阴性对照组比较,P<0.01。
?
2.7 沉默MAPK1对CG细胞凋亡能力的影响SGC-7901-sh-MAPK1、SGC-7901-sh-Ctrl、HGC-27-sh-MAPK1及HGC-27-sh-Ctrl组早期凋亡率分别为(3.17±0.003)%、(1.22±0.001)%、(12.04±0.007)%、(3.15±0.002)%,晚期凋亡率分别为(17.41±0.008)%、(0.20±0.000)%、(13.39±0.002)%、(1.05±0.001)%。SGC-7901-sh-MAPK1及HGC-27-sh-MAPK1组细胞早期及晚期凋亡率显著高于相应阴性对照组(t=0.000~12.340,P<0.01)。见图9。表明MAPK1可显著提高SGC-7901及HGC-27细胞的凋亡能力,促进其凋亡。

图9 流式细胞术检测各组CG细胞的凋亡细胞数Fig.9 Flow cytometry of number of apoptotic gastric cancer cells in various groups
2.8 沉默MAPK1对CG细胞周期和凋亡相关分子表达的影响SGC-7901-sh-MAPK1及HGC-27-sh-MAPK1组细胞CDK6、P53、Bax、Caspase 3、C-Caspase 3、Caspase 9、C-Caspase 9表达明显高于相应阴性对照组(t=3.17~6.35,P<0.01),CDK1、CCNB1及Bcl-2表达则明显低于相应阴性对照组(t=2.85~4.03,P<0.01)。见图10和表2。表明MAPK1下调可使细胞滞于G1期,阻止细胞从G1期向S期发展,促进细胞凋亡。

图10 Western blot法检测各组CG细胞周期和凋亡相关分子的表达Fig.10 Western blotting of expression and cell cycle-and apoptosis-associated factors in gastric cancer cells in various groups
表2 CG细胞周期和凋亡相关分子的表达水平(±s,n=3)Tab.2 Expression levels of cell cycle-and apoptosis-associated factors in gastric cancer cells in various groups(±s,n=3)
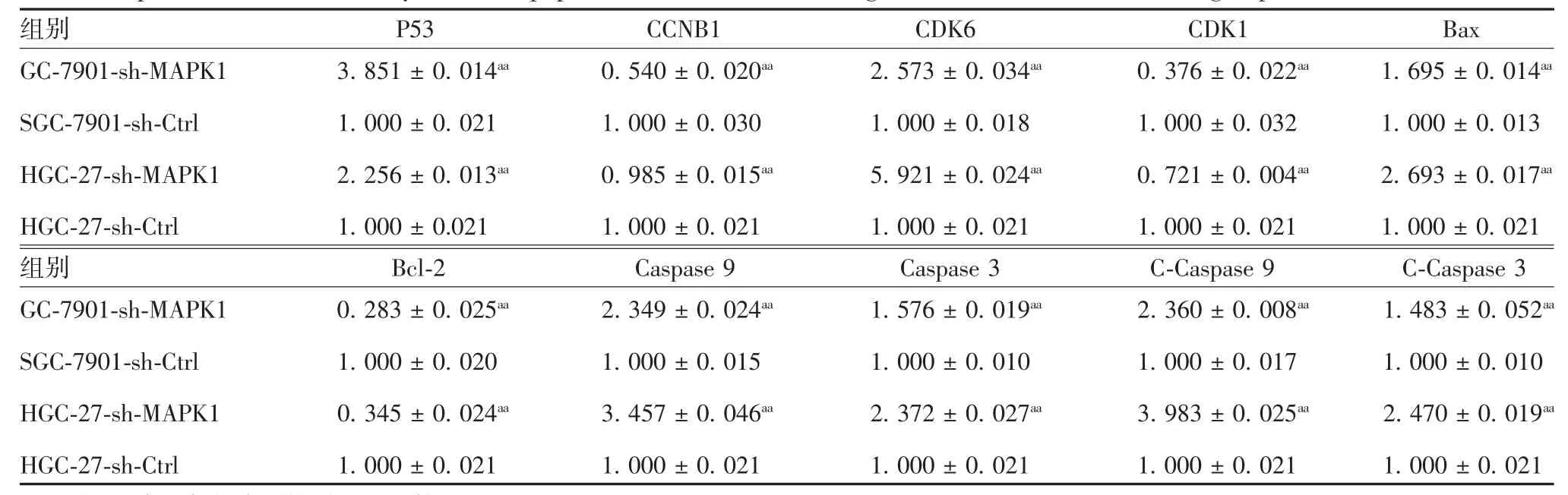
表2 CG细胞周期和凋亡相关分子的表达水平(±s,n=3)Tab.2 Expression levels of cell cycle-and apoptosis-associated factors in gastric cancer cells in various groups(±s,n=3)
注:aa表示与相应阴性对照组比较,P<0.01。
?
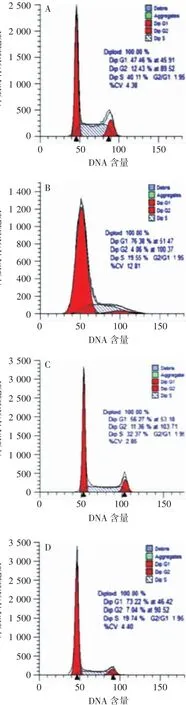
图8流式细胞术检测各组CG细胞的细胞周期分布Fig.8 Flow cytometry of cell cycle distribution of gastric cancer cells in various groups
3 讨论
GC是一种死亡率较高的疾病,随着医疗技术的发展,癌症发病率稳步下降,但临床管理面临巨大挑战[13]。尽管人们对遗传和表观遗传癌症有了越来越多的了解,但缺乏用于早期诊断GC的非侵入性方法[14]。本研究应用TCGA数据库数据挖掘网站-UALCAN,提取GC患者基因表达及临床病理特征数据,统计结果表明,MAPK1在原发性肿瘤中的表达明显升高(P<0.01),且在GC中的表达具有显著种族差异性(P<0.01),非裔美国人和亚洲人中CG患者的MAPK1表达量相对较低,而高加索人GC患者的表达量较高;在肿瘤病理分级和分期中,MAPK1表达量在2、3级和2、3、4期明显升高(P<0.05)。表明MAPK1是一个在GC中高表达,并具有临床相关性的癌基因。许多研究表明,miRNA可通过靶向调控MAPK1影响肿瘤的生长进展,如miR-585、miR-378、miR-454通过直接靶向MAPK1抑制CG细胞增殖、侵袭、转移等恶性生物学行为[9,15-16];在对黑色素瘤的研究中,miR-524-5p靶向调控BRAF和ERK2抑制致癌性BRAF黑色素瘤的生长[17];miR-217-5p可通过直接靶向PRKCI、BAG3、ITGAV和MAPK1诱导结直肠癌细胞凋亡[18]。
上述研究表明,MAPK1在GC的发生、发展中起着关键性作用,为探讨沉默MAPK1对CG细胞生物学行为的影响,本研究用慢病毒LV-sh-MAPK1感染SGC-7901及HGC-27细胞,使MAPK1在细胞中沉默表达。沉默MAPK1后能够显著抑制SGC-7901、HGC-27的增殖、迁移及侵袭能力(P<0.01);可明显诱导CG细胞的凋亡(P<0.01),且细胞被阻滞于G1期;调控细胞G1期的CDK6的表达量明显上调(P<0.01),而调控细胞G2、G2/M期的CDK1、CCNB1的表达量显著下调(P<0.01);促进细胞凋亡的Bax、Caspase 3、C-Caspase3、Caspase 9、C-Caspase 9基因的表达明显升高(P<0.01),而抑制细胞凋亡的Bcl-2基因的表达则明显降低(P<0.01)。
综上所述,沉默MAPK1可抑制人CG细胞增殖、侵袭迁移能力,促进细胞凋亡并将其阻滞在G1期。因此,MAPK1可能被作为一种有价值的基因治疗靶点用于GC的治疗。
