国外新型冠状病毒变异株疫苗研发与评价技术要求的比较与分析
2021-09-18徐莉郭胜楠郭占东李敏
徐莉,郭胜楠,郭占东,李敏
1.国家药品监督管理局药品审评中心,北京100022;2.北华大学公共卫生学院,吉林 吉林132013
目前,新冠疫情仍在持续流行,且新型冠状病毒(Severe Acute Respiratory Syndrome Coronavirus 2,SARS-CoV-2)仍在不断变异[1-4]。其中,病毒基因序列的突变组合可导致病毒的传播力、致病力和/或免疫原性等发生明显改变[5-8]。世界卫生组织(World Health Organization,WHO)对病毒变异株进行了分类,满足以下条件之一的毒株定义为“关切变异株”(variant of concern,VOC):流行病学上传播力增强或流行特点出现有害变化,致病力增强或临床表现趋重;或导致公共卫生、社会措施或现有诊断、疫苗、治疗方法的有效性降低。满足以下条件的毒株定义为“关注变异株”(variant of interest,VOI):相比早期参考株,病毒表型发生变化或氨基酸变异引起或潜在引起病毒表型发生变化,病毒变异株可引起社区传播、或在多个地区/国家传播[9]。由此可见,病毒变异对传播力、致病力及免疫原性的影响可能是独立的,WHO更关注引起致病力改变的或对现有预防或治疗手段有效性有显著影响的毒株。WHO已公布了多株VOC[10],VOC可能会对死亡率和发病率产生负面影响,针对接种疫苗产生的抗体中和水平低,引起的疫苗诱导免疫逃逸。美国食品药品监督管理局(Food and Drug Administration,FDA)、欧洲药品管理局(European Medicines Agency,EMA)、英国政府网(Government of the United Kingdom,UK)及WHO已相继发布了关于SARS-CoV-2变异株疫苗的评价指南、监管意见等,本文结合国外技术指南,浅析SARS-CoV-2变异株疫苗研发与评价技术要求,旨在为新冠变异株疫苗的开发和评价提供参考。
1 FDA《新冠疫苗紧急使用授权行业指南》修正案
FDA在2021年2月22日发布了修订后的《新冠疫苗紧急使用授权行业指南》,新增了附录2《新出现的新冠变异株疫苗评价考虑》[11],并于2021年5月进行了再次更新。该指南主体内容包括药学、非临床、临床数据、免疫原性终点评估及其他考虑,附录内容包括背景介绍及相关考虑。见表1。该指南起草的背景为:①全球范围内正在开展的新冠疫苗研究中大多采用S蛋白作为抗原,从实验室研究、非临床研究及临床试验中收集的数据证明,尽管目前尚未定义中和抗体对临床保护力的相对贡献,未确定中和抗体水平与保护相关性,且在保护中的作用可能因疫苗的类型有所不同,但S蛋白的中和抗体对许多候选疫苗引起的保护反应有重要贡献,仍为有效性评价的重要指标,②SARS-CoV-2正在不断变异,可能出现高病毒适应性和传播力的变异株,已获紧急使用授权(Emergency Use Authorization,EUA)或临床阶段的原型疫苗针对变异株的保护效果可能会降低。
FDA将变异株疫苗(modified vaccine)考虑为与已批准原型疫苗采用相同生产工艺,由同一制造商生产的疫苗,目的为增强疫苗对新冠变异株引起新型冠状病毒肺炎(Corona Virus Disease 2019,COVID-19)的保护效果。随着获得变异株疫苗和相关疫苗信息的增加,变异株疫苗获EUA所需的支持性研究数据会进一步更新。《新冠疫苗紧急使用授权行业指南》中说明本次提出的技术要求仅针对表达S蛋白的新冠疫苗,主要基于以下科学假设及监管策略的考虑:S蛋白中和抗体是疫苗保护应答的主要成分;预测保护的免疫标志尚未建立;变异株可能逃脱原型苗的免疫,无法快速开展对变异株的临床疾病终点效果研究;原型苗已获得EUA,变异株疫苗与获得EUA的原型疫苗为同一制造商和生产工艺生产,希望借助平台知识加快变异株疫苗的批准。FDA认为,该指南属于一种前瞻性的技术指导,不涵盖以下内容:如何确定新毒株序列、疫苗应表达何种蛋白序列、确定变异株疫苗维持足够保护力的方法及不降低针对未来出现的新变异株的保护效力;明确不考虑多价苗。同时提及了FDA正在继续思考的问题,包括但不限于:决定启动变异株疫苗开发所需的数据,评估决定或推荐是否需要开发变异株疫苗的机构,FDA的疫苗和相关生物制品顾问委员会在疫苗更新决定中扮演的角色,变异株疫苗说明书如何撰写等。
另外,FDA认为变异株疫苗开发仍缺少具体的检测数据及研究数据,仍存在不确定性:目前尚未明确变异株是否比原型株毒力更强、免疫原性和安全性是否与原型株疫苗具有可比性、是否需要定期更新毒株。对于将来是否可在无需临床研究的情况下批准新冠变异株疫苗使用,将随着数据的积累另行予以考虑。
2 EMA《针对为新冠疫苗变异株提供保护的疫苗监管需求思考性文件》
EMA于2021年2月25日发布了《针对为新冠疫苗变异株提供保护的疫苗的监管需求思考性文件》[12],意见指出,应同时结合参考EMA发布的《疫苗临床评价指南和预防疫苗的良好药物警戒及特殊人群考虑指南》[13]。该意见介绍了质量、非临床和临床的申报资料及数据要求,包括单价或多价疫苗,见表1。该意见仅适用于同时满足以下两项要求的情形:①原型疫苗已在欧盟获上市许可;②除接种的抗原改变外,变异株疫苗的生产工艺、控制及设施、质量属性应与原型苗相同或非常相似。
3 UK《已上市COVID-19疫苗的毒株变更指南》
UK于2021年3月4日发布了《已获批COVID-19疫苗的毒株变更指南》[14]。指南内容包括背景介绍、流感疫苗监管理念[15]、对已获EUA的新冠疫苗针对变异株进行适应性调整的要求,同时提出了对将来可能出现的其他与SARS-CoV-2不相关的新型冠状病毒流行的应对准备考虑。
该指南较为明晰地提出了应急状态下监管策略调整的必要性,对比了传统监管方法和应急状态下对监管-供应平衡的需求差异及风险-效益评估差异。同时认为,流感疫苗的特殊监管途径可能成为可借鉴的监管途径,但也提到流感疫苗与新冠疫苗的认知基础及临床经验有所不同,因此,应选择一种适宜的研发策略,具体阐述如下:传统的监管方法一般将新毒株的替换视为新产品,应重新开展临床试验以证明疫苗的安全性、免疫原性和效力。其中,生成临床有效性数据为限速步骤,将推迟获得新疫苗的时间,难以快速应对疫情,应从产品质量、安全性和有效性和速度方面进行权衡。与流感模拟模型比较,新冠疫苗的大规模接种虽已证实了在目前流行状态下原型疫苗的有效性,且原型疫苗数据可作为新冠疫苗的效价和免疫原性桥接初始数据,并积累了安全经验。但鉴于对当下流行的新冠病毒临床研究数据收集的时间有限,新冠疫苗不能被指定为季节性疫苗,且许多新冠疫苗采用新型技术路线制备,缺乏临床长期应用的经验;另外,目前对新冠病毒的科学特性认知不如流感病毒成熟。据此,可综合基于季节性流感更新的监管原则及新冠原型疫苗已有的非临床或临床研究的数据支持,对已获EUA的新冠疫苗的更新进行考虑。
若已有疫苗免疫血清交叉反应数据证明原型苗不能提供针对变异株的保护,或有效性研究报告/调查证明疫苗效力下降,均会促使疫苗更新。该指南对质量、非临床和临床方面提出了考虑,见表1。另外,指南还提及了对开展人体挑战的思考。
4 WHO《对新冠疫苗预认证或紧急使用清单的评价考虑》及其附录
WHO于2021年3月12日发布了《对新冠疫苗预认证或紧急使用清单的评价考虑》及其附录[16],该附录文件为实时更新文件,将随着数据积累进行修订。对于变异株疫苗的定义为:针对VOC的疫苗,与已批准的原型株比较,仅变更毒株,疫苗生产工艺、控制和生产设施及质量属性等均不发生变化。明确该附录用于评估变异株单价疫苗,其毒株应为WHO定义的VOC,其原型苗已列入紧急使用清单或正在评估中。该附录指出,2020年12月25日发布的《新冠疫苗评价考虑-新冠疫苗生产考虑点》[17]中的要求仍适用于变异株疫苗,同时适用于未进行针对变异株改良的疫苗,在研发过程中需结合考虑。
该附录制定发布的重要背景情况主要包括疫情发展、疫苗可及性、S蛋白中和抗体保护作用及抗体滴度与保护作用的关系。变异株疫苗技术评价出台指南的主要考虑为:①目前,出现影响疫苗免疫原性及保护效力VOC变异株可能性高;②全球范围内疫苗可及性高,以安慰剂为对照的临床试验终点日益困难;③病毒感染可诱导细胞和体液免疫,已有数据表明自然免疫或疫苗诱导免疫S蛋白中和抗体对免疫保护重要,可作为衡量疫苗免疫原性及保护效力的替代指标,但不能忽视,抗体水与平保护力的相关性或用于预测保护力的抗体阈值尚未确定。
该指南对处于不同开发阶段的新冠疫苗及候选VOC疫苗的研究提出了原则性的考虑:①已列入WHO EUL的疫苗:该文件指导评估与原型疫苗相同的生产工艺和生产场地生产的变异株候选苗,但仅适用于变异株的单价候选苗;②处于临床Ⅲ期后期的候选疫苗:此类疫苗可能尚未发布初步临床保护力结果,鼓励制造商提供数据以展示疫苗诱导的中和抗体对VOC的中和能力;③临床Ⅰ期或Ⅱ期阶段原型候选苗:可能已发布或未发布免疫原性和安全性数据,建议制造商应在临床开发过程中监测疫苗对VOC的保护效果;④正在或即将进行非临床研究的候选苗:制造商应在候选疫苗设计时,评估对VOC的保护效力。
该附录对药学、非临床评估、临床评估(试验设计、加强免疫、分析、安全性及风险管理计划)[18]提出了评价考虑,见表1。在非临床研究中,提出鼓励合作,共享毒株、血清和序列信息。在临床研究中提出如可能建议采用商业化规模变异株疫苗进行免疫原性研究。
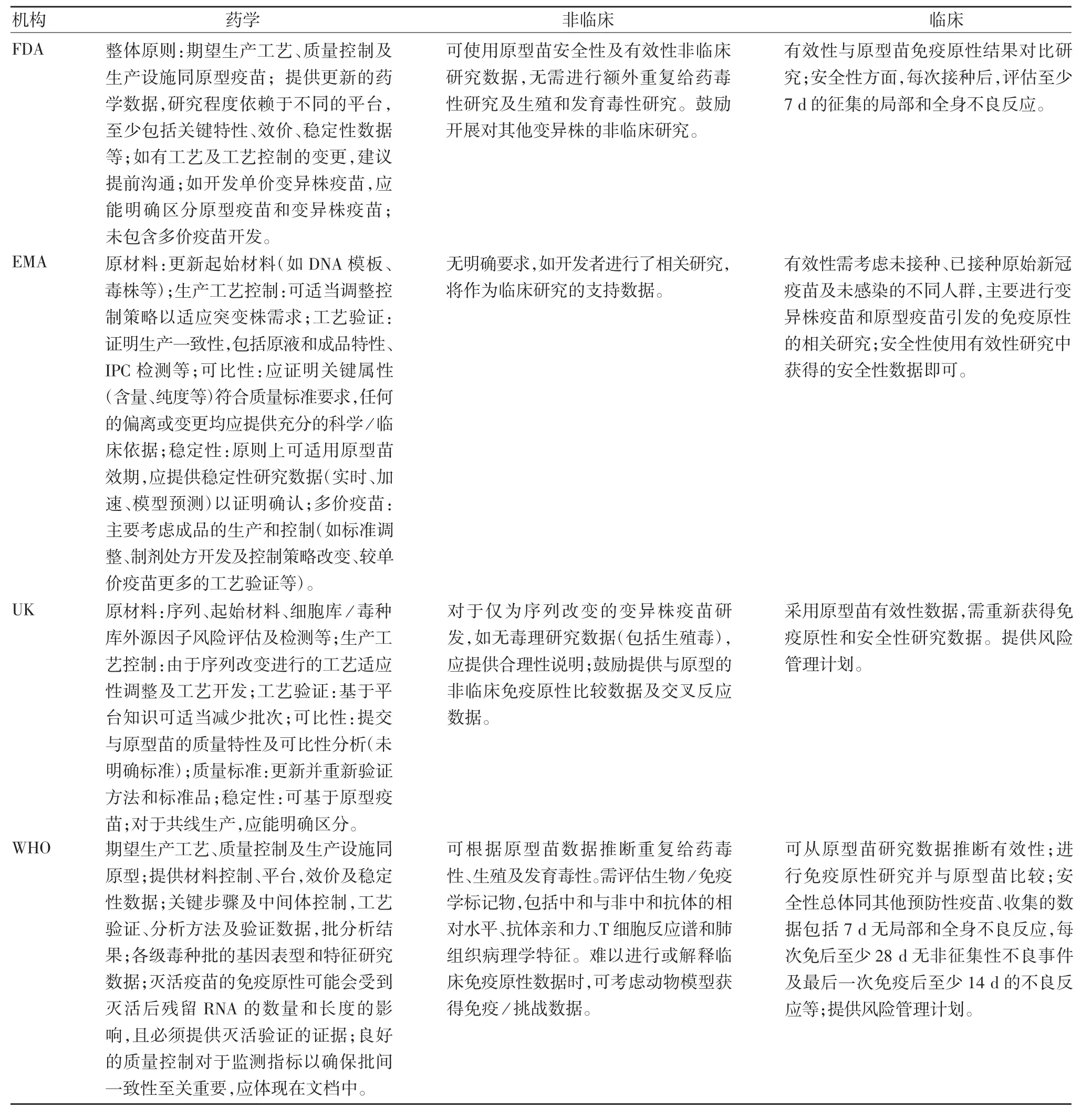
表1 FDA、EMA、UK及WHO对变异株疫苗的药学、非临床及临床要求比较
5 小结
各指南均系在预期可能出现变异株的理论预测上及尚未获得详细的研究数据前建立的一种备用的监管科学手段,对满足一定前提条件的疫苗可减免部分的临床前研究,并通过桥接临床研究的方式推进变异株疫苗的上市。对于开发变异株疫苗的必要性、可行性及毒株序列的筛选,各监管机构均认为,需综合考虑变异株对疫苗保护效力的影响确定,毒株序列的筛选需根据流行株、毒株交叉保护能力等由国家疾控部门确认或由国际组织提供。FDA明确仅对是否需要开发针对变异株的疫苗提出思考,而哪些数据可表明需求变异株疫苗、由谁确定和推荐等问题不包含在指南中。
对于变异株疫苗的定位,国际上基本均定义为在原型疫苗已获得EUA基础上开发的,并与原型疫苗为同一制造商和生产工艺生产的疫苗。其中,EMA明确适用情形为:同时满足原型疫苗已获欧盟上市许可且变异株疫苗除抗原改变外,生产工艺、控制及设施、质量属性应与原型苗相同或非常相似,WHO仅提出了对不同开发阶段的科学建议,但WHO对于简化临床前研究及临床研究的情形仍限定为已获得EUA的疫苗。
药学方面,各监管机构对需要更新的部分进行了简单的、原则性的阐述,包括:①更新的起始材料(如序列),提出更新和细节信息要求。②更新生产工艺、控制及设施等。各监管机构考虑一致,认为由于序列/毒株变更进行工艺的适应性调整是科学的,但仍需参照原型疫苗提交更新的生产工艺控制策略、工艺验证等数据;对于生产一致性,如工艺验证、关键步骤、中间体控制、关键质量属性及批分析等需提交完整的研究数据并提出了具体的技术要求。③均建议与原型疫苗开展质量可比性研究,如FDA与WHO均期望预期结果同原型疫苗;EMA提出应与原型疫苗相同或非常相似;UK明确提及了同原型疫苗的可比性,但未明确详细要求。④稳定性方面均要求需提供研究数据,如有数据支持,则原型疫苗效期初步适用于变异株疫苗。非临床方面,大部分机构认为,如果可论证原型疫苗安全性及有效性特征可代表变异株疫苗,则可不需要独立研究数据,相关研究数据可作为临床研究支持数据。WHO指南认为,原型疫苗临床保护力为50%~60%的,动物攻毒试验将有助于变异株疫苗的开发判断。临床方面,各监管机构均要求提供安全性研究数据,其中EMA提出可使用有效性研究中获得的安全性数据;均提出与原型疫苗进行免疫原性对比研究,WHO和UK均提出可采用原型疫苗有效性数据。
关于多价疫苗,各机构整体上均未过多考虑或作为重点考虑。其中,FDA和WHO均明确未将多价疫苗纳入变异株疫苗的研发及评价考虑,仅EMA提及了对多价疫苗的框架思考,认为多价疫苗可能引起的调整和研究较单价疫苗考虑更多,尤其是制剂处方及成品检定方法的开发等方面,且存在成品总杂质水平翻倍等可能。UK提出二价/多价可能需要开展额外免疫原性研究,以确定各组分剂量,并研究是否存在相互干扰,并指出开发多价疫苗需更多研究数据,最好与监管方进行讨论;即认为多价疫苗的制剂处方开发及成品质量控制将会成为研究的重点。多方的指南提出,质控方法及生产过程中,应能准确区分变异株疫苗与原型疫苗。对于已有上市原型疫苗的多价疫苗开发,其临床研究同单价变异株疫苗,可采用与原型疫苗进行免疫原性桥接试验。另外,FDA和UK均提出应提前考虑变异株疫苗的命名和说明书问题。
6 展望
整体上,各机构均认为在应急状态下,在可能影响疫苗效果的变异株出现之前,前瞻性地建立特定的监管通道以推动针对变异株的疫苗开发是非常必要的。目前,各机构提出的相关意见均较为开放,具有较大的灵活度,且强调和体现目前考虑的实时性,指南会伴随数据的积累进行修订和更新。同时也指出,现有指南由于收集的数据有限,存在较大的不确定性,建议根据具体情况具体分析,开发者应与监管机构保持有效的沟通。
UK提出了流感监管理念的适应性引入及对人体挑战试验的思考,充分体现了在目前新冠病毒大流行背景下,对产品质量、安全性、有效性及产品获得的速度方面进行的平衡性考虑,以期能够有效务实地获得疫苗产品应对疫情。对于新冠变异株的疫苗开发不能完全借鉴流感病毒疫苗监管模式,主要基于以下考虑:①流感疫苗的监管策略是由流感病毒易变的特点决定的,流感病毒与新冠病毒变异模式不同,流感存在重配情况导致更易变异。新冠病毒多为基因位点突变,病毒不会以如此显著的速率突变,导致针对特定抗原的疫苗迅速被淘汰。已有研究结果显示,原型疫苗对新冠病毒突变株仍具有交叉保护效果[19]。②流感疫苗和新冠疫苗的研发基础不同,流感疫苗在长期研发的基础上,对流感病毒结构和特性、疫苗特性有了深入了解,且积累了足够的疫苗安全性和有效性数据。新冠病毒是一种新的病原体,对其科学特性的研究不及流感病毒成熟,另外,许多疫苗形式(如mRNA疫苗)较为创新,研究深度有限,几乎无长期的临床经验,研究基础较为薄弱。③流感疫苗经历了从简化临床到免临床的过程,流感疫苗上市后积累了大量数据,在较长一段时间内,国际上对于流感毒株的更新,要求临床桥接研究或少量的人体攻毒研究。最终开始免临床试验,仅进行毒株替换后质量研究。新冠疫苗目前仍处于研发或上市使用的早期阶段,缺少相应的临床经验积累。④流感疫苗生产用毒株为WHO统一分发的重配株,WHO在重配株生产过程中验证了其生产适用性、外源因子风险及雪貂等动物有效性。对于新冠病毒尚无统一的毒株推荐机制和筛选标准,毒株需进行生产适用性、毒株毒力、传代稳定性及外源因子风险分析等全面的检定和研究。
目前,我国新冠疫苗开发所处的阶段涵盖临床前研究、临床试验研究、EUA及已获批附条件上市等。产品及候选产品覆盖的技术路线较为全面,包括灭活疫苗、重组蛋白疫苗、重组病毒载体疫苗及核酸疫苗等,其中两款新冠灭活疫苗已获WHO批准紧急使用[20-21]。为应对可能出现影响现有疫苗效果的变异株流行应急情况,需建立变异株疫苗产品的快速研发路径及对应监管策略,可借鉴文中所述国外各机构发布的相关考虑,并结合我国国情综合考虑,制定具有科学性、可操作性、灵活性、前瞻性和先进性,且与国际相关指南及意见等相协调的相关指导原则。
