创新细菌疫苗的研究进展及挑战
2021-09-18顾江曾浩邹全明
顾江,曾浩,邹全明
陆军军医大学国家免疫生物制品工程技术研究中心,重庆400038
某种意义上讲,人类文明史就是与病原微生物抗争的历史。在疫苗及抗生素发明之前,细菌一直是人类健康的最大威胁,如鼠疫杆菌、麻风杆菌、伤寒杆菌、霍乱弧菌等,这些曾经让人闻之色变的黑死病、麻风、破伤风等在疫苗使用后几乎销声匿迹,疫苗在帮助人类抵抗细菌性传染病中发挥了极其重要的作用。虽然抗生素的发明和广泛应用使大多数细菌感染获得较好治疗,但目前细菌疫苗仍然是公共卫生防疫体系的重要组成部分,我国规划免疫的“14苗防15病”中,细菌性疫苗占“5苗5病”。此外,细菌性疫苗品种如肺炎球菌疫苗、b型流感嗜血杆菌疫苗、A群C群脑膜炎球菌疫苗等,在非免疫规划疫苗品种中占比超过半数。
由于受到诸多限制,过去研制的细菌疫苗存在血清型保护谱欠宽、有效性不足、生产工艺繁复等问题,已上市的肺炎链球菌疫苗、结核杆菌疫苗、脑膜炎球菌疫苗等正进行升级优化。随着细菌抗生素耐药问题日趋严重,研制针对超级耐药细菌的原创疫苗是目前细菌疫苗的另一个主要研究领域。本文对近年来创新细菌疫苗研发取得的突破和面临的挑战作一简要综述。
1 已上市细菌疫苗升级优化
1.1 肺炎链球菌疫苗 肺炎链球菌是一类富含荚膜的革兰阳性球菌,通常定植于人咽部,主要导致肺炎、中耳炎等局部器官感染和全身脓毒血症乃至死亡。WHO数据显示,仅2008年约880万5岁以下儿童死亡,其中47.6万儿童死于肺炎链球菌感染[1]。20世纪初期美国已研制出灭活全菌肺炎链球菌疫苗,但抗生素的发明使疫苗需求下降,导致疫苗升级进展缓慢。至20世纪60年代抗生素耐药问题出现,疫苗在防控肺炎链球菌感染和耐药中的地位重新获得重视,并推动了疫苗的迅速发展。胞外丰富的荚膜是肺炎链球菌的关键致病因子,其通过介导细菌的黏附、抵抗宿主的免疫杀伤过程发挥致病作用,因此也是疫苗的关键靶标。肺炎链球菌的荚膜具有高度的多样性,已报道的血清型高达97种。目前市面上主要使用的疫苗包括23价肺炎球菌多糖蛋白结合疫苗、13价肺炎球菌多糖蛋白结合疫苗,分别针对23种血清型和13种血清型的肺炎链球菌[1]。
为提高肺炎链球菌疫苗的保护效率,新一代疫苗研发主要聚焦在以下2个方面:首先,增加了多糖结合疫苗的荚膜血清型。2021年6月,美国FDA批准的Prevnar 20以CRM197为载体蛋白,在原有13价多糖基础上,增加了7个血清型的荚膜多糖抗原,分别为8、10A、11A、12F、15B、22F和33F。该疫苗分别在3 902名18~60岁(NCT03760146)、1 710名18~49岁(NCT03828617)和876名65岁以上(NCT03835975)志愿者中完成了Ⅲ期临床试验,结果显示,疫苗的安全性与13价多糖结合疫苗无显著差异,在保证原13价多糖抗原的免疫原性基础上,新增加7个多糖抗原的功能性抗体水平达到预期[2]。同一阶段批准的肺炎链球菌疫苗V114为15价,是CRM197结合的15种血清型荚膜多糖,血清型分别为1、3、4、5、6A、6B、7F、9V、14、18C、19A、19F、23F、22F、23F和33F[3]。
其次,随着对肺炎链球菌致病机制研究的不断深入,大量新型蛋白类毒力因子被发现,并以其为靶标进行新型肺炎链球菌疫苗的研发。重组PcpA、PhtD、PlyD1等单个或联合组成的肺炎链球菌疫苗已经完成Ⅰ/Ⅱ期临床试验[4]。2021年7月,美国FDA授予突破性疗法认定的创新疫苗产品ASP3772,是含有24种肺炎链球菌多糖及2种保守蛋白抗原的新型疫苗(24+2)[5]。该疫苗不仅安全性与13价多糖结合疫苗(辉瑞Prevnar13)无显著差异,且在所有ASP-3772剂量水平下,对血清型3的抗体水平高于Prevnar13对照组;在ASP3772最高剂量水平下,对血清型5和19F的功能性抗体水平显著高于对照组。
1.2 脑膜炎球菌疫苗 脑膜炎球菌是一种革兰阴性带荚膜的需氧双球菌,主要寄居在人体鼻咽部,是引起急性细菌性脑膜炎的主要病原菌之一。在全球范围内每年导致30万~50万人感染,病死率约40%。其中10%~20%的脑膜炎球菌感染幸存者伴有永久性神经系统后遗症,给家庭和社会造成严重的负担[6]。与肺炎链球菌类似,荚膜是其主要的致病因子和疫苗靶标。根据其抗原特性,脑膜炎球菌的荚膜可分为至少13种血清型,其中血清型A、B、C、W135、X、Y导致约95%的脑膜炎感染病例。脑膜炎球菌的血清型分布随患者年龄、地域以及疫苗应用的情况发生变化。目前上市的脑膜炎球菌疫苗主要以多糖或多糖结合疫苗为主。包括A群多糖疫苗、A群C群多糖结合疫苗、ACWY群多糖结合疫苗等[6]。
由于B群脑膜炎球菌的免疫原性较弱,且与人体组织的唾液酸糖蛋白存在交叉反应,不能作为疫苗抗原直接应用。因此,针对B群脑膜炎球菌的疫苗研发一直是疫苗学的难点。基于反向疫苗学技术,PIZZA等[7]筛选出了B群脑膜炎球菌蛋白类保护性抗原,为研制B群脑膜炎球菌疫苗奠定了基础。2014年,FDA批准基于2种重组类脂化H因子结合蛋白(factor H-binding protein,fHBP)变异体疫苗Trumenba。超过2万名志愿者的Ⅲ期临床试验结果显示,该疫苗耐受性良好,可有效诱导针对4种血清型菌株的功能性抗体。使用外膜囊泡(outer membrane vesicles,OMV)技术也是研究B群脑膜炎球菌的重要手段。古巴、挪威和新西兰率先批准使用了基于OMV的疫苗——MeNZB。但自2008年6月起,由于疾病的发病率降低及项目成本等问题,MeNZB停止了常规接种。2015年,FDA批准了由3个重组蛋白和OMV组成的疫苗Bexsero。该疫苗的3个重组蛋白分别为fHbp、奈瑟菌属黏附素A(Neisseria adhesion A,NadA)和奈瑟菌属肝素结合抗原(Neisseria heparin binding antigen,NHBA)。62%~88%接种Bexsero的受试者可产生血清功能性抗体[8]。
1.3 结核杆菌疫苗 由结核分枝杆菌导致的结核病(tuberculosis,TB)是危害全球儿童健康的重要传染病。《2020年全球结核病报告》显示,2019年约1 000万人患TB,约140万人死于TB相关疾病[9]。每年新发儿童TB患者约112万,死亡人数约17.3万[10]。截至目前为止,卡介苗(BCG)是全球使用时间最长、用于预防TB的唯一疫苗。全球每年约89%的儿童(约1亿)接种BCG。BCG接种对重症TB,如粟粒型TB和结核性脑膜炎等具有较好的保护作用。然而BCG还存在诸多不足,主要如下:对青少年和成年人的免疫保护作用不明确,保护作用持续时间有限,且不同免疫方式保护作用差异较大。对于一些存在免疫缺陷的新生儿,早期BCG接种可引起卡介苗病,严重者可导致患儿死亡[11]。因此研究新型结核杆菌疫苗势在必行。
利用基因工程将BCG改造成新型减毒结核杆菌疫苗是重要的研究方向。德国马普感染生物学研究所研制的VPM1002,是利用增强抗原释放的李斯特菌溶血素(listeriolysin)替换BCG的尿素酶基因,以期促进BCG抗原的降解和递送,提高疫苗的免疫应答。VPM1002疫苗的Ⅲ期临床试验结果显示,该疫苗不仅可替代BCG预防重症TB的发生,还可预防结核潜伏感染(latent tuberculosis infection,LTBI)及活动性结核病(active tuberculosis,ATB)的复发[12]。另一个进展较快的新型减毒结核杆菌疫苗为MTBVAC,是敲除编码ESAT-6和CFP10基因的BCG。MTBVAC已在南非地区开展了Ⅰ期临床试验,结果显示,MTBVAC的安全性、耐受性及免疫原性与BCG类似。此外,MTBVAC是目前唯一进入临床试验阶段可用于预防新生儿TB的疫苗[13]。还有研究者在猴体试验中直接将BCG通过静脉注射进行免疫,可明显提高BCG的免疫应答和保护效果[14]。
2021年6月,国家药品监督管理局批准了微卡(VaccaeTM)上市,用作免疫治疗剂,帮助缩短药物敏感TB患者的疗程。微卡属于灭活全菌疫苗,由母牛分枝杆菌菌体蛋白组成,Ⅲ期临床试验结果显示,接种该疫苗及抗结核分枝杆菌治疗的耐多药TB患者,6个月后的痰液阴转率为43%,远高于仅接受药物治疗患者(21%)[15]。RUTI是西班牙Parexel公司研制的新型结核杆菌疫苗,由包裹在脂质体的灭活MTB的毒素组成,Ⅰ期临床试验结果显示,在活动性结核病(active tuberculosis,ATB)患者体内具有较好的免疫原性和安全性[16]。目前RUTI已在南非进入Ⅱa期临床试验,以进一步评价其在治疗耐多药ATB中的免疫原性和安全性。
基因工程重组蛋白疫苗也是新一代结核杆菌疫苗的重要研究方向[17]。目前进展最迅速的为进入Ⅱb期临床试验阶段的Mtb72F和H56。Mtb72F疫苗以Mtb32A和Mtb39A的融合蛋白作为抗原,以AS01E作为佐剂。H56的核心抗原为包括Ag85B、ESAT-6和Rv2660c的融合蛋白,佐剂为聚阳离子肽与CpG OND1a复合佐剂IC31。此外,重组蛋白疫苗GamTBvac和ID93也完成了Ⅱa期临床试验。GamTBvac的核心抗原由Ag85a、ESAT6、CFP10组成,通过融合右旋糖酐结核结构域(dextran-binding domain)与右旋糖酐-DEAE和CpG佐剂制成疫苗。ID93的核心抗原由Rv2608、RV3619、Rv3620、Rv1813组成,佐剂为吡喃葡萄糖脂质的稳定乳液(GLA-SE)。此外还有多种重组蛋白疫苗正处于临床前或Ⅰ期临床试验阶段。
2 原创细菌疫苗的研究进展
抗生素的使用很大程度上解决了细菌感染治疗的问题,因此导致抗生素时代的创新细菌疫苗研发进展缓慢。随着抗生素耐药性的出现和广泛传播,单纯依赖抗生素很难有效解决细菌感染及防控的难题。2014年,WHO发布的《抗菌素耐药:全球监测报告》显示,每年美国因感染超级耐药细菌死亡的人数高达约6.3万,欧盟范围内死亡人数也约达2.5万[18]。2015年,美国公布了一项为期5年的国家行动计划,应对紧迫而严重的细菌耐抗生素威胁。在“十三五”期间,由国家卫生计生委牵头,联合十四个部委,制定了《遏制耐药细菌国家行动计划》,应对细菌耐药带来的挑战,遏制细菌耐药发展及蔓延,维护人民群众身体健康。
疫苗可在源头上预防细菌的定植及传播,有助打破抗生素耐药-新抗生素研发-新抗生素耐药的死循环,从根本上解决细菌感染及耐药菌株流行的问题[19]。肺炎链球菌的低耐药率与肺炎链球菌疫苗的广泛应用密不可分。临床上耐药性强、危害严重的细菌主要包括屎肠球菌(Enterococcus faecium)、金黄色葡萄球菌(Staphylococcus aureus)、克雷伯杆菌(Klebsiella species)、鲍曼不动杆菌(Acinetobacter baumannii)、铜绿假单胞菌(Pseudomonas aeruginosa)、艰难梭菌(Clostridium difficile)等。以下对研究进展较快的金黄色葡萄球菌、铜绿假单胞菌和艰难梭菌的疫苗作一介绍。
2.1 金黄色葡萄球菌疫苗 金黄色葡萄球菌属于革兰阳性球菌,是院内感染及战创伤、烧伤感染的主要病原体,在临床上主要引起皮肤脓肿、骨髓炎、肺炎以及脓毒症等疾病。耐甲氧西林金黄色葡萄球菌(methicillin-resistantStaphylococcus aureus,MRSA)是其耐药性细菌的典型代表,每年造成的死亡人数与艾滋病相当。据美国疾病控制中心统计,仅2011年有80 461人感染MRSA,11 285人死于MRSA相关疾病,死亡率为14%[20]。中国细菌耐药性监测网(China Antimicrobial Surveillance Network,CHINET)数据表明,2016—2020年,在临床分离的革兰阳性菌中金黄色葡萄球菌一直保持第一的地位,同时,MRSA的平均检出率为31.0%~38.4%[21-22]。
金黄色葡萄球菌疫苗的靶点主要集中荚膜、表面黏附因子和分泌性外毒素[23]。目前仅有2个疫苗完成了Ⅲ期临床试验,分别为StaphVax和V710。StaphVax由5型和8型荚膜多糖偶联铜绿假单胞菌外毒素A组成,在3 600名血液透析患者的Ⅲ期临床试验中,未观察到显著的保护效果[24]。V710是重组细菌表面的铁离子转运蛋白抗原IsdB,在心胸外科手术患者中完成了Ⅲ期临床试验,结果显示,V710疫苗接种可诱导高水平的特异性抗体,但未观察到保护效果[25]。此外,还有其他7个疫苗开展了Ⅰ/Ⅱ期临床试验,目前尚无金黄色葡萄球菌疫苗上市。
本研究团队研制的新一代金黄色葡萄球菌疫苗rFSAV,由5个抗原(IsdB、HLA、SpA、SEB和MntC)组成,分别靶向细菌的毒素、膜蛋白及与细菌生长代谢相关的蛋白。该疫苗不仅具有良好的免疫原性,且在脓毒症模型、骨折感染模型和肺炎模型中均可有效抵御金黄色葡萄球菌的感染侵袭,显示出良好的保护效果[26-27]。rFSAV疫苗于2015年获得临床试验研究批件,已经分别完成了累计666人的Ⅰa、Ⅰb期和Ⅱ期临床试验,结果显示,该疫苗具有良好的安全性和免疫原性(尚未发表)。rFSAV疫苗将于2022年开展Ⅲ期临床试验,以充分评价其安全性和免疫保护效果。
2.2 铜绿假单胞菌疫苗 铜绿假单胞菌属于革兰阴性非发酵杆菌,有单鞭毛,不含荚膜,广泛存在于医院环境和人体皮肤、呼吸道等部位,是医院获得性感染最为常见的条件致病菌之一。机体免疫障碍或呼吸功能受损时易感染铜绿假单胞菌,如罹患战创伤、烧伤、机械通气、慢性阻塞性肺病、囊性纤维化等患者。铜绿假单胞菌感染可发生在人体的任何组织和器官,其中角膜、肺脏、皮肤较为常见。进展至败血症等全身型感染的死亡率超过20%[28]。2016—2020年CHINET统计数据显示,铜绿假单胞菌对亚胺培南和美罗培南的耐药率居高不下,泛耐药铜绿假单胞菌的分离率逐年上升[22-23]。
上世纪60年代已开始针对铜绿假单胞菌疫苗的研发,但目前尚无上市疫苗。最初的疫苗多以细菌脂多糖(lipopolysaccharide,LPS)作为抗原,如辉瑞公司研发的7价脂多糖疫苗,分别在肿瘤、烧伤、急性白血病和囊性纤维化患者中完成了Ⅲ期临床试验,结果显示,多糖结合疫苗免疫原性不足,无明显保护效果[29]。另一个完成Ⅲ期临床试验的多糖疫苗为瑞士血清与疫苗所研制的8价脂多糖-外毒素A的结合疫苗,由于保护效果有限等原因未获批上市[30]。澳大利亚IMMUNO公司提取天然的铜绿假单胞菌A型和B型鞭毛研制的蛋白疫苗,在483名囊性纤维化患者体内完成了Ⅲ期临床试验,也未取得预期保护效果。奥地利Valneva Austria GmbH公司研制的基因工程重组蛋白疫苗IC43,由铜绿假单胞菌外膜蛋白OprF190-342和OprI21-83的融合蛋白构成。2015年8月,在812名ICU住院并使用机械通气患者体内完成了Ⅱ/Ⅲ期临床试验,结果显示,该疫苗的接种不能明显降低铜绿假单胞菌感染及其导致的死亡[31]。目前还有4种疫苗正处于Ⅰ/Ⅱ期临床试验阶段,结果值得期待[29]。
2.3 艰难梭菌疫苗 艰难梭菌属于革兰阳性厌氧芽孢杆菌,可导致抗菌药物相关性腹泻、相关性结肠炎和伪膜性肠炎等肠道感染。由于对难治性腹泻的重视和检测手段的升级,近年来艰难梭菌的检出率逐年上升。艰难梭菌毒素A(Clostridium difficiletoxin A,TcdA)和毒素B(Clostridium difficiletoxin B,TcdB)是该菌的主要毒力因子,可引起鸟嘌呤三磷酸酶(Rho GTPase)失活,导致细胞死亡和肠道屏障功能损害,从而引发感染性疾病。甲硝唑、万古霉素和非达霉素是目前治疗艰难梭菌感染的主要药物,但由于耐药性和复发等问题,这些抗生素治疗效果有限,急需疫苗、抗体等其他手段进行干预[32]。2016年,美国FDA批准了首个用于艰难梭菌感染辅助治疗的靶向毒素B的单克隆抗体药物bezlotoxumab[33]。
目前该类疫苗研究主要靶向艰难梭菌的毒素A和B。研究进度较快的为赛诺菲巴斯德研制的TcdA和TcdB的双价毒素疫苗。疫苗于2020年9月在9 302名50岁及以上高风险人群中完成了Ⅲ期临床试验,试验中期分析表明,疫苗有效性为-5.2%,因不能降低高风险人群的艰难梭菌感染而中止后续研究[34]。辉瑞公司通过基因工程脱毒的双价毒素疫苗IC84在Ⅰ/Ⅱ期临床试验取得预期效果,目前正在50岁以上的高风险人群中开展Ⅲ期临床试验[35]。一个基于TcdA和TcdB的中和表位疫苗在50岁以上人群中完成了Ⅱ期临床试验,结果显示,该疫苗针对2种毒素抗体的阳转率高达83%,但目前尚无相关Ⅲ期临床试验(NCT02316470)的报道[36]。此外还有针对细菌芽孢形成和组装关键蛋白BclA1、CdeM和CotA的候选疫苗等,目前仍处于实验动物评价阶段[36]。
3 创新细菌疫苗研究的难点及对策
与病毒明显不同,细菌以独立的生命体存在,不仅基因组庞大,还可形成芽孢、L形变异体、鞭毛、荚膜等特殊结构。细菌感染是一个动态调控的过程,依靠差异化的致病因子,在人体组织器官造成结局迥异的感染,这可能是大多数单一靶点的细菌疫苗均未达到预期效果的主要原因。运用大数据、人工智能、多组学技术,全面加深对细菌致病过程和宿主抗感染免疫应答的认识,基于多靶点、多组分的“鸡尾酒”疫苗成为研发细菌疫苗的重要策略。目前大量的多组分细菌疫苗正处于临床研究阶段或批准上市,见表1。
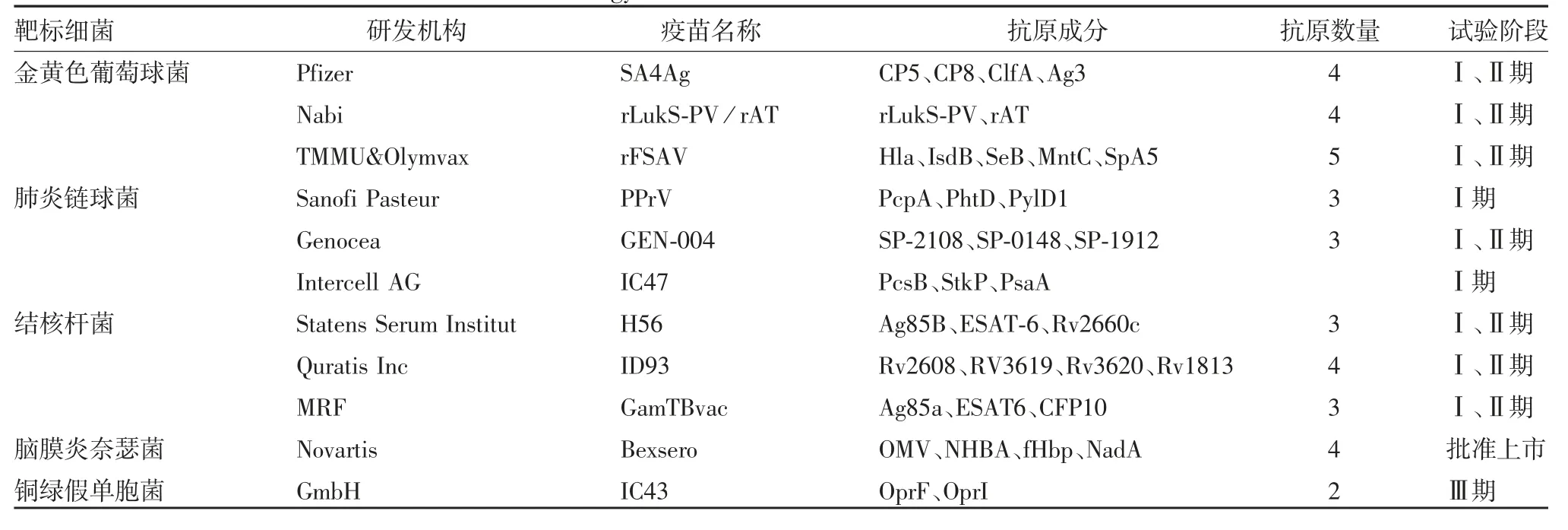
表1 基于“鸡尾酒”策略的细菌疫苗Tab.1 Bacterial vaccines based on“cocktail”strategy
疫苗佐剂和递送系统对疫苗保护效力提升更加重要,而目前细菌疫苗的佐剂主要以传统的诱导体液免疫应答的铝盐佐剂为主。因此,充分利用纳米医学、结构生物学、材料学等学科的最新进展,开展脂质体、自主装纳米颗粒、假病毒颗粒、高分子纳米材料、细胞因子复合佐剂、黏膜佐剂等新一代疫苗佐剂和递送系统研究,提高细菌疫苗的免疫应答强度及丰富免疫应答类型,是成功研发新型细菌疫苗的基础。
系统、准确的临床流行病学数据是评估创新疫苗研究的必要性、有效性和重要性的基础和前提。一些经典的重要病原细菌如白喉杆菌、百日咳杆菌等发病情况由国家和地方的疾控中心进行监测。而针对耐药金黄色葡萄球菌、铜绿假单胞菌和艰难梭菌等细菌的临床数据不完整,主要来自行业协会,缺乏行政力度,数据的权威性和系统性有限,严重阻碍了疫苗人体临床试验方案设计和有效性评价。因此,建议在国家层面纳入法定管理,并联合多学科、多部门,完善耐药细菌感染流行病学监测体系,深入开展病原细菌的流行规律、感染疾病负担研究,为创新细菌疫苗研制提供基础性条件支撑。
突发其来的新型冠状病毒肺炎疫情,重新让疫苗获得了科学家、政府和资本的青睐,全面推动了疫苗技术如mRNA疫苗技术、多糖结合生物合成、新型疫苗佐剂等的快速发展,创新细菌疫苗的研究也迎来前所未有的机遇。希望更多的科学家们在后疫情时代研制出更多更好的细菌疫苗,为人类健康保驾护航。
