人参皂苷Rg1纳米颗粒对缺血性脑卒中后血管新生的干预作用
2021-09-16沈俊逸王东轶壮雨雯
沈俊逸,王东轶,蔡 辉,杨 帆,壮雨雯,商 玮
0 引 言
缺血性脑卒中是指脑供血障碍造成相应神经功能损伤的临床综合征,具有高致死率和高致残率的特点,造成了严重的社会经济负担。促进血管新生是缺血性脑卒中后功能恢复的关键治疗策略[1]。脑卒中后的血管新生不仅可以改善局部缺血缺氧,还能通过分泌多种细胞因子来调节突触生长和神经发生[2-3]。因此,血管新生是决定缺血性脑卒中后神经功能恢复及预后的重要因素。
人参皂苷Rg1是从人参中提取的有效成分,可以促进血管新生,对缺血性脑卒中的神经损伤具有保护作用[4],但人参皂苷Rg1不具备主动作用靶组织或靶细胞的能力。新型纳米载药系统,即在纳米颗粒的表面耦联单克隆抗体OX26,能够主动靶向性结合血脑屏障(blood brain barrier,BBB)中脑微血管内皮细胞(brain capillary endothelial cells,BMECs)的转铁蛋白受体,将其包裹人参皂苷Rg1后可以协助药物靶向作用于BMECs,从而提高药物的生物利用率[5]。本研究拟构建单克隆抗体OX26修饰的纳米颗粒,并用包裹人参皂苷Rg1的纳米颗粒(Ginsenoside Rg1 -nanoparticles,Rg1-NPs)处理BMECs,观察Rg1-NPs 对BMECs增殖、迁移和成管能力的影响。
1 材料与方法
1.1 材料青霉素/链霉素、胰酶、胎牛血清购自Hyclone公司,磷酸缓冲盐溶液(phosphate buffer saline,PBS)购自南京生兴生物,MTT溶液购自beyotime公司,二甲基亚砜(dimethyl sulfoxide,DMSO)购自sigma公司,0.4%结晶紫染色液购自Solarbio公司,Transwell小室购自Millipore公司。
1.2方法
1.2.1 Rg1-NPs的制备本研究采用聚谷氨酸和苯丙氨酸乙酯共聚物制备。L-PAE与小分聚谷氨酸在酰胺化催化剂的作用下发挥酰胺化缩合,形成共聚物。共聚物与人参皂苷Rg1溶解混合在DMSO中,形成的纳米颗粒通过离心进行富集,再将上清中游离人参皂苷Rg1去除。Rg1-NP与单克隆抗体OX26(100 μg/mL)在酰胺化催化剂的作用下进行耦联,未耦联的单克隆抗体OX26进一步通过离心去除。
1.2.2检测Rg1-NPs的微观结构和表征采用磷钼酸染色法-透射电子显微镜观察Rg1-NPs的微观结构。将纳米颗粒溶液滴至碳膜铜网上,在烘片机上干燥,滴加磷钼酸负染试剂再干燥。将样本置于H-7000型透射电子显微镜下观察并拍摄。将制备所得的Rg1-NPs采用激光纳米粒度仪测定其平均粒径、多分散指数以及Zeta电位。检测Rg1-NPs的包裹率、泄漏率和体外缓释实验。
1.2.3MTT检测Rg1-NPs对BMECs增殖的影响在培养的BMECs细胞中分别加入PBS(对照组)、Rg1(Rg1组)和人参皂苷Rg1纳米颗粒(Rg1-NPs组),培养6 h后,加入10 μL MTT(5 mg/mL)继续培养3 h。去除培养基,每孔加入150 μL DMSO,摇晃均匀,在570 nm波长测定吸光度。
1.2.4嵌套小室方法检测Rg1-NPs对BMECs迁移的影响在培养的BMECs细胞中分别加入PBS(对照组)、Rg1(Rg1组)和Rg1-NPs(Rg1-NPs组),培养9 h后,加入约400 μL多聚甲醛,室温固定10 min,吸干上室固定液,加入约400 μL 结晶紫染液,室温染色10 min,轻轻用PBS浸泡数次以去除多余染料,擦去上室膜表面未迁移的细胞,放入显微镜下观察并计数。
1.2.5小管形成实验观察Rg1-NPs对BMECs成管的影响在培养的BMECs细胞中分别加入PBS(对照组)、Rg1(Rg1组)和Rg1-NPs(Rg1-NPs组),培养9 h后,观察内皮细胞管腔形成情况并拍照。拍照后,使用ImageJ软件Angiogenesis Analyzer Plugin对管腔形成情况进行分析。
1.3统计学分析实验数据采用SPSS 21.0分析,若数据符合正态分布且方差齐,组间比较采用独立样本t检验,以P≤0.05表示差异有统计学意义。
2 结 果
2.1Rg1-NPs的微观结构和表征透射电镜结果显示纳米颗粒为椭圆形,激光纳米粒度仪测定的结果显示Rg1-NPs的平均粒径为203.78 nm,多分散指数为0.135,Zeta电位为-23.13 mV。Rg1-NPs的包封率为(62.83±2.84)%。4 ℃储藏条件下人参皂苷Rg1泄露率为 (5.98±0.58)%,在常温储藏条件下人参皂苷Rg1泄露率为(13.64±1.84)%。在1、4、12、24、36 h分别检测人参皂苷Rg1的释放率,结果显示随着释放时间的延长,人参皂苷Rg1的释放率越高,在24 h后释放保持稳定,见表1。
表1 Rg1-NPs体外稳定性
2.2Rg1-NPs对BMECs增殖的影响MTT实验结果显示,Rg1-NPs组(0.56±0.03)和Rg1组(0.49±0.02)BMECs细胞的增殖皆高于对照组(0.44±0.01),其中Rg1-NPs组BMECs细胞的增殖高于Rg1组,差异均具有统计学意义(P<0.05),说明Rg1和Rg1-NPs均可促进BMECs细胞增殖,且Rg1-NPs优于游离Rg1。
2.3Rg1-NPs对BMECs迁移的影响嵌套小室方法检测的结果显示,Rg1-NPs组(55.33±5.03)和Rg1组(43.67±2.08)迁移的细胞数量均高于对照组(35.00±3.00),其中Rg1-NPs组迁移的细胞数量高于Rg1组,差异均具有统计学意义(P<0.05),说明Rg1和Rg1-NPs均可促进BMECs细胞迁移,且Rg1-NPs优于游离Rg1。见图1。
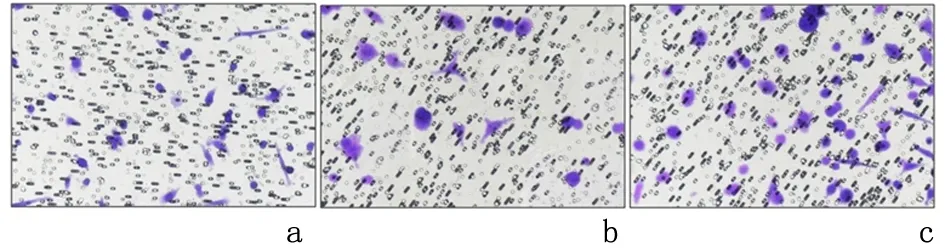
a:对照组; b:Rg1组; c:Rg1-NPs组
2.4Rg1-NPs对BMECs成管的影响小管形成实验结果显示,Rg1-NPs组和Rg1组管腔形成的网眼、点和管腔长度明显均高于对照组,其中Rg1-NPs组管腔形成的网眼、点和管腔长度高于Rg1组,差异均具有统计学意义(P<0.05),说明Rg1和Rg1-NPs均能促进BMECs细胞的管腔形成,且Rg1-NPs优于游离Rg1。见图2,表2。
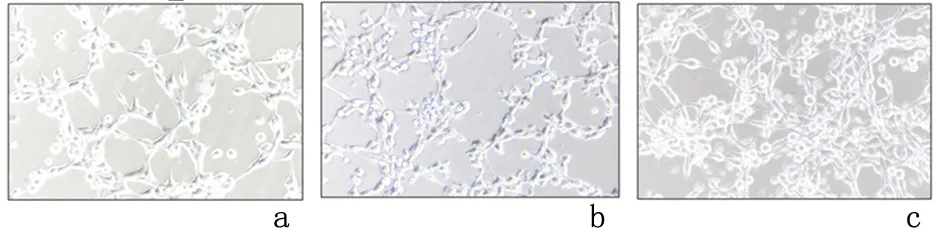
a:对照组; b:Rg1组; c:Rg1-NPs组
表2 Rg1和Rg1-NPs对管腔形成的网眼、点和管腔长度的影响
3 讨 论
缺血性脑卒中是具有高致残率、高致死率和高复发率的疾病,且随着全球人口老龄化,其发病率还在逐年递增[6]。缺血性脑卒中已成为社会的巨大经济负担,但目前治疗方面只有少量抗血栓药物,并存在再灌注损伤和出血的安全问题,因此有必要积极探寻一些新的潜在治疗药物。
缺血性脑卒中是由于脑部供血动脉阻塞导致脑组织供血减少,造成相应神经功能受损。据报道,脑卒中患者生存期与卒中区域的微血管密度密切相关[7]。据报道脑缺血后的轴突生长往往发生在血管新生之后,且鲜少出现在缺血部位周围,说明血管新生与轴突生长密切相关,血管新生是缺血性脑卒中后神经功能恢复的治疗关键[8]。血管新生促进缺血性脑卒中后神经发生(包裹神经干细胞的增殖、迁移和分化)主要体现两个方面:首先,新生血管可以为脑组织提供氧气、营养物质和可溶性因子,为神经干细胞迁移提供良好的微环境;其次,新生血管分泌的β1整合素可以促使神经母细胞与血管黏附,进而促进神经干细胞迁移[2]。鉴于缺血灶和其周围组织的血管新生对神经发生的重要性,血管新生是缺血性脑卒中后神经功能恢复的治疗关键,而促进血管新生的药物则很可能是改善缺血性脑卒中的潜在治疗手段。
人参皂苷Rg1是从三七和人参根茎中提取的主要活性物质,能够通过血管新生来促进神经细胞的增殖、迁移和分化,也可以抑制细胞毒性诱导的氧化应激来减少神经元的凋亡,降低脑缺血动物模型的神经功能缺陷评分和脑梗死体积[9-10]。人参皂苷Rg1具备良好地促血管新生和神经保护功能,却无法靶向作用于BMECs。BMECs是BBB的重要组成部分,保持和恢复BMECs的正常生物学功能有利于促进血管重塑。近年来有关中枢神经系统药物传递系统迅速发展,研究者们逐渐通过增加药物脂溶性、制备药物载体以及鞘内给药等方式,穿透或靶向血脑屏障从而增加药物的生物利用率[11-12]。于是我们制备了耦联单克隆抗体OX26的Rg1-NPs,利用单克隆抗体OX26与BMECs中转铁蛋白受体的结合,载药靶向作用于BMECs[5, 13-15]。前期实验已经证实Rg1-NPs能够主动作用靶组织,进而促进大鼠脑梗死的恢复[16]。本研究进一步探索了Rg1-NPs改善缺血性脑梗死的调控机制,我们通过观察Rg1-NPs对体外微血管内皮细胞系统的影响,探究其对缺血性脑卒中后血管新生的作用。结果表明Rg1-NPs可以促进BMECs细胞的增殖、迁移和成管,且效果优于游离Rg1。目前诸多研究发现中药有效活性成分在改善缺血性脑卒中后血管新生方面具有一定的功效,但传统给药途经往往由于胃酸的破坏以及肝的首过效应导致生物利用率偏低,运用纳米材料作为药物载体的新型给药方式可以有效提高药物的生物利用率和吸收速率。本项研究为缺血性脑卒中后的血管新生和神经功能恢复提供了新的治疗角度,Rg1-NPs有望成为缺血性脑卒中的一种临床治疗药物。
