小鼠部分肝切除术后肝功能指标及干细胞再生研究
2021-09-16朱可心邓浩君饶慧玲国宏莉
刘 洋,柯 镜,朱可心,邓浩君,饶慧玲,于 娟,国宏莉,李 珊
0 引 言
肝是人体物质代谢的中心器官,具有强大的再生能力,增强肝的再生能力对肝疾病患者具有重要意义[1]。临床上,部分肝切除术(partialhepatectomy,PHx)后的顺利恢复主要取决于残余肝的迅速再生以及肝功能的迅速恢复[2]。PHx后,除残余成熟肝细胞迅速进入细胞周期进行增殖外,肝干细胞也迅速分化为肝细胞和胆管上皮细胞,参与肝再生[3]。多项研究表明,肝再生需要肝实质细胞与间质细胞共同参与,两者进行复杂的内部交互协同[4-5]。但目前对肝再生的机制还不完全清楚。本研究旨在探讨小鼠PHx后肝功能指标和不同时期肝增殖细胞的不同表达特征,探寻肝损伤后再生的动态评价指标,为临床上肝代谢、急性肝损伤、肝肿瘤、肝再生以及肝移植等方面提供理论和数据支撑。
1 材料与方法
1.1 实验动物雄性C57BL/6小鼠,6~8周龄12只,许可证号:SYXK(鄂2019-0031),批号:00287628,饲养温度18~24 ℃,相对湿度50%~60%,正常饮食,以肝左叶切除术后第2、4、8天为观察时间点,随机分为假手术组、术后2天、术后4天、术后8天组,各3只。手术操作均在 SPF级环境中完成。术前正常进食、进水,于手术当日分别称取体质量并记录,异氟烷吸入式气体麻醉,麻醉满意后将其固定在自制泡沫鼠板上,取腹正中切口,安尔碘消毒3遍,切口长约 2 cm,打开腹腔,用自制腹腔小拉先用1-0手术丝线集束结扎左外侧叶肝蒂,切除左外侧叶[6]。肝部结扎切除完成,检查无出血后,以0号手术线迅速缝合腹部切口,并注射抗生素,术后小鼠苏醒后确保其能正常进食、进水,定时观察小鼠生存情况。本实验经湖北医药学院实验动物伦理委员会审查(批准号:00287628)。
1.2肝功能评估小鼠部分肝切模型建立后,于术后第2、4、8天处死小鼠,心脏取血进行血清学分析,同时收取正常未手术小鼠血样标本作为正常组。用湖北医药学院附属东风总医院自动化生化分析仪测定谷丙转氨酶(ALT)、谷草转氨酶(AST)、直接胆红素(DBIL)、总胆红素、甲胎蛋白水平。
1.3免疫组化(IHC)检测于术后第2、4、8天处死小鼠,肝称重后用10%中性甲醛固定,石蜡包埋用于进一步组织学分析。取石蜡包埋的肝组织切片5 μm用苏木精和HE染色进行形态学检查,用Ki67、性别决定区Y框蛋白2(sex determining region Y-box 2, SOX2)、S100B评估肝增殖和肝干细胞再生情况。
1.4统计学分析所有数据用GraphPad 6.0进行分析,组间比较采用配对t检验。以P≤0.05为差异有统计学意义。
2 结 果
2.1 PHx小鼠肝大体形态变化结果显示PHx后2、4、8天肝比重均未达到假手术组水平(P<0.05)。手术后2~4 d为肝比重上升的高峰期,术后4~8 d肝比重不再明显增加,暗示PHx小鼠虽然能够迅速启动肝再生,但肝重不能在短时间内立即恢复至正常水平。另一方面,可观察到在PHx后2 d,与肝左外侧叶毗邻的肝中叶表现出充血、增生。见图1。
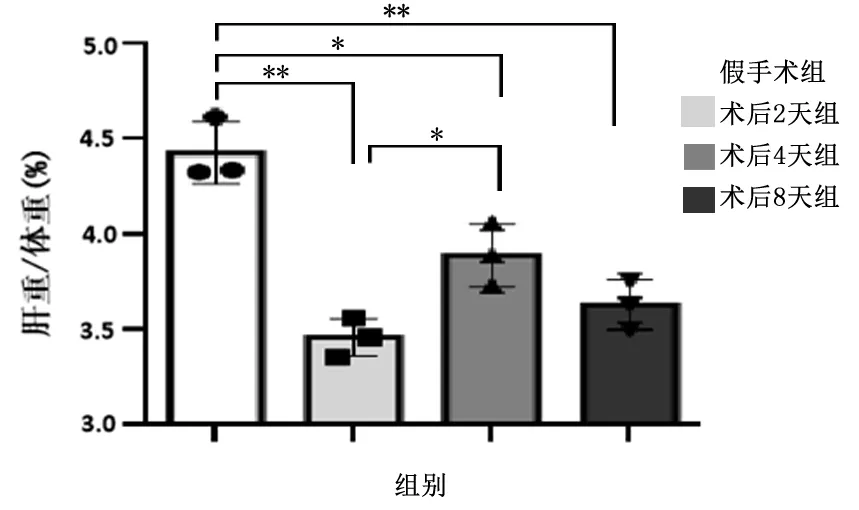
*P<0.05、**P<0.01
2.2PHx小鼠肝功能指标变化与假手术组相比,术后2天组ALT水平显著升高(P<0.05),但是呈现出较大的个体差异。与术后2天组比较,术后4天组、术后8天组快速下降至正常水平(P<0.05)。血清AST水平呈现出类似改变,均为术后第2天急速升高,术后4、8天较术后2天有明显下降(P<0.01),但是术后4天也呈现出一定的个体差异。而直接胆红素在各组无显著差异,且总胆红素、甲胎蛋白含量均小于检测范围。与假手术组比较,术后2天组ALT/AST升高、AST/ALT降低(P<0.05);与术后2天组比较,术后4、8天组ALT/AST降低、AST/ALT升高(P<0.05)。见表1。
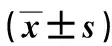
表1 PHx小鼠部分肝功能指标
2.3PHx小鼠肝细胞增殖指标变化HE染色结果显示,假手术组与术后2天,肝中央静脉(central vein, CV)和门管区(portal vein, PV)区域形态结构规整,未见明显异常;而术后4天组小鼠肝门管区可见较多炎性细胞浸润,纤维组织轻度增生;术后8天组小鼠肝再生结束,肝细胞形态大小正常。IHC结果显示, 假手术组小鼠肝正常增殖细胞(Ki67+)数为38.00±6.24,呈点状分布。PHx后第2天,小鼠肝组织内Ki67+细胞数为143.00±14.18,增殖程度明显高于假手术组(P<0.01),增殖的细胞多散在分布于肝实质细胞中。术后第4天,除肝实质细胞外,增生的纤维组织细胞和浸润的炎细胞Ki67+(345.00±50.02),呈现出围绕血管分布的特性,且与术后2天组相比有显著增加(P<0.01)。术后第8天,细胞增殖恢复到正常水平,Ki67+细胞数为42.00±3.51,较术后2天组显著下降(P<0.01)。见图2。
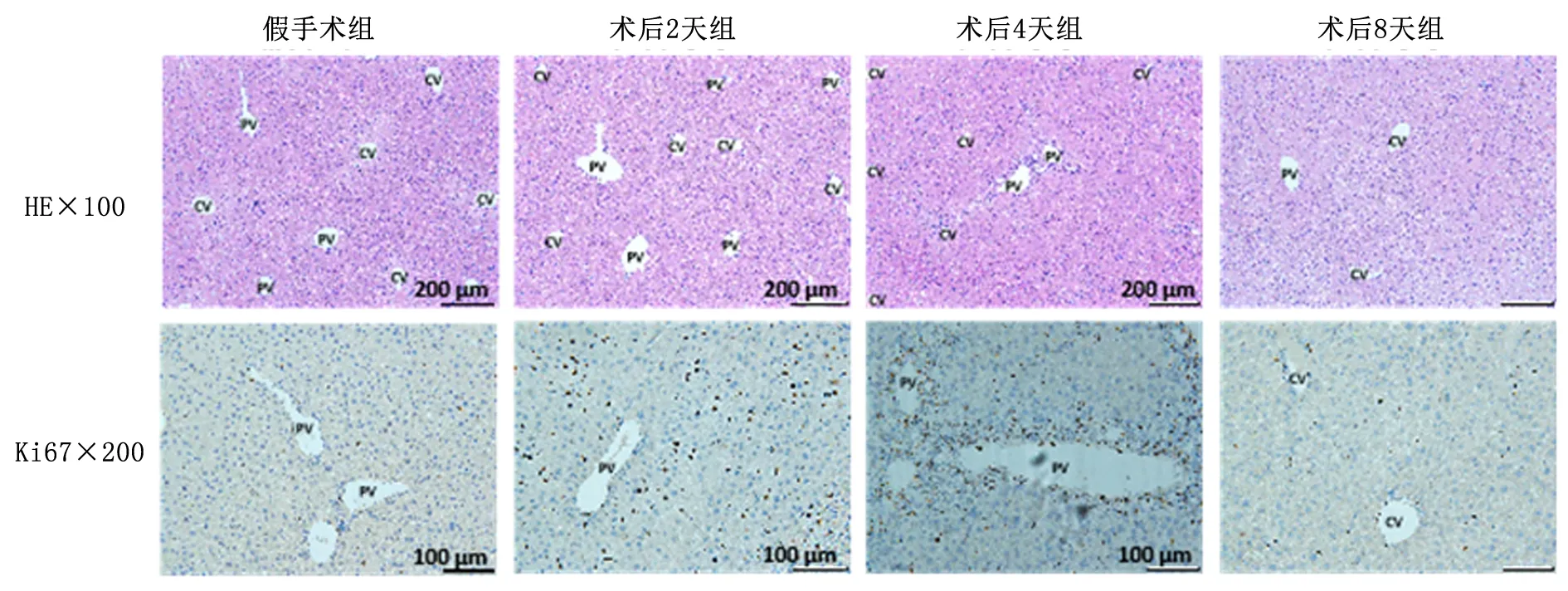
图2 PHx小鼠肝细胞增殖水平
2.4PHx小鼠肝组织SOX2、S100B表达变化IHC结果显示,肝组织内的SOX2蛋白主要表达于PV区附近的肝细胞中,而CV周围未见明显分布。术后2、4天组,SOX2在PV区周围肝细胞内强阳性表达,并且呈现出由PV区肝细胞向周围肝细胞表达逐渐减弱的趋势。另一方面,S100B则主要表达于肝细胞和胆管上皮细胞中。术后2天组可见PV区少数肝细胞与胆管上皮细胞内S100B弱阳性表达。而术后4天组S100B在肝细胞中的表达显著升高,呈现出弥漫性强阳性表达。肝内小胆管增生显著,胆管上皮细胞S100B的表达也有明显上调。与假手术组比较,术后2天组SOX2、S100B表达增加(P<0.05);与术后2天组比较,术后4天组SOX2、S100B表达增加(P<0.05),术后8天组S100B表达减少(P<0.05)。见图3,表2。
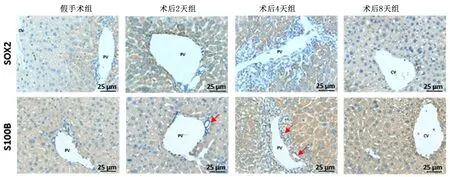
图3 PHx小鼠肝组织SOX2、S100B形态(免疫组化染色)
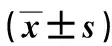
表2 PHx小鼠肝组织SOX2、S100B平均表达强度
3 讨 论
PHx是造成肝机械性损伤的一种方法,我们采用的C57BL/6小鼠肝部分切除模型,完整的保留了门静脉主干、下腔静脉、胆总管和肝动脉的结构,对肝既有机械性损伤,又有灌注损伤,接近于临床肝移植手术过程,实验结果更具有参考价值[6]。研究发现,行小鼠肝左外侧叶切除术后,由于结扎左外侧肝蒂,由于血流动力学变化,导致器官血流重新分配,临近中叶首先发生代偿性增生,与此同时,血清ALT、AST水平会发生明显变化显著升高(术后2 d),但这一过程进展迅速,个体差异性较大。术后4~8 d,血清ALT、AST水平明显下降,肝功能指标逐渐恢复至正常水平,但整个再生过程总胆红素和甲胎蛋白的含量并无明显改变。通过分析,我们认为单独检测ALT、AST能够在一定程度上显示肝功能的指标,但AST/ALT这一指标重复性最好,各组之间的差异更显著,另外,结合本研究检测肝细胞的增殖情况来看,AST/ALT更能够反映肝的损伤与恢复程度。因此,当肝再生患者的ALT、AST指标差异较大时,临床上可以使用AST/ALT来判断该患者的肝功能,具有更强的指导意义。
肝再生的机制极其复杂,是一个由多条通路、多种因素共同参与的一种复杂的调控过程[7-8]。研究发现,小鼠PHx后0~2 d为肝再生的早期诱导阶段,4~8 d是肝再生的晚期阶段,此阶段细胞发生凋亡和细胞增殖以维持再生肝的肝量。近年来的多项研究表明,肝窦内皮细胞有强大的再生能力,在晚期肝再生的过程中有着重要的作用[9-10]。Miyaoka等[11]研究发现,PHx后肝实质细胞的再生在2 d后达到高峰,然后逐渐降低。而Hu等[12]研究表明,PHx后4 d,肝窦内皮细胞的增生达到高峰。这些均与我们的发现一致,肝再生的发生由肝实质细胞和非实质细胞(包括肝窦内皮细胞、Kupffer细胞和卫星细胞等)共同参与,细胞两者协同参与了PHx后的肝再生过程,在再生的初期阶段(0~2 d),以成熟肝实质细胞的增殖为主,在再生的晚期阶段(4~8 d),有内皮细胞、Kupffer细胞等多种非实质细胞共同参与增殖,这说明PHx后2~4 d为重要时间的截点,肝实质细胞和其他细胞可能在这一时间段扮演者不同角色,共同参与并加速肝再生的发生。
人胚胎干细胞 (human embryonic stem cell,hESC)是胚胎着床前的多能细胞在体外培养中形成的多能干细胞系,其具有两大特性——无限自我更新和多能性[13]。干细胞重编程因子(Oct4、 Nanog、SOX2等)在hESC自我更新维持与分化过程中发挥决定性作用,其蛋白水平的高低直接影响hESC细胞的命运[14-15]。而在肝中,也存在着干细胞能够转化为两种构成肝组织主体的细胞(肝细胞和胆管上皮细胞)并参与肝再生的过程。Bhave等[16]研究发现,在施行大鼠PHx后,干细胞重编程因子(Oct4,Nanog,Klf4)在1 d后即出现显著上调,并可能发挥着抗凋亡的作用,过表达/敲低干细胞重编程因子能够影响肝再生的进程。我们的研究发现,PHx后,SOX2在PV区周围肝细胞内强阳性表达,并且呈现出由PV区向周围肝细胞表达逐渐减弱的趋势,暗示着肝干细胞主要分布于PV区附近,当肝损伤发生后迅速启动增殖,向成熟肝细胞进行分化,用于补充和代偿肝组织损伤。
S100B表达异常在神经系统疾病及多种肿瘤中均有报道,具有广泛的生物活性,在细胞增生、分化、基因表达、细胞凋亡中发挥重要作用[17-18]。我们前期研究表明,S100B能够调控血管损伤后的干细胞的分化,驱动干细胞向受损部位迁移[19]。还有研究发现,S100B的表达与肿瘤干细胞标志物(CD133,Nanog和Oct-4)的表达呈正相关[20-21],S100B通过抑制P53诱导卵巢癌细胞具有类似干细胞特性,并诱导肿瘤耐药发生[22]。而本研究显示,S100B主要表达于门管区附近的肝细胞和胆管上皮细胞中,胆管细胞作为肝组织的主体细胞也能够参与肝再生进程。PHx后4 d,肝内小胆管增生显著,S100B在PV区附近的肝细胞和胆管细胞的表达均有明显上调,而此时SOX2的表达在PV区临近的肝细胞也有显著增加,两者的表达方式呈现出一致性,这一结果预示着S100B可能直接或间接参与了驱动肝再生过程中肝干细胞的增殖。
综上所述,肝强大的再生能力是临床上施行PHx和肝移植的病理生理基础。本研究探究了PHx后肝再生过程中肝功能指标的变化规律,检测了肝再生不同阶段细胞增殖的特性,发现了SOX2和S100B阳性细胞可能在肝再生过程中发挥着重要的作用,但其具体作用机制仍需要进一步论证。本研究为促进肝再生、防治肝衰竭奠定一定的理论基础和分子靶标。
