内质网自噬受体1对胃癌细胞生物学功能的影响
2021-09-16马丹丹罗思佳董庆泰张智勇
曹 定,马丹丹,罗思佳,张 翌,董庆泰,龚 齐,张智勇,蔡 逊
0 引 言
胃癌在所有癌症中发病率排名第五位,是癌症相关死亡的第三大常见原因[1-3]。幽门螺杆菌是胃癌的主要病因[4],除幽门螺杆菌外,非贲门性胃癌的危险因素包括年龄大、社会经济地位低、吸烟、饮酒、家族易感、既往胃手术、恶性贫血等[5-7]。在日本和韩国等高发地区,筛查计划的实行使胃癌相关死亡率大幅下降[8-10]。目前胃癌的发生发展机制还不明晰,深入探索胃癌的进展机制,可以为胃癌的诊疗新思路提供依据[11]。134序列相似的家庭成员B (Family with sequence similarity 134, member B,FAM134B),又名内质网自噬受体1。FAM134B基因位于人类染色体5p区域,属于FAM134基因家族成员,该家族成员还包括FAM134A和FAM134C共3个基因[12]。Tang于2001年在通过对比食管鳞状细胞癌与癌旁组织的基因组杂交分析中首次发现FAM134B基因[13],经过多年的研究,FAM134B在多种恶性肿瘤中均起作用,其中包括食管鳞状细胞癌、乳腺癌、结直肠癌和肝细胞癌[12,14-16]。其中FAM134B在食管鳞状细胞癌中表现出原癌基因的特性,而在结直肠癌和乳腺癌中表现出抑癌基因的特性。于此同时,FAM134B的功能障碍在人类神经病变[17]、病毒感染[18]、血管疾病[19]、炎症[20]中发挥作用。但是FAM134B在胃癌中的具体作用机制尚未深入研究,本研究旨在研究FAM134B在胃癌细胞中表达上调对胃癌细胞增殖、迁移、侵袭和凋亡的影响,并通过分析FAM134B相关的信号通路及相互作用蛋白情况来对FAM134B生物学功能进行阐述。
1 材料与方法
1.1 材料
1.1.1 主要试剂pcDNA3.1-FAM134B、pcDNA3.1-vector由本单位中心实验室提供,胃癌细胞系MFC由华中科技大学同济医学院提供,胰蛋白酶、DMSO、DMEM培养液、胎牛血清购自美国Sigma公司,离心管、质粒提取试剂盒、Lopofectamin 2000细胞转染试剂盒购自美国英杰公司,细胞板和培养皿购自美国康宁公司。
1.1.2主要仪器设备二氧化碳培养箱(美国Thermo Fisher Scientific);流式细胞仪(碧迪医疗器械有限公司);标准型超净工作台(佳宝净化工程设备有限公司);荧光显微镜(奥林巴斯有限公司)。
1.2方法
1.2.1 质粒转染取MFC细胞系重悬后细致接种在无菌6孔板进行培养,取Lopofectamin 2000细胞转染液室温下5 min后轻缓混匀细胞转染剂;将DMEM液200 μL和pcDNA3.1-FAM134B质粒4 μg 移入EP管中,轻轻混匀后室温放置;将6 μL细胞转染剂滴加入EP管中,轻轻混匀后室温下放置15 min;将上述含有pcDNA3.1-FAM134B的MFC细胞系(FAM134B组)滴加到6孔板中继续培养;同样方法于MFC细胞系中转染pcDNA3.1-vector质粒(对照组),1 d后行蛋白印迹实验评估质粒转染情况。
1.2.2细胞划痕实验分别用胰蛋白酶消化转染成功的两组细胞,在1000 r/min的条件下离心5 min;重悬计数后行细胞传代,将两组细胞移入12孔细胞培养板中培养直到单细胞铺满培养孔;使用无菌枪头对照直尺,沿培养孔的直径垂直划出1条直线,然后使用PBS缓冲液轻轻洗去刮下来的细胞;向培养板中加入DMEM培养基,放入培养箱中继续培养24 h后拍照记录;运用Image J软件计算两组细胞的愈合率。
1.2.3CCK8法用胰蛋白酶分别消化两组细胞,在1000 r/min的条件下离心5 min。重悬计数后行细胞传代。按每孔细胞数约为1万个将两组细胞移入在96孔细胞培养板中进行培养。培养2 d后并向所有细胞孔中加入新配制的10%CCK8工作液(CCK8原液∶无血清培养基=1∶10)继续培养。30 min后使用酶标仪测定波长450 nm处各孔的吸光度。每组6个复孔,两组都重复试验3次,记载每个复孔的光密度值。
1.2.4Transwell法将稀释后1 mg/mL浓度的Matrige液50 μL均匀移入Transwell小室上室中培养2 h;用胰蛋白酶分别消化两组细胞后离心,重悬计数后行细胞传代。按每孔细胞数约为2万个,将两组细胞移入96孔细胞培养板中培养。取出Transwell小室,向下室中加入含10%胎牛血清的DEME,向上室中加入两组细胞悬液培养48 h。从培养箱中取出Transwell小室,使用无菌棉签柔和吸干。将小室放入甲醛溶液中浸泡20 min固定,用PBS缓冲液洗涤后滴加结晶紫染色20 min,染色后用清水冲洗晾干。将处理完成的Transwell小室置入显微镜下观察,每组4个复孔,随机选取4个200倍视野进行拍照记录,每个视野细胞染色情况取平均值。
1.2.5Annexin V/PI双染色法用胰蛋白酶分别消化两组细胞后离心,取离心完成的EP管用移液枪弃去上清液,用提前预冷好4 ℃的PBS缓冲液冲洗2次。在冰面上向两组细胞滴加1×Binding Buffer 300 μL。再向细胞中加入Annexin V-FITC 5 μL,轻轻充分混匀室温下放置5 min后,加入Propidium Iodide 5 μL,充分摇匀后在避光的环境中室温下放置10 min。使用凋亡试剂盒检测两组细胞凋亡情况,计算出均值后进行统计细胞数。
1.2.6FAM134B基因富集分析通过TCGA数据库对FAM134B相关功能基因集进行数据收集,使用GSEA 4.0.2软件进行多重假设检验矫正,进行随机组合,对于P<0.05、FDR<0.05的基因集进行筛选。
1.2.7利用String数据库分析FAM134B相互作用蛋白网络利用String数据库分析FAM134B蛋白相互作用的蛋白情况,选取String数据库中人类的FAM134B蛋白,对于FAM134B蛋白相互作用的蛋白进行构建网络图。
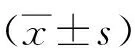
2 结 果
2.1FAM134B过表达对胃癌细胞生物学功能的影响
2.1.1 细胞转染蛋白印迹实验评估质粒转染结果显示,FAM134B组表达水平上升,转染成功。见图1。

1: FAM134B组;2:对照组
2.1.2FAM134B对胃癌细胞迁移的影响细胞划痕实验结果显示,FAM134B组细胞24 h后的愈合率[(48.333±7.095)%]较对照组[(72.667±4.509)%]明显降低(P=0.018)。表明FAM134B在一定程度抑制胃癌细胞的迁移。见图2。

a:对照组;b:FAM134B组
2.1.3FAM134B对胃癌细胞增殖的影响CCK8法检测实验结果显示,FAM134B组A450nm波长的密度值(0.643±0.801)较对照组(1.071±0.783)明显降低(P=0.008)。表明FAM134B在一定程度抑制胃癌细胞的增殖。
2.1.4FAM134B对胃癌细胞侵袭的影响Transwell法对细胞侵袭能力检测实验结果显示,FAM134B组细胞计数[(34.750±3.500)个]较对照组[(57.000±4.690)个]明显降低(P=0.001)。表明FAM134B在一定程度上抑制胃癌细胞的侵袭。见图3。
a:对照组;b:FAM134B组
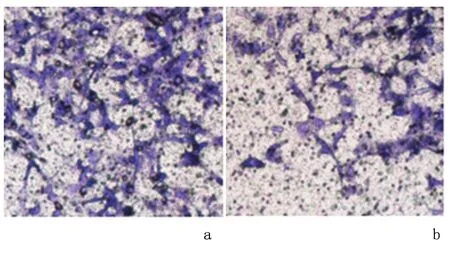
2.1.5FAM134B对胃癌细胞凋亡的影响FAM134B组细胞凋亡计数 [(22.240±2.487)个]较对照组[(12.553±2.155)个]明显升高(P=0.007)。表明FAM134B在一定程度上促进胃癌细胞的凋亡。见图4。
Q1:细胞机械性损伤、Q2:晚期凋亡或坏死细胞、Q3:细胞早起凋亡、Q4:存活正常细胞
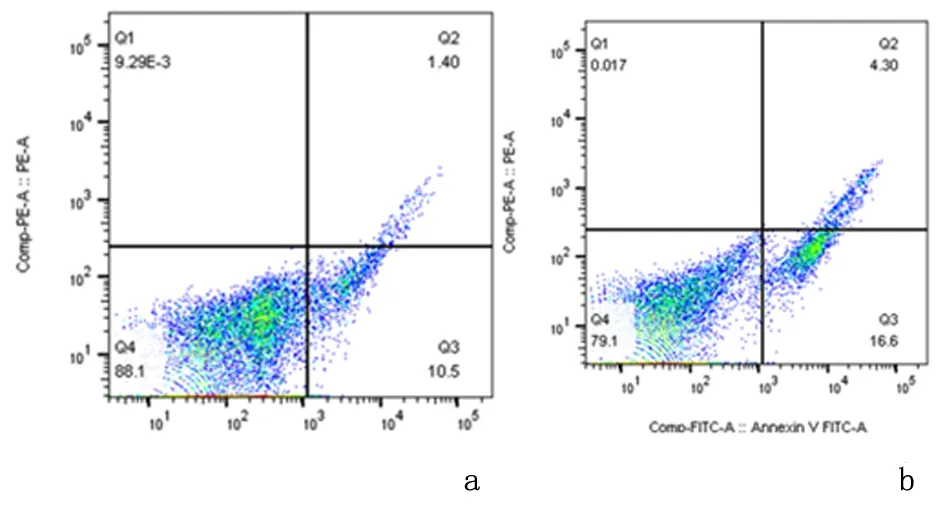
2.2GSEA富集分析富集涉及178个基因集共56514个基因,随FAM134B表达水平上升而上调包括102个基因集,且FAM134B主要参与32条信号通路(P<0.05,FDR<0.05),包括氨基酸代谢、药物代谢、视黄醇代谢、PPAR信号通路、初级胆汁酸生物合成等信号通路。与癌症相关的生物过程和信号通路为色氨酸代谢通路、药物代谢细胞色素P450通路、过氧化物酶体通路、PPAR信号通路。见表1,图5。

表1 FAM134B相关富集分析结果
a:色氨酸代谢通路; b:药物代谢细胞色素P450通路; c:过氧化物酶体通路; d:PPAR信号通路
2.3FAM134B相互作用的蛋白通过String数据库分析FAM134B相互作用蛋白情况,发现与FAM134B蛋白相互作用的蛋白较多且相互作用分数较大,其中相互作用分数(Score)最大的为NAA50蛋白(Score=0.902)、WNK1蛋白(Score=0.759)、CTNND2蛋白(Score=0.718)、PLCXD2蛋白(Score=0.718)、WRB蛋白(Score=0.693)、MAP1LC3B蛋白(Score=0.675)、STX8蛋白(Score=0.647)、RASGEF1B(Score=0.641)、KIF1A蛋白(Score=0.609)、RTN3蛋白(0.604)。见图6。

图6 FAM134B相互作用蛋白图
3 讨 论
FAM134B蛋白的缺失会使内质网自噬功能不全,内质网功能不全会导致内质网中错误折叠蛋白的积累,最终这些因素会诱导细胞凋亡[17]。在肺癌细胞系A549中,FAM134B蛋白的低表达会导致饥饿过程中PAPP和CASPASE 9的积累加速,而CASPASE 8的水平没有变化[17],这表明FAM134B是可能一种影响线粒体通路的抗凋亡蛋白。自噬和细胞凋亡是两种自毁过程,可以消除受损的细胞或细胞器[21]。自噬和凋亡的关系很复杂,在癌细胞株Hela和HCT116中,营养物质的缺乏会诱导细胞自噬来维持细胞生存。然而,在这种情况下抑制自噬会导致细胞凋亡[15]。因此,FAM134B的消耗可能是内质网吞噬抑制的结果,从而诱导细胞凋亡。相反,降低FAM134B水平可减少结肠癌细胞凋亡[15]。因此,FAM134B诱导的细胞凋亡可能在不同的肿瘤中具有组织特异性。在其他生理环境下,自噬也可诱导一种细胞死亡,称为自噬性细胞死亡(II型细胞死亡)。正常情况下,内质网应激或UPR是触发自噬的因素。然而,小分子z36诱导的内质网吞噬可导致内质网应激、UPR和细胞死亡[22]。在此过程中,FAM134B与LC3、ATG9一起被Z36上调,介导过度的ER吞噬,导致ER降解加速,内质网稳态受损[22]。结果表明,仅在Hela中过表达FAM134B就足以诱导内质网应激和细胞死亡[22]。FAM134B参与了I型和II型细胞死亡过程。FAM134B对细胞死亡的影响可能是由这两种对立通路在不同情况下的净平衡决定的,并可能与癌症类型有关。
本研究通过构建FAM134B过表达模型进行体外实验的方式,细胞划痕实验的结果显示,FAM134B上调可以显著抑制胃癌细胞的迁移,差异具有统计学意义;CCK8法对两组细胞活力检测实验结果显示,FAM134B上调可以显著抑制胃癌细胞的增殖,差异具有统计学意义;凋亡试剂盒对两组细胞凋亡水平实验结果显示,FAM134B上调可以显著促进胃癌细胞的凋亡,差异具有统计学意义。进一步对FAM134B的生物学功能及调控机制进行研究,基于TCGA数据库中收集与FAM134B相关基因集信息,利用GSEA软件对FAM134B进行数据分析,结果显示:共有32条信号通路在FAM134B高水平表型处有富集,与肿瘤相关的生物过程和信号通路为色氨酸代谢通路、药物代谢细胞色素P450、过氧化物酶体通路、PPAR信号通路等。其中色氨酸的代谢场所主要是位于小肠及中枢神经系统,于此同时色氨酸代谢在肿瘤细胞中十分活跃。色氨酸于肿瘤细胞中代谢产生犬尿氨酸,犬尿氨酸能抑制树突状细胞功能和激活AHR通路,进而密切参与一些肿瘤的发生及发展过程[23]。FAM134B是否参与色氨酸代谢等信号通路参与肿瘤的进展,还需要更多的实验来具体分析FAM134B作用情况。String数据库分析FAM134B相互作用蛋白情况,可以发现与FAM134B蛋白相互作用蛋白包括NAA50、WNK1、CTNND2、PLCXD2、WRB、MAP1LC3B、STX8、RASGEF1B、KIF1A、RTN3等。其中WNK1蛋白可以通过刺激肿瘤血管生成在内的多种作用来促进肿瘤的生长和转移[24]。WNK1通过激活TRPC6-NFAT通路促进肾肿瘤进展,WNK1表达上调可以促进结肠癌细胞的生成,同时也在肝细胞癌调节中起重要作用[25-27]。FAM134B在胃癌中的表达下调是否与WNK1等相互作用蛋白相关,还需要进一步的研究来深入探索FAM134B相关的相互作用具体情况。
综上所述,FAM134B表达上调可以抑制胃癌细胞的增殖、迁移、侵袭,并促进胃癌细胞的凋亡。且FAM134B相关信号通路及相互作用蛋白密切参与肿瘤的进展。随着对FAM134B研究的不断深入,FAM134B可能成为胃癌诊疗过程中重要的靶点。
