创伤性颅脑损伤后发生进展性出血性损伤的危险因素分析
2021-09-16帅俊坤吴金玉陈军谢晓晓陈强张鑫
帅俊坤,吴金玉,陈军,谢晓晓,陈强,张鑫
创伤性颅脑损伤(traumatic brain injury,TBI)是造成创伤患者死亡和残疾的主要原因[1],其分为原发性脑损伤和继发性脑损伤[2];原发性脑损伤往往不能挽回,因此对其管理策略主要集中在预防和治疗继发性脑损伤上[3]。进展性出血性损伤(progressive hemorrhagic injury,PHI)是继发性脑损伤的一种,定义为与伤后首次头颅CT检查相比,原有出血性病灶体积在随访头颅CT上扩大≥25%或出血体积绝对增加≥6 mL,或者颅内出现新的出血性病灶,但不包括手术患者因止血不彻底造成的再出血[4-7]。其发生率约为19.8%~74.9%[8-13]。既往研究表明,PHI的发生会明显增加TBI患者的病死率和致残率[13-15]。以往有研究报道了TBI患者发生PHI的一些危险因素[16-18],但对此尚存在争议,且对一些因素缺乏量化指标,在临床工作的监测、预防方面缺乏简便性。为此,本研究回顾性分析连云港市第一人民医院神经外科2018年9月—2020年5月收治的409例TBI患者的临床资料,进一步探讨和明确TBI患者发生PHI的危险因素;以期早期识别PHI高危患者并积极进行干预,不仅有助于降低其发病率和致残率,改善TBI患者的预后,还可以减少重复的影像学检查,优化医疗资源的分配。
1 资料与方法
1.1 一般资料 本组患者中男273例(66.7%),女136例(33.3%);年龄16~96岁,平均年龄54.08岁;59例患者(14.4%)发生了PHI。纳入标准:(1)年龄≥18岁;(2)伤后24 h内进行了头颅CT检查;(3)入院72 h内有头颅CT复查;(4)根据《颅脑创伤临床救治指南》(第四版)[19]初步给予保守治疗。排除标准:(1)严重多发伤患者,除头部的简明损伤量表(abbreviated injury scale,AIS)评分≥3分;(2)入院时头颅CT上血肿体积>25 mL;(3)受伤到入院时间>24 h;(4)入院3 d内死亡或自动出院死亡;(5)临床资料(入院时血常规、血凝、CT等结果)缺失的患者。由1名住院医师和1名主治医师根据患者入院72 h内的头颅CT复查与伤后首次头颅CT结果对比判断是否发生PHI,分为PHI组和非PHI组;相互核对后如果二者对PHI的判断持不同意见,则再邀请一名主任医师来得出最终判断。本研究获徐州医科大学附属连云港医院伦理委员会批准(伦理审批号LW20210205001)。
1.2 PHI入组标准 与伤后首次头颅CT相比,入院72 h内随访头颅CT上颅内出现新的出血性病灶或原有出血性病灶明显扩大(较伤后首次CT检查增加至少25%或出血体积绝对增加至少6 mL)[4-7]。血肿体积=A×B×C/2,其中A=最大直径(cm),B=与A垂直的最大直径(cm),C=轴向厚度(cm);多发出血性病灶则分别计算其体积,然后求和得到总的出血性病灶体积[20],不计入直径<1 cm的出血性病灶。
1.3 临床资料收集 患者的年龄、性别、受伤到首次头颅CT检查时间、入院时收缩压和舒张压、格拉斯哥昏迷量表(Glasgow coma scale,GCS)评分,血糖浓度、血小板计数(platelet count,PLT)、凝血酶原时间(prothrombin time,PT)、凝血酶时间(thrombin time,TT)、活化部分凝血活酶时间(activated partial thromboplastin time,APTT)、纤维蛋白原(fibrinogen,Fg)、国际标准化比率(international normalized ratio,INR)、D-二聚体浓度。以及CT显示合并脑挫裂伤或脑实质内血肿、硬膜下血肿(subdural hematoma,SDH)、硬膜外血肿(epidural hematoma,EDH)、颅骨骨折、蛛网膜下腔出血厚度(0级:≤5 mm,1级:5~10 mm,2级:>10 mm),存在中线移位(0级:≤5 mm,1级:5~10 mm,2级:>10 mm),基底池受压(0级:正常,1级:受压,2级:消失);格拉斯哥预后量表(Glasgow outcome score,GOS)评分(4~5分为预后良好,1~3分为预后不良)。均选择入院时首次检查结果。

2 结 果
2.1 单因素分析结果 Wilcox秩和检验显示,PHI组患者入院时GCS评分、血小板计数、活化部分凝血活酶时间均低于无PHI组患者;入院时血糖浓度、D-二聚体浓度、合并脑挫裂伤或脑实质内血肿比例、硬膜下血肿比例、硬膜外血肿比例、颅骨骨折比例均高于无PHI组患者。两组患者受伤到首次头颅CT检查时间、合并蛛网膜下腔出血、存在中线移位、基底池受压消失的差异均有统计学意义(P<0.05~0.001);而性别、年龄、入院时收缩压和舒张压、凝血酶原时间、纤维蛋白原、INR等变量的差异均无统计学意义(均P>0.05)。见表1。

表1 PHI组与无PHI组患者的相关临床因素比较(中位数[四分位间距])

续表
2.2 多因素Logistic回归分析结果 将单因素分析有统计学意义的因素进一步行多因素Logistic回归分析,结果显示D-二聚体、合并脑挫裂伤或脑实质内血肿、合并硬膜下血肿、蛛网膜下腔出血厚度≥5 mm、基底池受压消失是TBI后发生PHI的独立危险因素(均P<0.05)(表2)。对D-二聚体浓度绘制ROC曲线,得到截断值为3 mg/L(图1);然后将其转换为分类变量再次进行Logistic回归,根据最小AIC选择最佳模型。
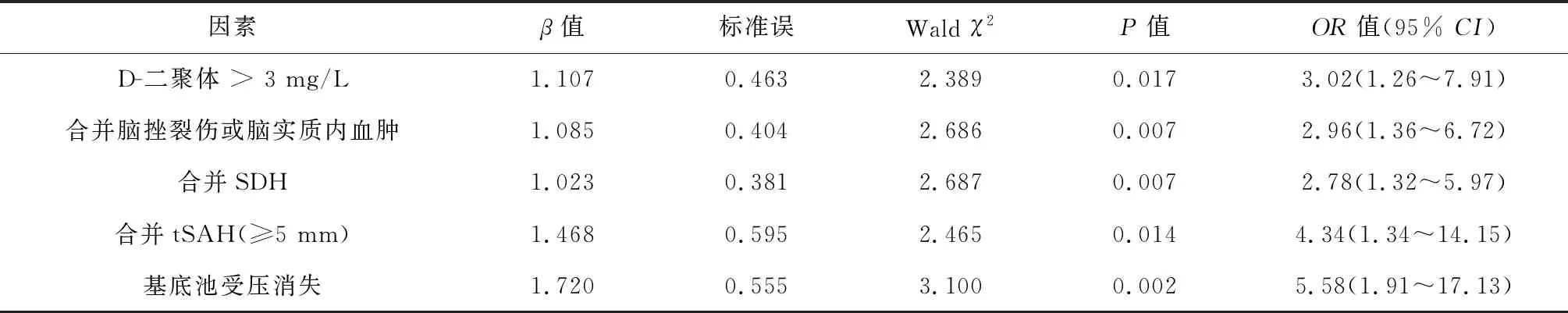
表2 TBI患者发生PHI的危险因素多因素Logistic回归分析

图1 D-二聚体的ROC曲线
3 讨 论
20世纪90年代,Stein等[21]首次描述了PHI,近一半的头部损伤患者在随访CT上显示出延迟性损伤的迹象。PHI是TBI后最严重的并发症之一,患有PHI的患者比没有患PHI的患者有更高的临床恶化风险和更差的预后,可能会使临床恶化风险增加5倍;其已被证实是重度TBI患者死亡和伤残的独立危险因素[5]。因此,TBI后对PHI的早期诊断对改善患者的预后具有重要意义;而早期诊断很大程度依赖于临床医生的警惕性,所以对PHI的高危因素进行评估,可以指导临床医生对此类患者早期识别、早期干预。
关于PHI的发生机制目前虽尚不完全清晰,有如下几种学说,包括全身性缺氧、血管调节失调、凝血机制障碍和保护性机制学说[22],但PHI应归因于原发性损伤时破裂的微血管持续出血;从病理生理学的角度来看,激活的炎症和凝血反应可能会导致PHI的发生[23];因此凝血功能对PHI的预测也被广泛研究。
Folkerson等[11]研究279例孤立的颅脑外伤患者,发现近56%的患者患有PHI。而 Vedantam等[13]报道,200例颅脑外伤患者中有61例患者(30.5%)患有PHI。可见,既往文献报道的PHI发病率差别较大,在19.8%~74.9%之间,这可能与各研究纳入的患者不同,以及对PHI的认识与重视程度、首次CT检查和随访CT检查的时间间隔、甚至判断标准不一致有关。本研究TBI患者中发生PHI的比例为14.4%(59/409例),略低于国内外报道的结果,原因可能为本研究患者中纳入的轻度TBI患者较多(入院时平均GCS评分为13.6分)。本研究的样本量虽较小,但采用Logistic回归同样筛选出了D-二聚体、合并脑挫裂伤或脑实质内血肿、合并硬膜下血肿是TBI后发生PHI的独立危险因素,与既往研究[16-18]报道的一致。另外本研究还发现蛛网膜下腔出血厚度≥5 mm、基底池受压消失亦是PHI发生的独立危险因素,这在之前的研究中少见报道。因此在临床应加强对tSAH厚度较大、基底池受压TBI患者的监测,以预防并发症的发生。
诸多研究表明D-二聚体与PHI的发生关系密切。创伤造成血管破裂之后,凝血过程会被激活,形成止血栓,同时为了防止不正常的血管内凝血,纤溶系统也被激活,凝血物质被大量消耗,继发纤溶亢进,产生大量的D-二聚体[24]。因此,此类患者可能有较高的倾向发生PHI。入院时D-二聚体浓度≥5 mg/L在多项研究中被报道作为PHI的预测指标具有良好的灵敏度和特异度[5,17]。本研究结果显示入院时D-二聚体浓度>3 mg/L是PHI的一项独立危险因素;这种差异可能是由于纳入的对象不同所致,本研究患者中轻度TBI患者占大多数,整体D-二聚体水平不高。
存在原发脑挫裂伤可能代表了原发损伤的严重程度,原发损伤较严重代表可能会撕裂更多的组织与血管,更容易发生PHI[25]。有研究提出小的脑挫裂伤较稳定[8],有的研究却表示大的脑挫裂伤较稳定[10,26],这种差异可能是对PHI的不同定义导致的,还有可能是脑挫裂伤体积较小代表了损伤的严重程度较轻,出血容易停止;而脑挫裂伤较大造成脑组织严重水肿、颅内压明显升高、脑血流量减少,反而不容易发生PHI。Folkerson等[11]研究发现,合并脑实质挫裂伤的患者相比其他颅内出血发生PHI的可能性是其他亚型的4.5倍。考虑到脑挫裂伤或脑实质内血肿的形态不规则和周围水肿带的存在,应用ABC/2的方法计算其体积可能不准确;因此本研究只关注了原发脑挫裂伤是否存在,而没有关注其体积大小。
本研究发现硬膜下血肿和脑实质内血肿是TBI患者并发PHI的独立危险因素,与Cepeda等[10]的研究结果相似。SDH常常是桥静脉撕裂导致的[27],可能代表皮层静脉、桥静脉和静脉窦的损伤,这些损伤可能导致PHI的风险增加[8]。Hsu等[28]报道了1例轻度TBI男性患者,最初的头颅CT检查没有发现明显的出血表现,后来发生了PHI;最后发现有轻微的颞骨骨折和临近的静脉窦损伤及血栓形成,推测这可能与PHI之间有因果关系。此外,SDH还可引起局灶性缺血、再灌注损伤、血管源性水肿和脑血流减少等损伤性局部反应,这些损伤可能会使血肿扩大的风险增加[29]。但目前文献报道仍然没有哪一种颅内血肿亚型比其他亚型具有更强预测性的统一结论,这可能与不同研究纳入对象的标准、初始血肿的大小和样本量等不一致有关。
此外,本研究还发现蛛网膜下腔出血厚度≥5 mm是TBI患者发生PHI的独立危险因素,这在之前的研究中较少提及。Chieregato等[30]发现,脑挫裂伤进展也主要发生在入院CT检查中存在有tSAH的位置,认为大脑凸面的蛛网膜下腔出血可能是皮质薄层出血的早期迹象。Hayashi等[31]报道了2例单纯轻度TBI伴单纯SAH的患者发生PHI行手术治疗,术中发现破裂的小动脉持续性的出血可能是PHI的原因。创伤是SAH最常见的原因,创伤不仅会引起薄壁组织或蛛网膜下腔的小动脉或小的动脉瘤破裂[32],同时也造成组织的撕裂、位移和水肿,损伤的动脉受到牵拉和推挤,止血难度增加,容易发生PHI;此外血液通过受损的小脑膜或蛛网膜进入大脑时,受损组织释放的细胞毒性物质所带来的代谢上的损害可能会加剧PHI进展[30]。颅脑外伤后SAH血肿厚度≥5 mm,表明脑血管受到了较严重且广泛的破坏,可能更容易导致血液渗出、血肿扩大。但还需要做更多的研究来探讨不同程度的蛛网膜下腔出血与PHI的相关性。
本研究显示基底池受压消失是PHI发生的独立预测因子。有文献报道,PHI患者有较高的基底池受压的发生率[13];此外也有研究发现脑池受压是脑挫裂伤进展的独立预测因子[10]。既往的大部分研究没有很清晰地区分不同的脑池,大都使用基底池这一术语,而且对基底池也没有明确的定义。本研究关注的主要是环池和大脑脚池的受压程度,显示基底池受压消失是发生PHI的独立危险因素,但是其机制尚不清楚。因此,基底池受压与PHI发生的关系尚需进一步的研究。
关于TBI后对PHI的治疗,除了常规应用脱水、利尿、神经营养剂等降低颅内压、加强脑保护,及时纠正水、电解质、酸碱平衡的紊乱,注重心、肝、肾等重要脏器的保护以及预防肺部感染、消化道出血外,还应密切监测患者的病情变化,及时调整治疗方案。当保守治疗后患者的病情稳定或有改善,复查CT示血肿量未达到手术指征,且中线移位<3 mm、脑池受压改变不明显,甚至外侧裂池、环池、鞍上池形态有好转,可在严密观察、ICP监测和动态CT随访下继续进行保守治疗。当保守治疗后患者病情无改善或有加重,CT显示幕上血肿量≥30 mL、颅后窝血肿≥10 mL、颞区脑内血肿≥20 mL,有基底池受压、中线移位≥5 mm、鞍上池闭塞,以及ICP≥25 mmHg持续15 min以上,且治疗无效,则应及时进行手术治疗。手术方式主要为颅内血肿清除术,根据术前是否脑疝和术中脑肿胀情况决定是否行去骨瓣减压[19,22]。
综上所述,TBI后PHI的发生与多种因素有关,入院时D-二聚体>3 mg/L,合并脑挫裂伤或脑实质内血肿,合并硬膜下血肿、蛛网膜下腔出血厚度≥5 mm、基底池受压消失是PHI发生的独立危险因素。故对合并上述独立危险因素的TBI患者应增强PHI的防范意识,及时行动态CT检查,严密监测病情变化并制定个性化的治疗方案,以更好地改善TBI患者的预后。
