利用PEI-SWNT介导的瞬时转化检测青花菜基因编辑效率
2021-09-12宋立晓侯忠乐任一鸣严继勇曾爱松许园园张昌伟
宋立晓 侯忠乐 任一鸣 严继勇 曾爱松 许园园 张昌伟


摘要:CRISPR/Cas9基因编辑系统是作物分子设计育种的重要手段,sgRNA设计对于提高基因编辑效率具有重要作用。为了提高sgRNA设计的准确度,构建了聚乙烯亚胺修饰的单壁碳纳米管(PEI-SWNT)介导的瞬时转化体系,并用于检测青花菜CRISPR/Cas9基因编辑效率。结果表明,CRISPR/Cas9编辑体系可以诱导青花菜特定基因位点发生突变,编辑效率为8.3%。研究结果为利用CRISPR/Cas9基因编辑系统创制青花菜新种质提供了基础。
关键词:青花菜;基因编辑;单壁碳纳米管;瞬时转化
中图分类号:S635.301 文献标志码: A 文章编号:1002-1302(2021)13-0056-03
青花菜(Brassica oleracea L .var. italica Planch)又名西兰花,是十字花科芸薹属甘蓝种中以绿色花球为产品的一、二年生草本植物。营养价值较高,含有丰富的维生素,并含抗癌物质,受到消费者的青睐。青花菜栽培历史较短,但发展很快,在我国已成为一些地区出口创汇的重要优质蔬菜种类之一。通过现代育种技术,提高青花菜种质资源的抗性和品质,对于青花菜品种选育工作非常重要。
近年来CRISPR/Cas9基因编辑系统作为一种新型生物学研究手段被开发利用,该系统凭借其技术优越性被广泛应用于拟南芥、烟草、玉米等多种作物的基因组定点编辑[1-3]。CRISPR/Cas9系统的编辑效率受多种因素影响,Cas9核酸酶启动子、sgRNA启动子的类型、sgRNA与目标位点的结合效率,目标靶点的数目、载体的类型、转化的方式以及宿主植株的同源重组修复能力等;优化Cas9基因的密码子可以提高编辑效率[4-5]。熊兴鹏对甘蓝型油菜的研究结果表明,利用不同的sgRNA,其编辑效率从20%到56%不等[6-7]。
不同的sgRNA序列对于目标基因的结合效率具有很大的差异,在依靠特定软件对sgRNA序列进行设计时,各个软件会依据sgRNA序列的碱基种类对其编辑效率进行估算,不同软件的算法差异以及作物种类的影响会造成估算结果常与实际的编辑效率有较大的差异[8],为了排除干扰因素的影响,通过瞬时表达对CRISPR/Cas9转化载体的编辑效率进行检测就尤为重要。
青花菜的再生体系建立比较困难,转化的效率也较低,在实际的操作中往往是经过复杂的步骤实现了遗传转化却由于基因编辑载体的效率较低而无法实现基因编辑,为了避免这种情况,有必要在遗传转化前对基因编辑载体的编辑效率进行检测。
近年来纳米材料渐渐应用到植物的遗传转化中[9]。碳纳米管和聚乙烯亚胺复合体介导的遗传转化是利用聚乙烯亚胺带正电的特性吸附带负电的质粒载体,利用碳纳米管长径比很大的特性,刺破植物细胞壁,将外源载体导入到植物细胞内[10]。利用聚乙烯亚胺修饰的碳纳米管介导的瞬时转化在烟草、小麦、棉花上都已成功实现,在青花菜上还未有先例,本研究参照烟草试验方法,探索该体系在检测青花菜基因编辑效率上应用的可行性。
1 材料与方法
1.1 试验材料
本试验所用青花菜品种是苏青3号,由江苏省农业科学院蔬菜研究所选育而成,由笔者所在课题组保存;碳纳米管购自于先丰纳米材料科技有限公司,聚乙烯亚胺购自于Sigma-Aldrich。相關试验于2019年10—12月在江苏省高效园艺作物遗传改良重点实验室进行。
1.2 sgRNA的设计与基因编辑载体的构建
用CRISPR-p2.0(http://crispr.hzau.edu.cn)在线软件对青花菜紫色相关基因BEE1(Bol030777)基因序列进行靶位点分析,选择位于外显子上、GC含量不低于50%、靠近基因编码区5'端的序列作为靶位点[11];将候选的sgRNA与青花菜的基因组序列进行比对,淘汰脱靶率较高的sgRNA,设计的sgRNA序列如表1所示,并将人工合成的sgRNA序列连接到北京唯尚立德公司VK005-14质粒载体上[12]。选择测序结果一致的质粒进行摇菌扩繁,质粒提取步骤按照天根生化科技(北京)有限公司质粒提取试剂盒说明书进行,提取的质粒浓度需达到1 000 ng/μL,浓度不够则利用浓缩仪进行浓缩。
1.3 PEI-SWNT的制备
按照文献[13-14]的方法制备PEI-SWNT。将1.3 mg干燥COOH-SWNTs加入50 mL锥形底离心管中,加入30 mL蒸馏水,超声波浴处理获得COOH-SWNT悬浊液,PEI与COOH-SWNTs共反应获得PEI-SWNT复合体。PEI与COOH-SWNTs按照1 ∶ 20的比例共反应获得PEI-SWNT复合体,将PEI-SWNT复合体转移到100000-MWCO过滤器中。用无核酸酶的水洗涤PEI-SWNT溶液6次,将过量的PEI洗去。
1.4 基因编辑载体瞬时转化青花菜叶片
准备MES输送缓冲液(pH值=4.5~5.0)用于稀释PEI-SWNT,以PEI-SWNT ∶ DNA(3 ∶ 1)的质量比将500 ng PEI-SWNTs与167 ng质粒DNA复合在一起,室温下孵育30 min以形成DNA-PEI-SWNT复合物。将DNA-PEI-SWNT溶液吸入 1 mL 的无针注射器。在青花菜叶子背面用针尖刺穿,将注射器缓慢注射到青花菜的叶片中。在叶片上轻轻地标记入渗区域,1 d后质粒DNA转录为mRNA,2~3 d将mRNA翻译为蛋白。
1.5 青花菜子叶中瞬时表达荧光蛋白检测
将注射后的植株转移到光培箱(光周期为白天16 h,27 ℃;夜晚8 h,22 ℃)进行培养。于注射后第3天(72 h)在激光共聚焦显微镜下观察叶片是否有GFP荧光蛋白表达。
1.6 候选sgRNA基因编辑效率检测
取青花菜叶片有GFP荧光表达部位的叶片,用CTAB法提取叶片的基因组DNA,根据编辑的基因序列设计包含编辑位点的引物进行PCR扩增(表2)。纯化回收扩增后的PCR片段,连接T载体后进行大肠杆菌转化,每个样品挑取8个单克隆摇菌后PCR扩增测序。将测序结果与青花菜的基因序列进行比较,检测基因位点是否被编辑,并计算编辑效率。
2 结果与分析
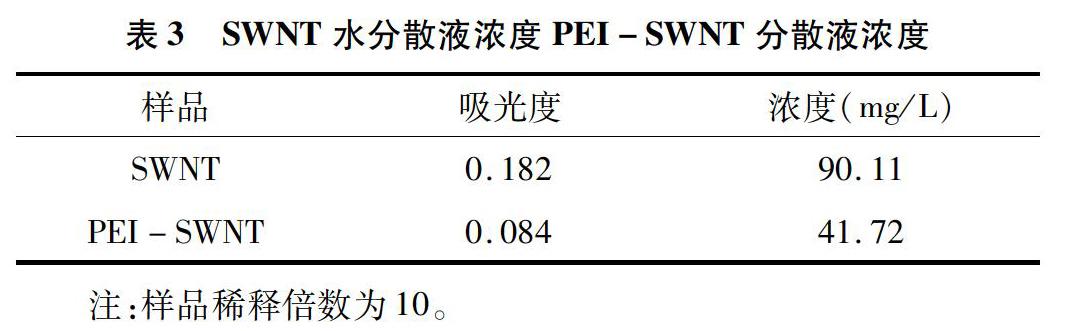
2.1 SWNT水分散液浓度和PEI-SWNT分散液浓度分析
通过对SWNT和PEI-SWNT浓度的测量表明SWNT水悬浊液的浓度为90.11 mg/L(建议浓度在100 mg/L左右),PEI-SWNT的浓度可以达到41.72 mg/L(表3),回收效率为46.3%。PEI-SWNT的浓度达到试验要求。
2.2 青花菜叶片GFP荧光表达分析
利用荧光共聚焦显微镜观察荧光标签的表达情况,由图1可见,注射碳纳米管和质粒的复合体的青花菜叶片可在共聚焦显微镜下观察到绿色的荧光,说明GFP蛋白在注射后第3天已经在叶片表达,通过此方法可以将外源基因导入到青花菜的叶面细胞中并完成外源基因的表达。本试验成功注射32个叶片中有7个可以在荧光共聚焦下观察到绿色荧光,占注射总数的21.9%。
2.3 青花菜CRISPR/Cas9系统候选sgRNA基因编辑结果
提取有GFP荧光蛋白表达的叶片DNA,用表2的引物扩增检测有GFP荧光表达的青花菜基因组的序列,胶回收PCR产物,然后连接到T载体上并转化到大肠杆菌,将挑取的24个单克隆样品摇菌后进行测序。测序的结果中有2个编号样品的序列在基因编辑位点附近发生了基因突变,第5号样品在B1编辑位点PAM附近检测到3个碱基的缺失,第10号样品检测到B1编辑位点单碱基的突变(图2),B2和B3编辑位点没有检测到基因突变。sgRNA在青花菜中的编辑效率为8.3%。
3 讨论
基因编辑技术已经被广泛应用于各类蔬菜的种质资源创新中,sgRNA的编辑效率是影响基因编辑技术成败的关键因素之一[15],通过常规遗传转化方法对sgRNA有效性进行验证比较耗时,且成本较高[12]。瞬时表达体系作为一种简便高效的方法可用于快速验证sgRNA的编辑效率,徐璇等利用柑橘的原生质体成功实现了柑橘的瞬时转化[16],郑天慧等利用原生质体转化的方法在拟南芥上实现了基因编辑并筛选出高效率的sgRNA序列。但通过原生质体实现瞬时转化的方法存在许多局限性,如试验过程中材料容易被污染,对编辑效率的检测难度大等。已有研究表明,PEI-SWNT介导的瞬时转化方法具有操作简便、检测周期短等优点,能够被用于验证sgRNA的编辑效率。本研究探索了在青花菜上建立切实可行的瞬时转化方法,该方法操作简便、快速,可以方便快捷地验证sgRNA的编辑效率。
本研究在已有研究的基础上优化了试验步骤,较大幅度提高了碳纳米管分散液的浓度,利用PEI-SWNT介导的瞬时转化系统在青花菜上实现了更加高效的瞬时转化。试验结果表明,SWNT水悬浊液的浓度可以达到90 mg/L以上,PEI-SWNT溶液的浓度可以达到41.72 mg/L,SWNT结合PEI后的回收率为46.3%,可以满足试验的需求;PEI-SWNT介导的瞬时转化体系可以将外源载体通过叶面注射的方法导入到青花菜的葉面细胞中。提取青花菜瞬时转化部位叶片的基因组DNA,对编辑位点进行测序后发现有单碱基的突变和缺失,说明构建的CRISPR/Cas9系统在青花菜上具有编辑能力。本试验结果显示由PEI-SWNT介导的瞬时转化体系可以完成对青花菜更加高效的瞬时转化,本方法相较于其他瞬时转化方法更简单高效,且单次转化成本可以降低到3美元。该方法为利用基因编辑技术创制青花菜的新种质奠定了良好的基础。
参考文献:
[1]Liu W,Zhu X,Lei M,et al. A detailed procedure for CRISPR/Cas9-mediated gene editing in Arabidopsis thaliana[J]. Science Bulletin,2015,60(15):1332-1347.
[2]Liang Z,Zhang K,Chen K,et al. Targeted mutagenesis in Zea mays using TALENs and the CRISPR/Cas system [J]. Journal of Genetics and Genomics,2014,41(2):63-68.
[3]Gao J,Wang G,Ma S,et al. CRISPR/Cas9-mediated targeted mutagenesis in Nicotiana tabacum [J]. Plant Molecular Biology,2015,87(1):99-110.
[4]张玉苗,李 蓉,鲁 瑶,等. 基于提高CRISPR/Cas基因编辑效率的研究进展[J]. 热带作物学报,2019,40(10):2006-2015.
[5]时 欢,林玉玲,赖钟雄,等. CRISPR/Cas9介导的植物基因编辑技术研究进展 [J]. 应用与环境生物学报,2018,24(3):640-650.
[6]Xiong X,Liu W,Jiang J,et al. Efficient genome editing of Brassica campestris based on the CRISPR/Cas9 system [J]. Mol Genet Genomics,2019,294(5):1251-1261.
[7]陈 凯. CRISPR技术的优化及Cas9酶PAM识别位点的改造[D]. 中国农业科学院,2017:43.
[8]Zhu Q,Liu Y G,Ma X,et al. A protocol for CRISPR/Cas9-based multi-gene editing and sequence decoding of mutant sites in plants [J]. Scientia Sinica Vitae,2018,48(7):783-794.
[9]孔倩倩,李志辉,王 琼,等. 纳米基因载体在植物遗传轉化中的应用[J]. 生物技术通报. 2010,6:6-12.
[10]袁刚强. 单壁碳纳米管材料(SWCNTs)对水稻的植物毒性效应的研究[D]. 湖南大学,2015:50-51.
[11]王玮玮,刘瑞琪,吴勇延,等. CRISPR/Cas9基因编辑系统研究进展及其在动物基因编辑研究中的应用 [J]. 畜牧兽医学报.2019,7:1299-1305.
[12]Demirer G S,Zhang H,Matos J L,et al. High aspect ratio nanomaterials enable delivery of functional genetic material without DNA integration in mature plants [J]. Nat Nanotechnol,2019,14(5):456-464.
[13]Demirer G S,Zhang H ,Goh N S,et al. Carbon nanotube-mediated DNA delivery without transgene integration in intact plants[J]. Nature Protocol,2019,14(10):1-24.
[14]丁莉萍,张杰伟,马 艳,等. CRISPR/Cas基因组编辑技术研究进展及其在植物中的应用[J]. 植物生理学报,2019,55(4):411-424.
[15]马兴亮,刘耀光.植物CRISPR/Cas9基因组编辑系统与突变分析[J]. 遗传,2016,38(2):118-125.
[16]徐 旋. 柑橘原生质体瞬时转化体系优化及利用CRISPR/Cas9技术定点突变山金柑基因[D]. 武汉:华中农业大学,2018:43-46.
