褪黑素调控呼吸代谢及抗氧化活性延缓采后青花菜衰老
2018-03-01朱玲玲胡花丽罗淑芬吴朝霞李鹏霞
朱玲玲,胡花丽,罗淑芬,吴朝霞,李鹏霞※,3,4
0 引 言
青花菜(Brassica oleracea L.var. Italica Planch.)属于十字花科芸苔属甘蓝种,富含多种营养成分,能增强肝脏的解毒能力,提高机体的免疫力,并具有抗肿瘤、抗菌、抗氧化等多种药理活性[1]。采后青花菜在常温下放置2~3 d花蕾便因失水及叶绿素降解而萎蔫、变黄、生霉等,营养成分也迅速被降解,严重影响其商品价值[2]。因此,研究青花菜贮藏保鲜技术具有现实意义。
褪黑素(melatonin,MT),化学名N-乙酰基-5-甲氧基色胺,是所有植物都具有的一种内源吲哚胺。在植物根、茎、叶、花、果实等不同器官中,已经确认了褪黑素的存在[3-4]。现有研究表明,褪黑素参与了植物的多种发育过程,包括发芽[5],幼苗生长[6]和衰老[7]等。褪黑素除了作为黑暗信号和植物生长调节剂外,另一个显著的作用是与保护植物免受内部和环境氧化胁迫有关的抗氧化活性[8]。在叶片组织上的研究表明,MT处理降低了大麦叶叶绿素的降解,延迟了黑暗诱导的衰老现象[9];Wang[10]和 Shi[11]等亦报道,褪黑素通过调控湖北海棠和莲座叶片叶绿素的降解而延缓其衰老。有研究显示,100µmol/L MT处理可维持草莓果实中较高的三磷酸腺苷(adenosine triphosphate,ATP)、二磷酸腺苷(adenosine diphosphateadenosine,ADP)含量以及较高的能荷水平[12];Gao[13]等采用100 µmol/L MT处理桃果实,发现MT处理降低了桃果实的呼吸速率,并显著提高了桃果实的超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)及过氧化物酶(peroxidase,POD)活性;另外,在木薯上的研究也证明了 MT处理通过提高SOD、CAT活性,降低H2O2积累,从而延迟木薯根采后生理变质[14]。然而,褪黑素处理对采后青花菜贮藏过程中呼吸代谢作用尚未见报道。因此,本研究采用褪黑素处理鲜切青花菜,首先对青花菜黄化指数、色差及组织内源褪黑素含量进行分析,进而分析了褪黑素对青花菜总叶绿素含量、呼吸代谢、能量水平、抗氧化物酶及其同工酶活性的影响,旨在阐明褪黑素调控采后青花菜衰老的可能机制,进而为其实际应用提供理论支撑。
1 材料与方法
1.1 材料与试剂
青花菜购买于南京众彩批发市场(由基地订购,并于采摘当日运至批发中心),采用泡沫箱+隔纸+碎冰的方式运回实验室。参考刘红艳[15]的方法,选取大小均一,成熟度一致,无病虫害、机械损伤,花球紧密的青花菜作为试验材料,然后分切成小青花菜头。
色谱级的褪黑素、甲醇、ATP(adenosine triphosphate)、ADP(adenosine diphosphateadenosine)和 AMP(denosine monophosphate)购自美国Sigma-Aldrich;分析纯的氟化钠,丙二酸,磷酸三钠,叠氮钠和联苯胺购自山东西亚化学工业有限公司;分析纯的水杨羟肟酸,丙烯酰胺(Acrylamide)和甲叉双丙烯酰胺(N,N′-Methylenebis acrylamide)购自上海阿拉丁化学工业有限公司;分析纯的盐酸羟胺,对氨基苯磺酸,α-萘胺,甲硫氨酸,氮蓝四唑和核黄素购自上海瑞永生物科技有限公司;分析纯的四甲基乙二胺购自成都市科龙化工试剂厂;分析纯的过硫酸铵购自国药集团化学试剂有限公司。
1.2 主要仪器与设备
CR-400型色差仪(精度0.07以内),柯尼卡美能达有限公司;UV-1102型紫外可见分光光度计(±0.002),天美科学仪器(上海)有限公司;A11 Basic型液氮研磨器(出样粒度:1~100 µm),艾卡(广州)仪器设备有限公司;Seven multi pH计(±0.001),梅特勒-托利多仪器(上海)有限公司;Oxygraph氧电极自动测定体系(最小分辨率:10 × 10–6µmol),英国 Hansatech 公司;KY-Ⅱ型水浴式氮吹仪(控温精度:±1℃),安简(北京)科技有限公司;Aglient 1260 型高效液相色谱仪(1 × 10–8µg最低检测限),安捷伦科技(中国)有限公司;DYY-7C型电泳仪(最大输出电流2 000 mA),北京市六一仪器厂。
1.3 试验方法
根据预试验结果,选用100 µmol/L的褪黑素对青花菜进行浸泡处理,以蒸馏水浸泡为对照(CK1),无任何处理为空白对照(CK0),浸泡5 min后,沥干,将青花菜装入4.5 L的带孔保鲜盒,每处理设置3个重复。贮藏温度为(15±1)℃、相对湿度为 85%~90%。贮藏期间每隔1 d取样1次,用干净的刀具切取青花菜小花蕾于液氮中速冻,并置于–20℃用于相关指标的测定。其中,呼吸代谢各途径的测定采用同期鲜样进行。
1.4 指标测定方法
1.4.1 黄化指数和色差的测定
黄化指数的测定参照 Olarte等[16]的颜色评价标准和Pen等[17]的褐变指数计算。贮藏期间,每1 d测定1次。
黄化指数=∑(黄化级别 × 黄化样品数目百分比) (1)
当青花菜黄化指数大于 2时认为黄化程度严重,样品已不具有商品价值。青花菜的黄化级别按表1判定。
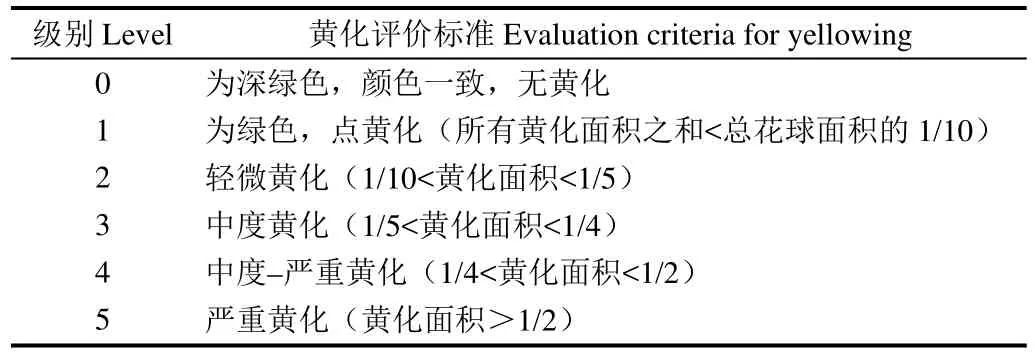
表1 青花菜黄化等级评价Table 1 Evaluation of yellowing level in broccoli
色差的测定参考纪淑娟等[18]的方法,利用色差计测定花球的色度,在L*、a*、b*模式下,每处理每1 d平行测定20次,取其平均值。
1.4.2 褪黑素质量分数测定
参考Sun[19]的方法,略有修改。称取1 g青花菜样品,加入10 mL甲醇,静置1 h,超声15 min随后在4 ℃10 000 g下离心15 min,收集上清液并用0.22 µm滤膜进行过滤,置于新试管中,用氮吹仪吹干。将吹干后的物质用1 mL 80%(v/v)甲醇水溶液重新溶解,震荡混匀,通过0.22 µm滤膜过滤后等待上样。
检测条件:A相(甲醇),B相(50 mmol/L Na2HPO4/H3PO4缓冲液),体积比为40%:60%;采集数据时间30 min;色谱柱Xbridge C18反相柱(250 mm ×4.6 mm × 5 µm);柱温 30℃;流速:1 mL/min;检测器:激发光波长267 nm,发射光波长348 nm;进样量:20 µL。
1.4.3 总叶绿素质量分数测定
参考刘红艳等[15]的方法。
1.4.4 呼吸速率的测定
采用专一性呼吸抑制剂测量各呼吸途径所占比例(%)。参考赵素平等[20]的方法。10 mmol/L氟化钠为糖酵解关键酶烯醇化酶的抑制剂;50 mmol/L丙二酸为三羧酸循环中的琥珀酸脱氢酶的抑制剂;10 mmol/L磷酸三钠为磷酸戊糖途径中的 6-磷酸葡萄糖脱氢酶的抑制剂;5 mmol/L叠氮钠为细胞色素氧化途径的抑制剂;10 mmol/L水杨羟肟酸为交替途径的抑制剂。
称取0.1 g青花菜花萼放入反应杯,反应温度(25.0±0.1)℃,转速 85 r/min;通过分别加入上述抑制剂各0.1 mL,分别测定青花菜在不同途径的耗氧速率以及占总呼吸速率的比例。
1.4.5 三磷酸腺苷(ATP)、二磷酸腺苷(ADP)、一磷酸腺苷(AMP)质量分数及能荷的测定
参照 Liu等[21]的方法,能荷的计算参考公式(2),试验重复3次。

式中ATP、ADP、AMP为各物质质量分数。
参考芦航等[22]的方法。
1.4.7 过氧化氢(H2O2)质量分数的测定
参考Patterson等[23]的方法。
1.4.8 超氧化物歧化酶(SOD)、过氧化氢酶(CAT)及过氧化物酶(POD)活性测定
SOD测定采用氮蓝四唑光还原法[24]。CAT测定采用过氧化氢法[25]。POD测定采用愈创木酚法[26]。
1.4.9 SOD、CAT及POD同工酶活性测定
取1 g青花菜样品,加入50 mmol/L 磷酸缓冲液(含1% PVP、2.55 mmol/L EDTA)10 mL,于10 000 g下离心 15 min,上清液用于同工酶测定。采用垂直平板聚丙烯酰胺凝胶(PAGE)电泳进行同工酶分析,按表2的凝胶配置进行灌胶,其中,凝胶贮备液为30%(m/V)丙烯酰胺:甲叉双丙烯酰胺(29:1),分离胶缓冲液为1.5 mol/L pH值为8.8的Tris-HCl,浓缩胶缓冲液为1.0 mol/L pH值为 6.7的 Tris-HCl。电极缓冲液为 pH值为 8.3的Tris-Glycine。点样量为 40 µL/孔,电泳至溴酚蓝标志到达凝胶前沿为止。
表2 丙烯酰胺凝胶配置Table 2 Acrylamide gel configuration
SOD同工酶测定:分离胶浓度为10%,浓缩胶浓度为5%。染色采用NBT法[27],略作修改。胶片脱下后,于1 mg/mL NBT溶液中黑暗下浸泡20 min,蒸馏水冲洗几次,于 36 mmol/L pH值为 7.8的磷酸钠缓冲液(含28 mmol/L核黄素、50 µL四甲基乙二胺)中黑暗下浸泡15 min,蒸馏水冲洗几次,于50 mmol/L pH值为7.8的磷酸钠缓冲液(含10 mmol/L EDTA)中光照,待酶带显色后,漂洗,照相。
CAT同工酶测定:分离胶浓度为8%,浓缩胶浓度为5%。染色:将1%可溶性淀粉溶液于沸水浴中充分煮沸至无色透明;胶片脱下后放入可溶性淀粉溶液中 4 ℃下浸泡1 h 40 min;倾出淀粉液加入0.5% 过氧化氢溶液,室温静置1 min;然后用双蒸水漂洗几次,加入0.5% KI溶液(取0.5 g,用双蒸水定容至100 mL,加0.5 mL冰醋酸使之酸化);待酶带显色后,漂洗,照相。
POD同工酶测定:分离胶浓度为8%,浓缩胶浓度为5%。染色采用联苯胺染色法[28],略作修改。取0.1 g联苯胺,加入少量无水乙醇溶解,依次加入 5 mol/L乙酸10 mL,1.55 mol/L乙酸钠10 mL,H2O 70 mL,最后加入3~5滴H2O2。待酶带显色后,冲洗,拍照。
迁移率=酶带迁移距离(cm)/溴酚蓝迁移距离(cm) (3)
同工酶条带强度以凝胶图像分析系统扫描的灰度值表示。
1.5 数据统计
采用Origin 8.5软件绘制图表,所有数据为重复的平均值±标准误,显著性采用SPSS 16.0软件进行邓肯氏多重差异分析(P < 0.05),同工酶酶谱采用SensiAnsys 凝胶图像分析系统进行分析。
2 结果与分析
2.1 褪黑素处理对采后青花菜黄化指数和色差的影响
青花菜贮藏过程中花蕾黄化是影响其品质的重要因素之一,也是判断其贮藏寿命的直观因素。由图1可知,在贮藏期间,青花菜的黄化指数不断升高。贮藏第3 d时,CK0、CK1组青花菜开始出现黄化,并迅速上升。贮藏至第6 d时,CK0组青花菜的黄化指数为1.93,黄化程度严重,几乎失去商品价值,同期CK1组青花菜的黄化指数为2.08,完全失去商品价值。相比之下,MT处理组青花菜在贮藏第4 d时出现黄化,而且与CK0、CK1组相比,其黄化指数的上升较为缓慢。例如,在贮藏第4、第5、第6 d时,MT处理组青花菜的黄化指数均显著低于CK0、CK1组(P < 0.05)。值得注意的是,在贮藏第7 d时,MT处理组青花菜的黄化指数仅为1.71,该值仍低于2组对照在贮藏6 d时的黄化指数,表明MT组青花菜在贮藏第7 d仍具有一定的商品价值。因此,在本试验条件下,较2组对照相比,MT可使青花菜的贮藏期限由原来的5 d延长至7 d。

图1 采后青花菜贮藏过程中黄化指数的变化Fig.1 Change of yellowing index of postharvest broccoli during storage
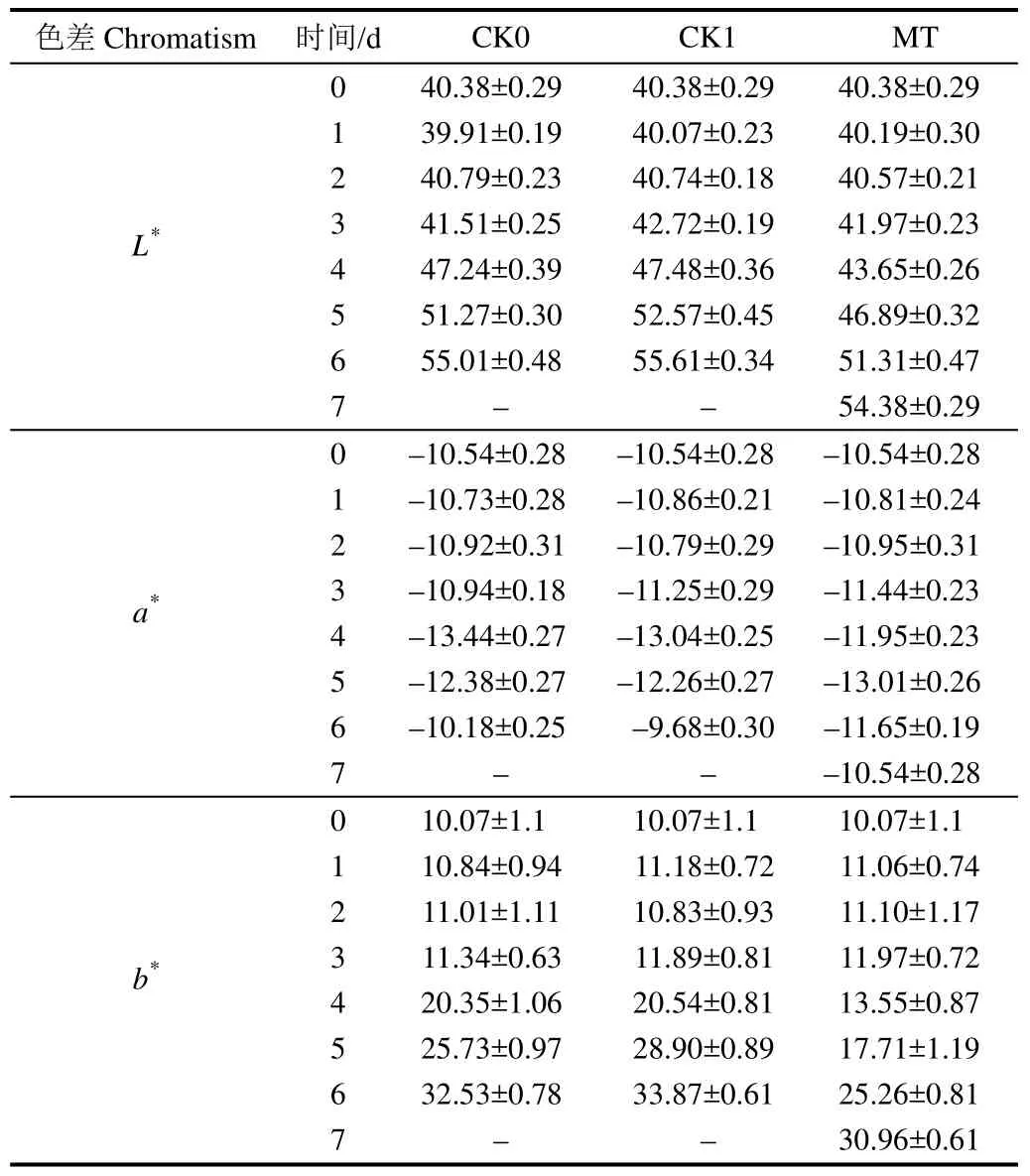
表3 采后青花菜贮藏过程中色差的变化Table 3 Change of chromatism of postharvest broccoli during storage
表3所示,随着贮藏时间的延长,各处理花球的L*、a*、b*值均呈现增大趋势。L*值的增大表示花球的颜色亮度由深开始变浅,a*和 b*值的增大表明花球的颜色开始变黄。在贮藏的前3 d,不同处理青花菜的颜色之间无显著差异;从贮藏第4 d开始,CK0和CK1组青花菜的L*和b*值均迅速上升,而MT组青花菜L*和b*值的上升相对缓慢,且在贮藏第4 d、第5 d、第6 d时均明显低于2个对照组(P < 0.05);从贮藏第5 d起,CK0和CK1组青花菜的a*值也迅速上升,同样MT组青花菜的a*值上升较缓,在贮藏第 6 d时明显低于 2个对照组(P <0.05)。另外,贮藏第7 d时,MT组青花菜的L*、a*、b*值均低于贮藏第6 d时CK0和CK1组青花菜的L*、a*、b*值,可见MT处理可有效延缓采后青花菜L*、a*、b*值的增加,这也与黄化指数的结果一致。
2.2 褪黑素处理对采后青花菜表型的影响
由图2可以看出,贮藏0~2 d内,CK0、CK1和MT处理组青花菜感官品质尚无明显差异;贮藏第4 d时,在CK0和CK1组,部分青花菜已出现黄化,但在同期,MT处理组青花菜仍保持良好的绿色表型;贮藏第 6 d时,CK0、CK1组青花菜已全部黄化,而在MT处理组,仍有部分花蕾保持绿色。

图2 采后青花菜贮藏过程中表型的变化Fig.2 Change of phenotype of postharvest broccoli during storage
2.3 褪黑素处理对采后青花菜内源褪黑素质量分数的影响
采后青花菜贮藏过程中内源褪黑素含量的变化见图3。在整个贮藏期间,CK0、CK1组褪黑素含量之间无明显差异,MT处理组青花菜褪黑素含量虽明显高于CK0、CK1组,但随贮藏时间的延长而显著降低(P<0.05)。
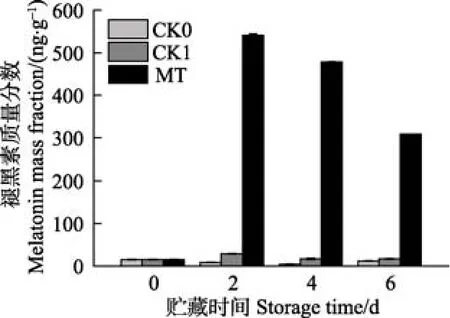
图3 采后青花菜贮藏过程中内源褪黑素质量分数的变化Fig.3 Change of endogenous melatonin mass fraction of postharvest broccoli during storage
2.4 褪黑素处理对采后青花菜总叶绿素质量分数的影响
花球颜色是青花菜重要的品质指标之一,而叶绿素含量与花球颜色关系密切。由图 4可看出,在整个贮藏过程中,青花菜的总叶绿素含量整体呈下降趋势,但MT处理延缓了组织中叶绿素的降解,在贮藏第2、第4、第6 d,MT处理组青花菜的叶绿素含量均明显高于CK0、CK1组(P<0.05)。第6 d时,MT组青花菜的叶绿素较CK0、CK1组分别高出18.03%、24.15%。
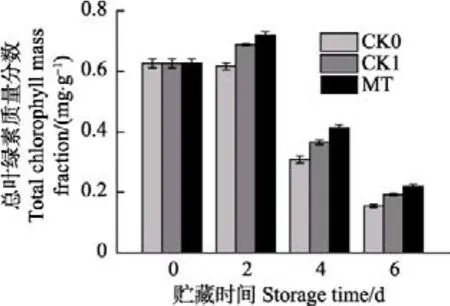
图4 采后青花菜贮藏过程中总叶绿素质量分数的变化Fig.4 Change of total chlorophyll mass fraction of postharvest broccoli during storage
2.5 褪黑素处理对采后青花菜底物氧化水平代谢途径的影响
呼吸作用是果蔬采后的重要生理活动之一,也是判断不同处理对果蔬生理变化影响的重要依据。由图5a可知,青花菜的总呼吸速率整体呈上升趋势,而 MT处理明显抑制了青花菜的呼吸作用,尤其在贮藏第4、第6 d,MT处理组青花菜的总呼吸速率显著低于CK0、CK1组(P<0.05)。

图5 采后青花菜贮藏过程中底物氧化水平代谢途径的变化Fig.5 Changes of pathway of substrate oxidation level metabolic in postharvest broccoli during storage
如图5b所示,在整个贮藏期间,CK0、CK1组青花菜的糖酵解(embden-meyerhof-parnas,EMP)途径总体呈先上升后下降趋势,贮藏第4 d达到峰值,而MT处理组青花菜的EMP途径则呈不断上升趋势,贮藏第6 d达到峰值,且峰值显著低于CK1组(P<0.05)。说明MT处理可以延缓采后青花菜EMP途径呼吸峰的出现时间,抑制EMP呼吸的活性。
由图 5c可见,CK0组青花菜的三羧酸循环(tricarboxyfic-acid-cycle,TCA)途径呈先下降后上升再下降趋势,贮藏第4 d达到峰值,而CK1与MT处理组青花菜的TCA途径则呈不断上升趋势。MT处理组青花菜的TCA途径在贮藏第4 d时,显著低于CK0、CK1组(P<0.05),在贮藏第6 d时,显著低于CK1组(P<0.05)。
由图 5d可知,CK0、CK1组青花菜的磷酸戊糖(phosphopentose pathway,PPP)途径呈先下降后上升趋势,MT处理组青花菜的PPP途径则呈不断上升趋势。尽管如此,在贮藏第4 d时,MT处理组青花菜的PPP途径显著低于2个对照组(P < 0.05),在贮藏第6 d时,显著低于CK1组(P < 0.05)。
2.6 褪黑素对采后青花菜电子传递末端途径的影响
细胞色素氧化途径(cytochrome pathway,CP)是呼吸链中电子传递链的 1个主要途径,它的表达与总呼吸强度密切相关。如图6a所示,贮藏期间,CK0、CK1及MT处理组青花菜的 CP途径总体皆呈先上升后下降趋势。贮藏第4、第6 d时,MT处理组青花菜的CP耗氧速率显著低于CK0、CK1组(P<0.05),说明褪黑素处理可抑制采后青花菜细胞色素途经的运行。
交替氧化途径(alternate pathway,AP)是电子传递链的另1条呼吸途径。由图6b可知,同CP途径相反,在贮藏期间,CK0、CK1及MT处理组青花菜的AP耗氧速率总体呈先下降再上升趋势。贮藏第4、第6 d时,MT处理组青花菜 AP途径显著高于 CK0、CK1组(P<0.05)。
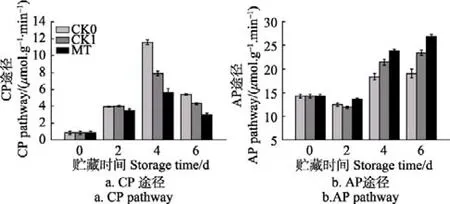
图6 采后青花菜贮藏过程中电子传递末端途径的变化Fig.6 Changes of terminal pathway of electron transport in postharvest broccoli during storage
2.7 褪黑素对采后青花菜能量代谢的影响
细胞的能量供应在果蔬采后成熟衰老中起关键作用,而植物组织中ATP含量则反映了细胞内能量供给的状态[29]。由图 7a可看出,在贮藏期间,CK0、CK1及MT处理组青花菜的ATP含量呈先上升后下降趋势,贮藏第4 d达到峰值。在贮藏第4、第6 d时,MT处理组青花菜的ATP含量均显著高于CK0、CK1组(P<0.05)。
在贮藏过程中,CK0、CK1及MT处理组青花菜ADP含量的变化趋势与ATP含量的变化趋势相似,为先上升后下降(图7b)。贮藏第4、第6 d时,MT处理组青花菜的ADP含量均显著高于CK0、CK1组(P<0.05)。
图7c显示,CK0组青花菜的AMP含量呈不断上升趋势,CK1与MT处理组青花菜的AMP含量呈先下降后上升趋势。在贮藏第4、第6 d时,MT处理组青花菜的AMP含量明显低于 CK0、CK1组(P<0.05),说明 MT处理抑制了采后青花菜组织中AMP含量的增加。
能荷是细胞中可利用能量的一个量化指标,表示细胞中腺苷酸系统的能量状态[30]。由图7d可知,CK0组青花菜的能荷值呈先下降后上升再下降趋势,CK1与 MT处理组青花菜能荷值呈先上升后下降趋势。在贮藏第2、第4 d时,MT处理组青花菜的能荷值显著高于CK0、CK1组(P<0.05),在贮藏第6 d时,MT处理组青花菜的能荷值显著高于CK1组(P<0.05)。
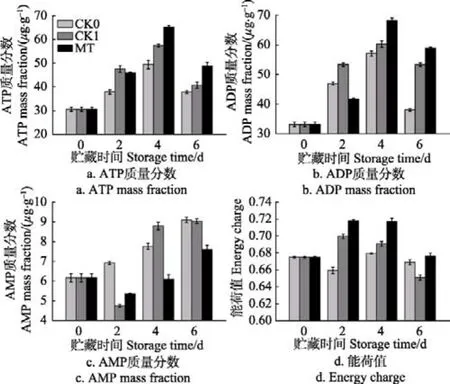
图7 采后青花菜贮藏过程中能量代谢的变化Fig.7 Change of energy metabolism in postharvest broccoli during storage
2.8 褪黑素处理对采后青花菜超氧阴离子()产生速率及过氧化氢(H2O2)质量分数的影响
果实衰老源于活性氧的积累,由于活性氧产生和清除之间的平衡被破坏,使果实衰老加剧。由图8a可知,CK0组青花菜的产生速率随着贮藏时间的延长呈不断上升趋势,CK1与 MT处理组青花菜的产生速率变化趋势相似,为先上升后下降。在贮藏第2、第6 d时,MT处理组青花菜的产生速率显著低于 CK0、CK1组(P<0.05),在贮藏第4 d时,MT处理组青花菜的产生速率显著低于CK1组(P<0.05)。
采后青花菜贮藏过程中 H2O2含量的变化情况见图8b,CK0、CK1及MT处理组青花菜的H2O2含量均不断上升。在贮藏后期(第4、第6 d),MT处理组青花菜的H2O2含量显著低于CK0、CK1组(P<0.05)。
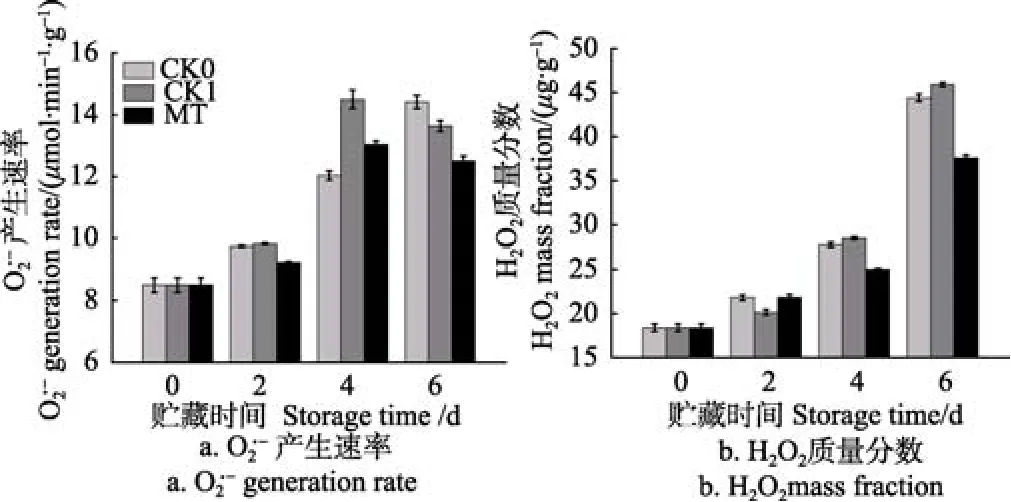
图8 采后青花菜贮藏过程中产生速率、H2O2质量分数的变化Fig.8 Changes of generation rate and H2O2 mass fraction of postharvest broccoli during storage
2.9 褪黑素对采后青花菜SOD、CAT及POD活性的影响
SOD是一种自由基清除剂,它可以清除细胞内超氧阴离子自由基(),通过歧化反应生成无毒的和毒性较低的H2O2,而H2O2再被CAT或POD进一步催化分解为H2O和。图9为采后青花菜贮藏过程中SOD、CAT及POD活性的变化情况。可以看出,在整个贮藏过程中,CK0、CK1及MT处理组青花菜的SOD、CAT及POD活性整体皆呈波动上升趋势,在贮藏第4、第6 d时,MT处理组青花菜的SOD、CAT及POD活性均显著高于CK0、CK1 组(P<0.05)。
2.1 0 褪黑素处理对采后青花菜SOD、CAT及POD同工酶的影响
由图10a、10b可知,采后青花菜的SOD同工酶出现了 3条谱带,标记为SODⅠ、SODⅡ和 SODⅢ,其迁移率分别为0.25、0.41及0.55。SODⅢ条带强度较SODⅠ、SODⅡ略高些,说明SODⅢ对SOD活性贡献较大。在整个贮藏期间,CK0、CK1及MT处理组青花菜SOD同工酶条带数量相同,且变化趋势相一致,为先上升后下降。在贮藏第2、第4 d时,MT处理组青花菜SODⅠ、SODⅡ、SODⅢ条带强度均明显高于CK0、CK1组(P<0.05)。
由10c、10d可知,采后青花菜的CAT同工酶只出现了 1条谱带,其迁移率为 0.16。整体变化趋势为先上升后下降,贮藏第2、第4 d得以较好的表达。在贮藏第4 d时,MT处理组青花菜 CAT同工酶条带强度明显高于CK0、CK1 组(P<0.05)。
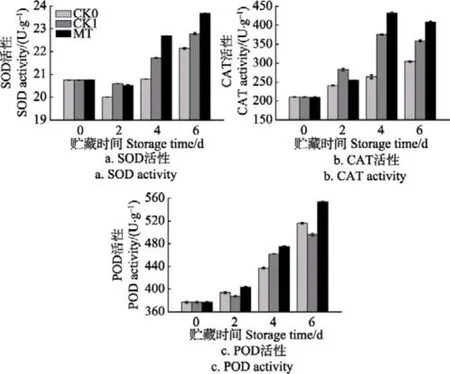
图9 采后青花菜贮藏过程中SOD、CAT、POD活性的变化Fig.9 Changes of the activities of SOD, CAT, and POD in postharvest broccoli during storage
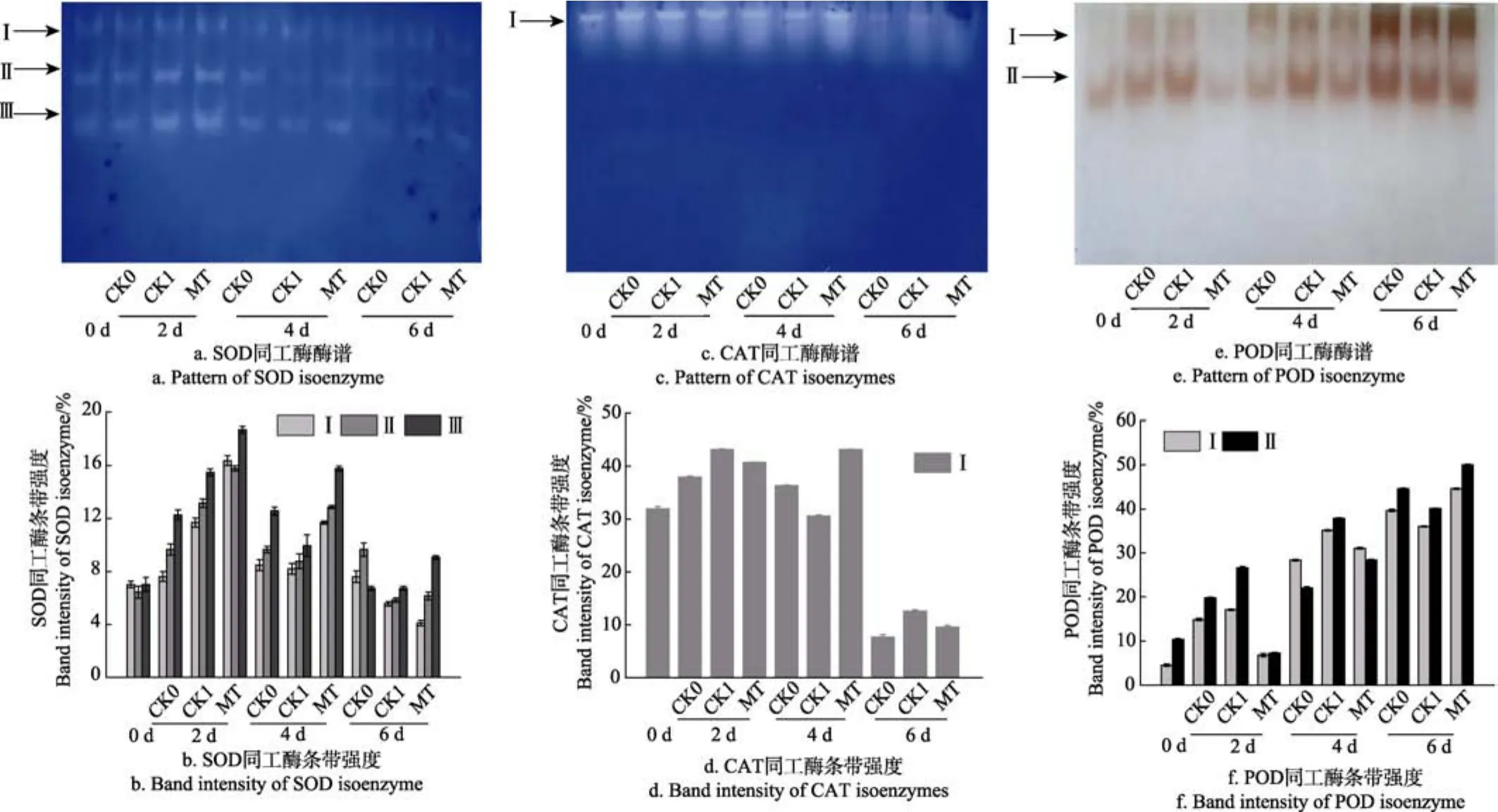
图10 采后青花菜贮藏过程中SOD、CAT及POD同工酶的变化Fig.10 Changes of isoenzymes of SOD, CAT, and POD in postharvest broccoli during storage
由图10e、10f可以看出,采后青花菜的POD同工酶出现了2条谱带,标记为PODⅠ、PODⅡ,其迁移率分别为 0.14、0.34。总体看来,PODⅡ条带为主条带,颜色较深,说明这种POD同工酶表达较好,对POD活性贡献较大。在整个贮藏期间,CK0、CK1及MT处理组青花菜的POD同工酶数量相同,且整体变化趋势相一致,为波动上升,与POD活性变化测定结果相一致。在贮藏第6 d时,MT处理组青花菜的PODⅠ、PODⅡ条带强度明显高于CK0、CK1组(P<0.05)。
3 讨 论
青花菜衰老的显著标志为黄化,本研究通过对采后青花菜黄化指数及色差的测定发现,100 µmol/L褪黑素(MT)处理可明显抑制采后青花菜黄化,使其在贮藏第7 d仍具有较好的商品性质,延长了采后青花菜的贮藏寿命。同时,MT处理可显著延缓采后青花菜叶绿素的降解。与Arnao等[9-11]人研究结果相互印证。
呼吸强度是衡量采后果蔬呼吸代谢的一个主要指标。呼吸速率越高,果蔬的营养物质消耗越快[32],抑制采后果蔬的呼吸活动可有效保持其品质[33]。本试验结果表明,褪黑素处理可降低采后青花菜的总呼吸强度,延缓青花菜黄化衰老。Gao[13]等采用100 µmol/L褪黑素处理桃果实,同样发现褪黑素降低了桃果实的呼吸速率。
糖酵解(EMP)、三羧酸循环(TCA)、磷酸戊糖(PPP)途径是底物氧化水平上的 3条呼吸途径,它们的运行比例与总呼吸强度密切相关。本试验表明,贮藏第 4 d时MT处理组青花菜的 EMP、TCA、PPP途径均显著低于CK0、CK1组;贮藏第6 d时MT处理组青花菜的TCA途径显著低于CK0、CK1组,PPP途径显著低于CK1组,说明MT处理对EMP、TCA、PPP途径的抑制作用体现在贮藏后期,这与总呼吸强度的变化一致。但该研究还有待进一步分析。
细胞色素途径和交替途径是电子传递链上主要的 2条呼吸途径。本研究表明,在整个贮藏期间细胞色素氧化途径(CP)耗氧速率总体呈先上升后下降趋势,而交替氧化途径(AP)耗氧速率则呈先下降再上升趋势。通常AP途径可作为电子传递链的一个支路,从而降低组织内活性氧水平的积累[34]。因此,本文进一步分析了采后青花菜组织中O2•-质量分数的变化,结果发现在贮藏后期MT处理组青花菜中O2•-产生速率低于CK0、CK1组,这可能与组织中电子传递链流向AP途径有关。
果实贮藏期间的能量水平对细胞功能维持非常重要,能量亏缺会引发组织衰老,反之,可延缓衰老进程[30]。Morteza[12]等发现MT处理可维持草莓果实中较高的能荷水平。本试验结果中,在整个贮藏期间 MT处理组青花菜的能荷值始终高于CK0、CK1组,
在正常情况下,植物体内自由基清除系统能够清除其外界环境影响和自身衰老所产生的自由基,是动态平衡过程[35]。在植物衰老或腐败情况下,提高的超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)等抗氧化酶能够清除活性氧代谢的产物,延缓果蔬采后衰老或腐败[36]。本试验结果显示,MT处理可显著提高采后青花菜组织内SOD、CAT及POD活性,从而抑制H2O2的积累,这与Ma[14]等试验结果一致。
SOD对环境十分敏感,其同工酶谱带的变化在一定程度上能反映植物抗逆性强弱。CAT和POD同工酶可分解H2O2,防止膜脂过氧化,进而保护细胞[37]。本研究中,MT处理可不同程度提高青花菜组织内SOD、CAT及POD同工酶活性,从而调节细胞代谢。我们也注意到,贮藏过程中,青花菜组织的SOD、CAT及POD同工酶活性与其酶活性变化趋势未完全一致,其原因仍需进一步研究。
4 结 论
1)由黄化指数和L*、a*、b*值的变化可看出,贮藏至6 d时,2个对照组样品已失去了商品价值;相比之下,褪黑素处理青花菜在贮藏第 7 d的黄化指数与对照组贮藏5 d的结果无显著性差异,表明褪黑素处理可使青花菜的贮藏寿命由5 d延长至7 d。
2)在底物氧化水平上,褪黑素处理显著降低了糖酵解、三羧酸循环和磷酸戊糖呼吸途径的运行比例,从而减缓了采后青花菜的总呼吸速率;在电子传递链水平上,褪黑素处理降低了细胞色素氧化途径的运行比例,同时提高了交替氧化途径的运行比例。
3)褪黑素处理维持了采后青花菜组织中较高的三磷酸腺苷、二磷酸腺苷含量及能荷水平,并抑制了组织中O2•-和 H2O2含量的积累,这与其维持组织较高的超氧化物歧化酶、过氧化氢酶、过氧化物酶及其同工酶活性有关。
因此,100 µmol/L褪黑素可用于采后青花菜的保鲜,维持其贮藏品质。本研究结果对于指导青花菜贮藏保鲜具有一定的实际意义,同时也为褪黑素处理的进一步应用提供了理论支撑。
[1] Lee K M, Lim J, Nam S, et al. Inhibitory effects of broccoli extract on Escherichia coli O157:H7 quorum sensing and in vivo virulence[J]. Fems Microbiology Letters, 2011, 321(1):67-74.
[2] Ma G, Wang R, Wang C R, et al. Effect of 1-methylcyclopropene on expression of genes for ethylene biosynthesis enzymes and ethylene receptors in post-harvest broccoli[J]. Plant Growth Regulation, 2009, 57(3): 223-232.
[3] Jemima J, Bhattacharjee P, Singhal R S. Melatonin-a review on the lesser known potential nutraceutical[J]. International Journal of Pharmaceutical Sciences and Research, 2011, 2(8):1975-1987.
[4] Reiter R J, Tan D X, Zhou Z, et al. Phytomelatonin: Assisting plants to survive and thrive[J]. Molecules, 2015, 20(4): 7396-7437.
[5] Zhang H J, Zhang N, Yang R C, et al. Melatonin promotes seed germination under high salinity by regulating antioxidant systems, ABA and GA4interaction in cucumber (Cucumis sativus L.)[J]. Journal of Pineal Research, 2014, 57(3): 269-279.
[6] Wang P, Sun X, Chang C, et al. Delay in leaf senescence of Malus hupehensis by long-term melatonin application is associated with its regulation of metabolic status and protein degradation[J]. Journal of Pineal Research, 2013, 55(4): 424-434.
[7] Byeon Y, Back K. An increase in melatonin in transgenic rice causes pleiotropic phenotypes, including enhanced seedling growth, delayed flowering, and low grain yield[J]. Journal of Pineal Research, 2014, 56(4): 408-414.
[8] Tan D X. Melatonin and plants[J]. Journal of Experimental Botany, 2015, 66(3): 625-626.
[9] Arnao M B, Hemandez-Ruiz J. Protective effect of melatonin against chlorophyll degradation during the senescence of barley leaves[J]. Journal of Pineal Research, 2009, 46(1): 58-63.
[10] Wang P, Sun X, Chang C, et al. Delay in leaf senescence of Malus hupehensis by long-term melatonin application is associated with its regulation of metabolic status and protein degradation[J]. Journal of Pineal Research, 2013, 55(4): 424-434.
[11] Shi H, Reiter R J, Tan D X, et al. Indole-3-acetic and inducibel 17 positively modulates natural leaf senescence through melatonin-mediated pathway in Arabidoposis [J].Journal of Pineal Research, 2015, 58(1): 26-33.
[12] Morteza S A, Javad R F. Melatonin treatment attenuates postharvest decay and maintains nutritional quality of strawberry fruits (Fragaria × anannasa cv. Selva) by enhancing GABA shunt activity[J]. Food Chemistry, 2017,221(1): 1650-1657.
[13] Gao H, Zhang Z K, Chai H K, et al. Melatonin treatment delays postharvest senescence and regulates reactive oxygen species metabolism in peach fruit[J]. Postharvest Biology and Technology, 2016, 118(1): 103-110.
[14] Ma Q, Zhang T, Zhang P, et al. Melatonin attenuates postharvest physiological deterioration of cassava storage roots[J]. Journal of Pineal Research, 2016, 60(4): 424-434.
[15] 刘红艳,胡花丽,罗淑芬,等. 6-苄氨基嘌呤减缓鲜切西兰花的衰老机理分析[J]. 食品科学,2016,37(24):313-321.Liu Hongyan, Hu Huali, Luo Shufen, et al.6-Benzylaminopurine alleviates the senescence of fresh-cut broccoli through inhibiting the production of ethylene[J].Food Science, 2016, 37(24): 313-321. (in Chinese with English abstract)
[16] Olarte C, Susana S, Echavárri J F, et al. Effect of plastic permeability and exposure to light during storage on the quality of minimally processed broccoli and cauliflower[J].LWT – Food Science and Technology, 2009, 42(1): 402-411.
[17] Pen L, Jiang Y M. Effects of chitosan coating on shelf and quality of fresh-cut Chinese water chestnut[J]. LWT – Food Science and Technology, 2003, 36(3): 359-364.
[18] 纪淑娟,熊振华,程顺昌,等. 1-MCP和CO2自发释放处理对西兰花常温货架期的保鲜作用[J]. 食品与发酵工业,2014,40(2):202-206.Ji Shujuan, Xiong Zhenhua, Cheng Shunchang, et al. Effects of spontaneous release 1-MCP and CO2on the quality of broccolis during shelf life[J]. Food and Fermentation Industries, 2014, 40(2):202-206.
[19] Sun Q Q, Zhang N, Wang J G, et al. Melatonin promotes ripening and improves quality of tomato fruit during postharvest life[J]. Journal of Experimental Botany, 2015,66(3): 657-668.
[20] 赵素平,刘红艳,胡花丽,等. 6-BA处理对采后西兰花呼吸途径及能量水平的影响[J]. 现代食品科技,2017,33(5):1-7.Zhao Suping, Liu Hongyan, Hu Huali, et al. Effect of 6-benzylaminopurine on the respiratory pathway and energy level in postharvest broccoli[J]. Modern Food Science and Technology, 2017, 33(5): 1-7. (in Chinese with English abstract)
[21] Liu D, Xu S, Hu H L, et al. Endogenous hydrogen sulfide homeostasis is responsible for the alleviation of senescence of postharvest daylily flower via increasing antioxidant capacity and maintained energy status[J]. Journal of Agricultural and Food Chemistry, 2017, 65(4): 718-726.
[22] 芦航,高建晓,胡花丽,等. 6-苄氨基嘌呤对采后空心菜品质及其活性氧代谢的影响[J]. 食品科学,2016,37(4):266-271.Lu Hang, Gao Jianxiao, Hu Huali, et al. Effects of 6-benzylaminopurine treatment on postharvest quality and reactive oxygen species metabolism of Ipomoea aquatica[J].Food Science, 2016, 37(4): 266-271. (in Chinese with English abstract)
[23] Patterson B D, Macrae E A, Ferguson I B. Estimation of hydrogen peroxide in plant extracts using titanium(IV)[J].Analytical Biochemistry, 1984, 139(2): 487-492.
[24] 高建晓,王毓宁,李鹏霞,等. 漆蜡涂膜对鲜莲蓬采后褐变的影响[J]. 食品科学,2016,37(18):275-282.Gao Jianxiao, Wang Yuning, Li Pengxia, et al. Effects of lacquer wax coating on postharvest browning of fresh lotus pods[J]. Food Science, 2016, 37(18): 275-282. (in Chinese with English abstract)
[25] Candan N, Tarhan L. Relationship among chlorophyllcarotenoid content, antioxidant enzyme activities lipid peroxidation levels by Mg2+deficiency in the Mentha pulegium leaves[J]. Plant Physiology and Biochemistry, 2003,41(1): 35-40.
[26] Singh S P, Singh Z. Postharvest oxidative behaviour of 1-methylcyclopropene treated Japanese plums (Prunus salicina Lindell) during storage under controlled and modified atmospheres[J]. Postharvest Biology and Technolology, 2012,74(3): 26-35.
[27] 罗广华,王爱国. 植物SOD的凝胶电泳及活性的显示[J].植物生理学通讯,1983(6):44-45.
[28] 陈建勋,王晓峰. 植物生理学实验指导[M]. 广州:华南理工大学出版社, 2006.
[29] Wang H, Qian Z G, Ma S, et al. Energy status of ripening and postharvest senescent fruit of litchi (Litchi chinensis Sonn.)[J]. BMC Plant Biology, 2013, 13(1): 1-16.
[30] 李辉,林毅雄,林河通,等. 1-MCP延缓采后‘油㮈’果实衰老及其与能量代谢的关系[J]. 现代食品科技,2015(4):121-127.Li Hui, Lin Yixiong, Lin Hetong, et al. Delayed senescence in harvested ‘Younai’ plums induced by 1-MCP treatment and its relation to energy metabolism[J]. Modern Food Science and Technology, 2015(4): 121-127. (in Chinese with English abstract)
[31] 王建华,刘鸿先,徐同. 超氧物歧化酶(SOD)在植物逆境和衰老生理中的作用[J]. 植物生理学通讯,1989,1(1):1-7.Wang Jianhua, Liu Hongxian, Xu Tong. The role of superoxide dismutase (SOD) in stress physiology and senescence physiology of plant[J]. Plant Physiology Communications, 1989, 1(1): 1-7. (in Chinese with English abstract)
[32] Lin D, Zhao Y Y. Innovations in the development and application of edible coatings for fresh and minimally processed fruits and vegetables[J]. Comprehensive Reviews in Food Science and Food Safety, 2007, 6(3): 60-75.
[33] Luo Z S, Chen C, Xie J. Effect of salicylic acid treatment on alleviating postharvest chilling injury of ‘Qingnai’ plum fruit[J]. Postharvest Biology and Technology, 2011, 62(2):115-120.
[34] Maxwell D P, Wang Y , Mcintosh L. The alternative oxidase lowers mitochondrial reactive oxygen production in plant cells[J]. Proceedings of the National Academy of Sciences,1999, 96(14): 8271-8276.
[35] 张刚,李里特,丹阳. 果蔬成熟衰老中的活性氧代谢[J]. 食品科学,2004,25(1):225-230.Zhang Gang, Li Lite, Dan Yang. Active oxygen metabolism in ripening and senescence of fruits and vegetables[J]. Food Science, 2004, 25(1): 225-230. (in Chinese with English abstract)
[36] Tian S, Qin G, Li B. Reactive oxygen species involved in regulating fruit senescence and fungal pathogenicity[J]. Plant Molecular Biology, 2013, 82(6): 593-602.
[37] 钟俐,李冠. 白粉病菌胁迫下甜瓜叶片中Ca2+的细胞化学定位及外源Ca2+对POD、CAT和SOD同功酶的影响[J]. 中国农业科学,2012,45(19):4040-4049.Zhong Li, Li Guan. Ultracytochemical localization and effects of calcium on isoenzyme in the leaves of Cucumis melo L. under the stress of powdery mildew[J]. Scientia Agricultura Sinica, 2012, 45(19): 4040-4049. (in Chinese with English abstract)
