mir-375调节notch通路对高氧诱导新生鼠肺上皮细胞凋亡的影响研究
2021-09-09黄润英范智利肖吉群郑巍蔡强
黄润英 范智利 肖吉群 郑巍 蔡强
支气管肺发育不良(bronchopulm onary dysplasi,BPD)是早产儿常见并发症之一,发病机制复杂,其中高氧致肺损伤是主要原因,患儿肺发育不全且长时间处于高氧环境中易出现损伤[1]。而目前大多数学者认为氧化应激是肺损伤的主要原因,而细胞凋亡成为氧化应激引起肺损伤的主要机制之一[2]。微小RNA(microRNA,miRNA)在疾病发生发展中参与氧化应激、炎性反应等过程,其中mir-375与氧化应激关系密切,其水平变化与疾病关系密切[3];在肿瘤疾病中mir-375是凋亡肿瘤细胞衍生出的miRNA,高表达的mir-375可在凋亡过程中以非外泌体形式释放出来,亦是吞噬细胞浸润以及促进肿瘤微环境发展的关键调节剂[4],但在BPD中笔者尚未发现研究。notch通路可决定肺泡上皮细胞的分化方向,参与高氧肺损伤修复过程,是一种保护性应激反应[5]。且mir-375与notch1在细胞增殖、迁移、侵袭、分化中都关系密切[6],但未发现二者在细胞凋亡中的相关研究。本研究构建BPD模型,观察mir-375对BPD大鼠肺上皮细胞凋亡的影响并探讨其机制,为靶位点治疗提供一定的参考。
1 材料与方法
1.1 材料
1.1.1 实验动物:健康SD孕鼠购自北京维通利华实验动物技术有限公司,许可证号:SYXK(京)-2017-0033,清洁级,足月顺产同一批新生SD大鼠作为研究对象,雄雌不限。所有实验经医院动物实验伦理委员会批准。
1.1.2 试剂与仪器:mir-375拮抗剂阴性对照、mir-375拮抗剂均购自广州锐博生物科技有限公司。mir-375、U6引物由上海生工生物工程股份有限公司合成;苏木素-伊红(hematoxylin-easine,HE)染色试剂盒、一步法TUNEL细胞凋亡检测试剂盒(绿色荧光)、丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)试剂盒均购自碧云天生物科技有限公司,货号:C0105、C1088、S0131S、S0060;一抗兔抗notch1、B淋巴细胞瘤-2基因(B-cell lymphoma-2,Bcl2)、Bcl2相关X蛋白(Bcl2 associated X protein,Bax)、GAPDH均购自英国abcam公司,货号:ab52627、ab216985、ab59348、ab181602。氧箱购自美国Shellab公司;实时荧光定量PCR(Quantitative real-time PCR,qRT-PCR)仪购自美国ABI公司,型号:ABI Veriti 96孔;蛋白凝胶成像仪购自上海Tanon公司,型号:Tanon-4800。
1.2 方法
1.2.1 动物造模:参照文献中方法[7]建立BPD模型。将80只出生后3 d大鼠随机分为对照组、模型组、mir-375阴性对照组和mir-375拮抗剂组,每组20只。除对照组外,其他3组置于氧箱中,氧浓度维持在(70±5)%,同时吸收氧箱二氧化碳和水蒸气保持氧箱中压力恒定,对照组置于空气中正常饲养,24 h后mir-375阴性对照组注射2 μl(浓度为0.5 μg/μl)mir-375拮抗剂阴性对照和纳米转染复合物的混合物;mir-375拮抗剂组注射2 μl(浓度为0.5 μg/μl)mir-375拮抗剂和纳米转染复合物的混合物;对照组和模型组注射2 μl无菌0.9%氯化钠溶液,大鼠建模7 d和14 d分别每组取10只进行下列实验。
1.2.2 体重变化:腹腔注射麻醉大鼠称量体重。
1.2.3 qRT-PCR检测大鼠肺组织中mir-375水平:称重结束后立即处死大鼠,打开腹腔,部分肺组织置于4%多聚甲醛中做HE染色和免疫组化实验,部分肺组织置于-80℃冰箱做qRT-PCR和蛋白免疫印迹(western blot,WB)实验。-80℃冰箱取50 mg肺组织,RNA提取试剂盒提取肺组织总RNA,cDNA合成第一条链试剂盒合成cDNA,qRT-PCR仪对mir-375、内参U6扩增。引物序列:mir-375 F:5’-GGGTTTGTTCGTTCGGCTC-3’、R :5’-CAGTGCGTGTAGTGGAG-3’;U6 F:5’-GCTTCGGCAGCACATATACTAAAAT-3’、R:5’-CGCTTCACGAATTTGCGTGTCAT-3’。上样体系20 μl:cDNA 1 μl(50 ng/μl),F/R(10 μm)(0.5/0.5)μl,2×Mix 10 μl,ddH2O 8.0 μl。反应条件:95℃、10 min;95℃、15 s,62℃、60 s,40个循环。2-ΔΔCT法计算肺组织中mir-375表达水平。
1.2.4 HE染色观察肺组织形态学:固定于4%多聚甲醛中的肺组织24 h后经不同浓度乙醇中脱水,二甲苯中透明,石蜡中包埋、冷冻凝固后切片。切片制作完成后经脱蜡、复水、染色,再脱水、透明、封片完成HE染色,光学显微镜拍照。
1.2.5 TUNEL检测肺组织凋亡情况:1.2.4切片按TUNEL细胞凋亡检测试剂盒方法检测凋亡情况,显微镜下TUNEL染色可见凋亡肺泡上皮细胞显示绿色,正常肺泡上皮细胞细胞核DAPI染色显示蓝色,显微镜下观察并计数。TUNEL染色阳性细胞百分比作为凋亡指数=凋亡细胞数/总细胞数×100%。
1.2.6 免疫组化检测大鼠肺组织中notch1表达水平:1.2.4切片并HE染色相同方法脱蜡、复水,滴加过氧化氢灭活内源性过氧化氢酶,热修复抗原并加磷酸缓冲液冲洗,5%脱脂奶粉封闭20 min,滴加一抗notch1(1∶100)(阴性对照用同型同种鼠IgG代替一抗)2 h,滴加二抗20 min后DAB显色,苏木素复染核,盐酸酒精分色,脱水、透明、封片。光学显微镜拍照。Image软件分析肺组织中面积积分光密度值,光密度值越大,则notch1阳性越强。
1.2.7 肺组织中MDA、SOD水平检测:-80℃中取部分肺组织,制备匀浆,硫代巴比妥酸法测定MDA水平、氮蓝四唑光还原法测定SOD水平。
1.2.8 WB检测肺组织Bax、Bcl2蛋白情况:-80℃冰箱取100 mg肺组织,手术剪剪碎后于冰上研磨,每管加1 ml蛋白裂解液冰上裂解30 min,组织匀浆液4℃、10 000 g离心20 min,上清液即为肺组织总蛋白。蛋白定量后经PAGE胶分离、PVDF膜转膜、5%脱脂奶粉室温封闭,对应加入一抗Bax、Bcl2、GADPH,4℃孵育过夜;对应加入二抗,室温孵育1 h。DAB显色试剂显色,蛋白凝胶成像仪拍照和定量分析。

2 结果
2.1 抑制mir-375对大鼠体重的影响 建模7、14 d,与对照组相比,模型组、mir-375阴性对照组体重降低(P<0.05);与模型组、mir-375阴性对照组相比,mir-375拮抗剂组体重升高(P<0.05)。见表1。
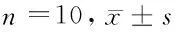
表1 4组大鼠7、14 d体重变化
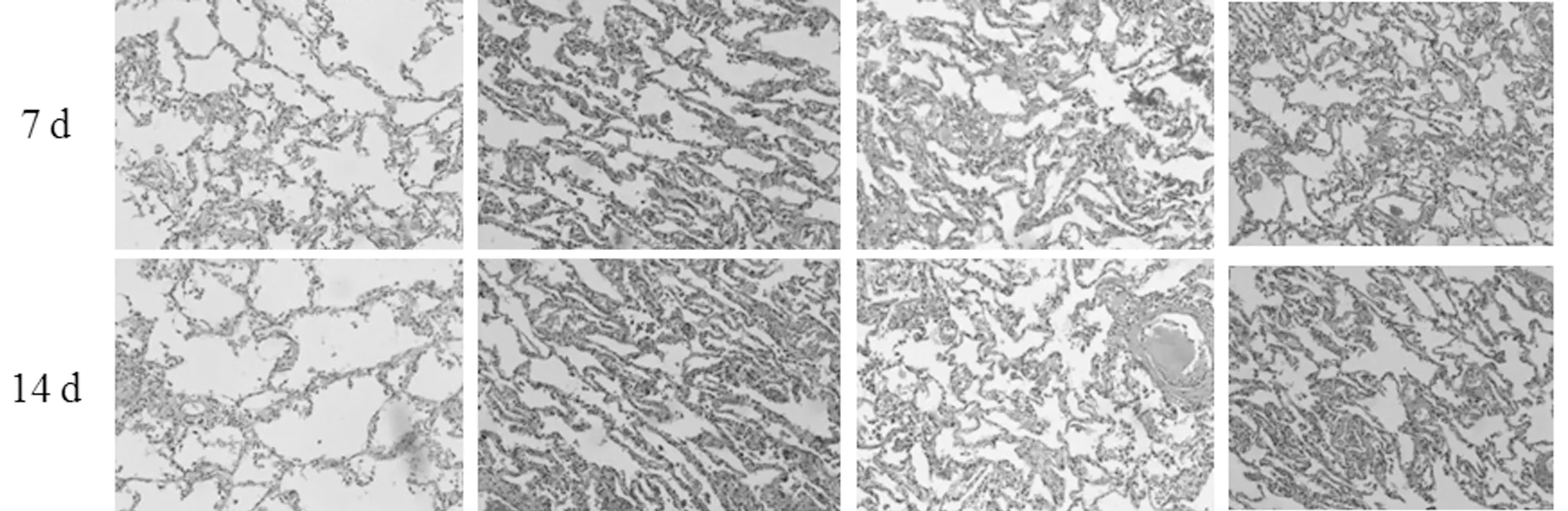
2.2 抑制mir-375对肺组织形态学的影响 建模7、14 d,对照组大鼠肺组织支气管完整且排列整齐,肺泡排列整齐;模型组与mir-375阴性对照组肺组织结构不完整,肺泡数量减少、体积增大,结构简单化;mir-375拮抗剂组肺组织结构有所改善,与模型组相比肺泡数量升高、体积减少。见图1。
2.3 抑制mir-375对肺组织中mir-375的影响 建模7、14 d,与对照组相比,模型组、mir-375阴性对照组肺组织中mir-375水平升高(P<0.05);与模型组、mir-375阴性对照组相比,mir-375拮抗剂组肺组织中mir-375水平降低(P<0.05)。见表2。
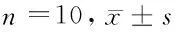
表2 4组大鼠肺组织中mir-375水平比较
2.4 抑制mir-375对肺组织细胞凋亡的影响 建模7、14 d,与对照组相比,模型组、mir-375阴性对照组肺组织肺泡上皮细胞凋亡指数升高(P<0.05);与模型组、mir-375阴性对照组相比,mir-375拮抗剂组肺组织肺泡上皮细胞凋亡指数降低(P<0.05)。见表3,图2。
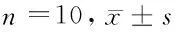
表3 4组大鼠肺组织肺泡上皮细胞凋亡指数比较

2.5 抑制mir-375对肺组织中notch1水平的影响 建模 7、14 d,与对照组相比,模型组、mir-375阴性对照组肺组织中notch1水平降低(P<0.05);与模型组、mir-375阴性对照组相比,mir-375拮抗剂组肺组织中notch1水平升高,差异有统计学意义(P<0.05)。见图3,表4。

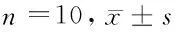
表4 4组大鼠肺组织中notch1染色光密度值比较
2.6 抑制mir-375对肺组织中MDA、SOD水平的影响 建模7、14 d,与对照组相比,模型组、mir-375阴性对照组肺组织中MDA水平升高,SOD水平降低,差异有统计学意义(P<0.05);与模型组、mir-375阴性对照组相比,mir-375拮抗剂组肺组织中MDA水平降低,SOD水平升高,差异有统计学意义(P<0.05)。见表5。
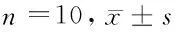
表5 4组大鼠肺组织中MDA、SOD水平比较
2.7 抑制mir-375对肺组织中Bax、Bcl2蛋白的影响 建模(7、14)d,与对照组相比,模型组、mir-375阴性对照组肺组织中Bax水平升高、Bcl2水平降低(P<0.05);分别与模型组、mir-375阴性对照组相比,mir-375拮抗剂组肺组织中Bax水平降低、Bcl2水平升高(P<0.05)。见表6,图4。
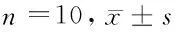
表6 4组大鼠肺组织中Bax、Bcl2蛋白水平比较

图4 4组大鼠肺组织中Bcl2、Bax蛋白表达情况;A 对照组;B 模型组;C mir-375阴性对照组;D mir-375拮抗剂组
3 讨论
早产儿出生时肺发育不成熟,需氧气支持和机械治疗,对氧依赖性强,但长期暴露在高氧环境中极易出现氧化应激现象,导致肺发育迟缓[8]。本研究发现,与对照组相比,模型组体重降低,肺组织结构不完整,肺泡数量减少、体积增大,简单化,提示BPD导致大鼠体重减轻、肺组织破坏。损害肺上皮细胞可增加氧化应激损伤,诱导细胞凋亡,并与肺损伤程度、肺纤维化关系密切[9]。因此,抗氧化应激被认为是目前减少BPD的重要原因,减少氧化应激改善疾病。
miRNA作为真核生物中参与基因转录调控的非编码单链小分子RNA,参与基因转录后的表达,从而参与病理生理过程,在血液循环中可作为生物标志物,应用于各种癌症、自身免疫缺陷疾病等疾病中,疾病发生早期即可检测到,对于预测疾病及对应治疗都存在极大优势[10,11]。mir-375在进化上高度保守,属胰腺转录因子的关键作用靶点,可参与胰腺的发育调控过程,升高mir-375与胰岛β细胞的凋亡相关[12];在Sertoli细胞中mir-375过表达增加活性氧水平并促进细胞凋亡[13];在血管损伤细胞中mir-375过表达可靶向调控导致炎症小体水平下降,导致血管病变基因、细胞粘附因子下降,从而减少细胞凋亡[14]。推测mir-375影响细胞凋亡从而影响疾病,但具体机制尚不清楚。本研究发现,与对照组相比,模型组肺组织中mir-375水平升高,提示BPD中mir-375水平升高与肺结构不完整关系密切。与模型组相比,mir-375拮抗剂组肺组织结构有所改善,肺泡数量升高,提示减少mir-375水平可改善肺组织结构,实现对BPD的保护。
氧化和抗氧化失衡是BPD发病的机制之一,MDA作为常见的细胞氧化损伤指标,反映氧化损伤程度;SOD是机体内抗氧化酶,其清除自由基,反映机体抗氧化应激水平[15]。Bax、Bcl2是目前研究细胞凋亡常用基因,Bcl2包括多个同源物,其蛋白主要调控凋亡途径的阻断,可阻断、抑制细胞凋亡信息传输过程;Bax可拮抗Bcl2,发挥促凋亡作用[16]。本研究发现,与对照组相比,模型组肺组织中MDA、Bax水平升高,Bcl2、SOD水平降低,提示BPD中肺组织氧化损伤严重,抗氧化水平减弱,导致机体氧化应激处于失衡状态,促进凋亡途径,减弱抑制凋亡信号传输过程,细胞凋亡严重,且TUNEL染色中细胞凋亡指数升高可直观观察到BPD肺组织肺上皮细胞凋亡严重。与模型组相比,mir-375拮抗剂组减弱上述情况,可能是降低mir-375水平使氧化应激向正常方向发展,从而减少细胞凋亡,实现对疾病的保护。
Notch通路属进化保守信号通路,可调控细胞增殖、分化、凋亡、侵袭、迁移等过程[17]。notch1在发育不成熟的高氧肺损伤中表达水平显著降低,促进肺的发展、再生和重建,从而对肺组织起保护和修复作用,恢复其正常形态和生理功能[18]。且研究发现notch1在高氧诱导的肺损伤中调控氧化应激从而影响肺损伤[19]。同时发现miRNA调控notch1影响凋亡,mir-34a可调节notch1信号传导参与神经元中的神经元凋亡过程,miRNA-34a抑制剂治疗可降低动作电位的频率,激活notch1信号传导并防止无Mg2+处理的神经元中的神经元凋亡,来抑制癫痫样放电,从而改善认知功能[20]。本研究发现,与对照组相比,模型组肺组织中notch1水平降低,提示在BPD中notch1水平较低,促使肺细胞再生能力较弱,导致疾病加重。与模型组相比,mir-375拮抗剂组肺组织中notch1水平升高,提示BPD中减少mir-375表达可升高肺组织中notch1水平,从而加速肺再生;同时减弱氧化应激损伤,减少肺上皮细胞凋亡,减轻肺组织损伤,实现对疾病的保护。
综上所述,mir-375可调节notch通路从而减缓氧化应激损伤,减轻肺上皮细胞凋亡,实现对BPD肺组织的保护。但mir-375与notch通路之间的调控机制有待进一步研究,是本文接下来研究重点。
