右美托咪定预防颅内动脉瘤栓塞术患者全麻插管交感神经反应及对血清炎性因子水平的影响
2021-09-09张泽郭琼梅周长浩卢学姿刘秀叶
张泽 郭琼梅 周长浩 卢学姿 刘秀叶
颅内动脉瘤发病率高,是导致蛛网膜下腔出血的重要原因。在动脉瘤手术期间,维持血流动力学的稳定是麻醉最基本的要求,以保证基本的脑灌注,避免脑血管痉挛和瘤体破裂等情况的发生。气管插管容易出现血流动力学的波动,血浆儿茶酚胺浓度升高,导致血压突然升高,脑血流增加[1],颅内压升高,甚至引发动脉瘤破裂。另外,在进行动脉瘤栓塞过程中,常常会发生脑血管痉挛,脑组织灌注不足,导致部分脑组织的缺血、缺氧[2],发生脑的缺血再灌注损伤,研究证实,炎性反应在脑缺血再灌注损伤的发生、发展中发挥着重要作用,同时,炎性反应过程中大量炎性因子和细胞趋化因子的释放会加重脑组织的损伤[3]。右美托咪定是一种α2肾上腺激素能受体激动剂,研究表明,在麻醉诱导前静注右美托咪定可有效减少插管操作引起的交感神经兴奋,使插管期间的血流动力学维持在稳定状态[4]。同时有研究表明,一定剂量的右美托咪定能够发挥抑制氧化应激反应和减轻炎性反应的作用,减轻不同组织器官的缺血再灌注损伤[5]。本研究通过观察右美托咪定预防颅内动脉瘤栓塞术患者全麻插管交感神经反应的效果及对血清肿瘤坏死因子-α(TNF-α)、白介素-6(IL-6)水平、神经元特异性烯醇化酶(NSE)和S100β的影响,探讨右美托咪定对颅内动脉瘤栓塞术患者的脑保护作用。
1 资料与方法
1.1 一般资料 选取2018年6月至2019年6月在我院择期全身麻醉下行颅内动脉瘤介入手术的患者80例, 其中男45例,女35例;年龄18~65岁;ASA分级为Ⅰ~Ⅱ级;格拉斯哥昏迷计分(GSC)法评分12~15分。排除术前存在严重心、肺、肝、肾功能疾病及感染、长期服用激素类药物、免疫调节剂和精神类药物的患者。患者采用随机数字表法随机分为对照组(C组)和右美托咪定组(D组),每组40例。2组患者年龄、性别比、GCS评分和手术时间比较差异无统计学意义(P>0.05),具有可比性。见表1。

表1 2组患者基本情况比较
1.2 麻醉方法 患者术前进行常规禁食水。进入手术室后开放上肢外周静脉,监测脉搏血氧饱和度、心电图、无创血压和脑电双频指数(bispectral index,BIS)。给予咪达唑仑镇静,局麻下行桡动脉穿刺连续监测有创动脉压,患者平静休息3 min后的收缩压(systemic blood pressure,SBP)、舒张压(diastolic blood pressure,DBP)、平均动脉压(mean arterial pressure,MAP)和心率(heart rate,HR)为基础值。在麻醉诱导前10 min,D组经静脉输注盐酸右美托咪定(扬子江药业集团有限公司)负荷量1 μg/kg,然后以0.4 μg·kg-1·h-1的速率持续输注至手术结束前30 min,C组采用同样的方法静脉输注等容量的0.9%氯化钠溶液。麻醉诱导:静脉注射舒芬太尼0.5 μg/kg、依托咪酯0.3 mg/kg、罗库溴铵0.6 mg/kg诱导,给药1 min应用可视喉镜行气管插管,固定后连接麻醉机行机械通气,设定呼吸参数潮气量8~10 ml/kg,呼吸频率10~15次/min,维持呼末二氧化碳(PETCO2)在35~40 mm Hg,气道压<40 mm Hg,血氧饱和度>95%。麻醉维持:微量泵静脉输注丙泊酚4~9 mg·kg-1·h-1,盐酸瑞芬太尼0.05~0.2 μg·kg-1·min-1,术中根据手术强弱刺激调整用药剂量,维持BIS值在40~60。手术结束后患者完全清醒拔除气管导管送返病房。诱导期间,如果患者平均动脉压<55 mm Hg,或较基础值下降达>30%,给予麻黄碱升高血压,单次剂量6 mg;若心率<50次/min,给予阿托品提升心率,单次计量0.5 mg。气管内插管均由同一名麻醉医生操作完成;患者的用药及分组情况由其他研究人员实施和完成。
1.3 数据采集和指标检测 记录患者入室平静休息3 min(T1)、气管内插管前即刻(T2)、插管后即刻(T3)、插管后3 min(T4)的有创动脉收缩压、舒张压及心率,将麻醉诱导期间收缩压、舒张压、心率的最大值和最小值的差值定义为波动值。于T1、T2、T3、T4、手术结束时(T5)、术后6 h (T6)、术后24 h (T7)取桡动脉血,采用ELISA法测定T1、T2、T3、T4时血浆中去甲肾上腺素(norepinephrine,NE)水平及T1、T5、T6、T7时血清中TNF-α、IL-6、NSE、S100β水平。

2 结果
2.1 2组患者插管时血流动力学指标比较 与T1时比较,C组T2时收缩压明显降低(P<0.05),T3、T4时收缩压、舒张压和心率明显升高(P< 0.05),D组T2、T4时的收缩压和心率明显降低(P<0.05)。与C组比较,D组患者T3、T4时的收缩压、舒张压及心率均明显降低(P<0.05),收缩压、舒张压和心率的波动值均显著低于C组(P<0.05)。见表2、3。
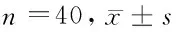
表2 2组患者插管时血流动力学指标比较
2.2 2组患者不同时间点血清TNF-α、IL-6水平比较 与T1时比较,2组T5~7时的血清炎性因子TNF-α和IL-6水平均明显升高(P<0.05),与C组比较,D组T5~7时血清TNF-α和IL-6水平均明显降低(P<0.05)。见表4。
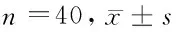
表3 2组患者插管时血流动力学指标波动情况比较
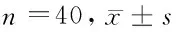
表4 2组患者不同时间点血清TNF-α和IL-6的水平比较
2.3 2组患者不同时间点血浆NE水平比较 与T1时比较,2组T3、T4时血浆NE水平均升高(P<0.05),与C组比较,D组T3、T4时血浆NE水平均降低(P<0.05)。见表5。
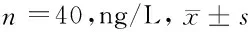
表5 2组患者不同时间点血浆NE水平比较
2.4 2组患者不同时间点血清NSE和S100β水平比较 与T1时比较,2组T5~7时的血清NSE和S100β水平均显著升高(P<0.05),与C组比较,D组T5~7时血清NSE和S100β水平均显著下降(P<0.05)。见表6。
表6 2组患者不同时间点血清NSE和S100β的水平比较
3 讨论
临床麻醉过程中,颅内动脉瘤介入手术既要防止血压突然升高导致动脉瘤破裂,增加颅内出血、颅高压的风险,又要避免血压过低、脑灌注不足导致脑缺血缺氧,加重脑组织损伤[6,7]。通常全麻气管插管时,暴露声门、置入气管导管均会对咽喉部和气管造成强烈的刺激,引起明显的交感神经应激反应,导致血压、心率出现大幅度波动。丙泊酚等静脉麻醉药都有不同程度的扩张血管和抑制心肌收缩的作用,增加丙泊酚或者其他麻醉药的药量有时并不能达到抑制插管反应的效果,反而经常会在插管后出现不同程度的血压下降,导致麻醉诱导期间血压波动较大。因此,对于颅内动脉瘤手术患者,在麻醉诱导期间对气管插管引起的心血管反应进行充分控制以维持血流动力学的稳定,同时需要避免因用药量过大导致的后期循环过度抑制[8]。
右美托咪定是一种高选择性α2肾上腺激素能受体激动剂,其主要作用于脊髓、蓝斑核和外周肾上腺激素能受体,从而起到镇痛、镇静和抑制交感神经反应的效果。有研究表明右美托咪定用于气管插管,可降低气管插管引起的交感神经过度兴奋,维持麻醉诱导期间血流动力学平稳[9]。很多关于右美托咪定减轻插管应激反应的研究,发现右美托咪定抑制交感神经活性,减轻诱导、苏醒期的心血管反应,稳定术中血流动力学变化,主要机制在右美托咪定可通过激动交感神经末梢突触前膜α2 肾上腺素能受体抑制交感神经的活性,从而降低去甲肾上腺素的释放[10,11],血浆中儿茶酚胺水平下降,血压和心率不会出现急剧变化,血流动力学相对稳定[12],另一方面,抑制节后交感神经释放去甲肾上腺素的效能,这与突触后膜肾上腺素能的β2受体被激活后导致交感节后神经细胞膜超极化有关[13]。Cho 等[14]研究显示麻醉诱导时给予右美托咪定,通过提升HR 变异性,有效的调节交感神经和迷走神经张力的均衡性,从而稳定心血管功能。
本研究中,在麻醉诱导期,D组患者预先给予右美托咪定,结果显示,在插管前后舒张压和收缩压波动幅度较对照组明显降低,在插管后血浆中NE水平较对照组降低,获得维持循环和抑制应激反应两方面的平衡。C组插管后患者的舒张压、收缩压、心率和NE明显上升,波动幅度大,插管应激反应明显,证实右美托咪定在麻醉诱导期抑制插管时的交感神经反应,使患者血流动力学更稳定。麻醉诱导前给予一定量的右美托咪定可以抑制插管应激导致的儿茶酚胺大量产生和释放,降低血浆中儿茶酚胺水平,抑制交感神经过度激活引起的心血管反应,有利于麻醉手术平稳进行。但是快速输注盐酸右美托咪定可在一定程度上刺激血管平滑肌上的α1肾上腺激素能受体,引起血管收缩,血压升高,导致心率反射性减慢[15]。本研究中D组在气管插管前后收缩压、舒张压均明显低于C组,而心率下降则更明显,这可能与应用右美托咪定导致反射性心率减慢有关。
在进行动脉瘤栓塞过程中,由于操作刺激等因素常常会发生脑血管痉挛,导致脑组织灌注不足,脑血流恢复后机体中的单核细胞、中性粒细胞、血管内皮细胞等被激活并积聚于损伤部位,释放大量相关炎症细胞因子[16],可影响神经元活动,发生脑缺血再灌注损伤。TNF-α作为最常见的炎性细胞因子,主要由活化的单核巨噬细胞、小胶质细胞、星形胶质细胞等分泌产生[17]。研究表明,大鼠发生局灶脑缺血再灌注的早期,TNF-α水平迅速升高,而静脉给予TNF-α抗体可明显减轻脑组织的再灌注损伤[18]。TNF-α介导脑再灌注损伤的机制可能与以下几方面有关:(1)活化机体的炎性趋化因子,导致白细胞大量积聚,产生“呼吸爆发”。(2)由于脑组织含有大量的磷脂成分,TNF-α可以激活脑内的磷脂酶A2,磷脂酶A2是细胞膜磷脂水解的关键酶,导致神经细胞膜磷脂的水解,造成神经细胞结构的破坏和功能的改变。另外一种炎性细胞因子IL-6可在急性炎症发生时与其受体结合,受体发生二聚化,激活细胞内的酪氨酸激酶信号传导通路,从而调控细胞核内相应基因的转录过程。有文献报道,IL-6 水平与缺血缺氧导致的急性脑损伤程度相关[19]。脑组织发生缺血再灌注后,IL-6在颅内大量合成并释放入血,造成血浆IL-6水平急剧升高,IL-6水平的升高进一步诱导神经细胞的坏死、凋亡。
血清NSE是存在于神经细胞内的一种特异性胞内蛋白,其水平增高程度可直接和有效的反映机体神经元受损情况,并与损失程度呈正相关,可以用于体内神经元损伤程度的监测。S100β主要存在于神经胶质细胞包括星形胶质细胞和少突胶质细胞等细胞中,可在一定程度上反映神经胶质细胞的损伤情况。故血清NSE和S100β为目前临床上评估脑损伤比较具有敏感性的生化学检测指标[20]。
右美托咪定的抗炎作用是通过激活突触后受体抑制交感神经活性,间接提高副交感神经张力,激活胆碱能抗炎通路来发挥作用的。研究证实,右美托咪定可以通过调节免疫细胞功能,改善机体的免疫反应[21,22],减轻炎症和氧化应激反应,减轻器官缺血再灌注损伤。大量研究证实,右美托咪定可以减轻颅脑损伤和神经外科手术时造成的局部脑损伤导致的炎性反应,保护脑功能。本研究结果显示,2组患者术后24 h 内血清TNF-α、IL-6、NSE和S100β水平均较术前明显升高(P<0.05)。说明颅内动脉瘤介入栓塞术患者围术期会发生不同程度的炎性反应和脑损伤。但2组比较,D组各时间点的血清TNF-α和IL-6水平均较C组明显降低(P<0.05)。说明右美托咪定抑制了颅内动脉瘤栓塞术导致的血清炎性因子的产生和释放。D组各时间点的血清NSE和S100β水平均较C组明显降低(P<0.05),说明右美托咪定可以通过降低颅内动脉瘤栓塞术患者术后血清炎性因子的水平减轻脑缺血再灌注损伤,起到脑保护作用。另外右美托咪定可能还可以通过其良好的镇静镇痛作用降低脑氧代谢率,稳定颅内压,减轻脑组织局部应激反应,发挥保护脑功能的作用[23,24]。
综上所述,给予1 μg/kg的右美托咪定负荷量,随后以0.4 μg·kg-1·h-1的速率持续输注,可以预防颅内动脉瘤患者全麻插管时的交感神经反应,使患者血流动力学更稳定,同时可以降低颅内动脉瘤栓塞术患者术后血清炎性因子的水平,减轻脑缺血再灌注损伤,发挥脑保护作用。
