患者参与式饮食干预对老年肺癌化疗患者营养状态和疲乏的改善效果
2021-09-09董琪李金花丁清清
董琪 李金花 丁清清
肺癌5年生存率仅为15%~40%[1]。对于老年患者这一特殊群体,因合并症多,多数患者因无法耐受手术而选择化疗作为首选治疗方法[2]。尽管化疗延长了患者生存时间,但是化疗药物会引起恶心呕吐、食欲减退等消化道症状,导致患者在化疗期间出现营养不良,有些患者甚至因严重营养不良而被迫终止化疗[3]。癌因性疲乏(cancer related fatigue,CRF)是一种与癌症治疗相关的主观症状,不同于普通疲乏,CRF症状更严重,并且在休息状态下也很难缓解,严重影响患者生活质量和治疗信心[4]。研究表明,化疗期间营养状态与CRF高度相关,有效的营养支持能降低患者CRF程度[5]。目前临床上对肺癌化疗患者的营养支持主要以饮食指导为主,未充分考虑患者的依从性,部分患者难以严格遵守医护人员制定的饮食计划。患者参与式饮食干预(patient participation-based dietary intervention,PPDI)是Kim等[6]提出的一种饮食指导方案,其核心是鼓励患者参与,与患者建立合作伙伴关系。研究证实,PPDI能明显改善恶性肿瘤患者营养状况和生活质量[7]。但是国内外存在医疗环境、就医文化等方面的差异,该方法是否适用于中国患者仍需要验证。为此,本研究对老年肺癌患者化疗期间实施基于PPDI的护理干预,观察对患者营养状况和CRF的影响。
1 资料与方法
1.1 一般资料 选取2019年1月至2020年1月在我院住院化疗的非小细胞肺癌患者90例,随机分为试验组和对照组,每组45例。试验组1例失访,1例死亡;对照组1例失访,1例中断治疗;最终试验组43例,对照组43例。试验组:男29例,女14例;年龄65~72岁,平均年龄(68.58±2.15)岁;文化程度:小学11例,初中20例,高中或中专8例,大专及以上4例;家庭人均月收入:<1 000元14例,1 000~3 000元22例,>3000元7例;婚姻状况:已婚40例,未婚3例;肿瘤临床分期:Ⅲ期32例,Ⅳ期11例;病理类型:腺癌28例,鳞癌15例;化疗方案:吉西他滨+顺铂36例,培美曲塞+顺铂7例。对照组:男25例,女18例;年龄65~75岁,平均年龄(68.49±2.75)岁;文化程度:小学15例,初中18例,高中或中专9例,大专及以上1例;家庭人均月收入:<1 000元16例,1 000~3 000元21例,>3 000元6例;婚姻状况:已婚42例,未婚1例;肿瘤临床分期:Ⅲ期34例,Ⅳ期9例;病理类型:腺癌30例,鳞癌13例;化疗方案:吉西他滨+顺铂33例,培美曲塞+顺铂10例。2组患者年龄、性别比、文化程度、经济收入、婚姻状况、临床分期、病理类型、化疗方案等差异均无统计学意义(P>0.05),具有可比性。
1.2 标准
1.2.1 纳入标准:①年龄≥65岁;②化疗时间为4个周期;③听力和语言表达能力正常,有一定阅读理解能力,能够在指导下或独立填写问卷;④小学及以上文化程度;⑤取得患者同意,并签署书面知情同意书。
1.2.2 排除标准:①认知功能障碍或精神障碍性疾病;②有≥2种肿瘤;③远处转移或合并其他严重疾患。
1.2.3 退出标准:中断化疗、化疗期间死亡或失访病例。
1.3 干预方法
1.3.1 对照组:给予常规护理,包括化疗期间进行适当有氧运动(如散步、慢跑、骑自行车、跳绳等);给予患者营养指导,纠正不良饮食习惯,根据患者情况建议进食高热量、高蛋白易消化食物等;发放科室自行编制的化疗期知识健康教育手册,及时处理化疗期出现的不良反应,告知患者有问题时可随时咨询管床医生或责任护士。
1.3.2 试验组:在常规护理基础上实施PPDI干预。
1.3.2.1 成立研究小组:由1名研究负责人、3名肿瘤专科护士(>10年临床护理经验,护师以上职称)、1名肿瘤科副主任、1名营养师组成干预小组。
1.3.2.2 制定方案:研究负责人查阅文献,同时结合国内肺癌化疗患者饮食要求,设计干预方案初稿,内容涉及化疗期间饮食指导、饮食相关症状及处理措施。初稿由肿瘤护理专家、肿瘤临床医生、营养师进行审阅、修改。根据专家建议,在初稿中补充了症状管理、用药指导、等值食物交换表等内容。选择符合纳入标准的10例患者进行预实验,收集患者意见。根据反馈意见,将部分医学专用术语转化为通俗语言,便于患者阅读和理解,最终形成PPDI管理手册,内容涵盖饮食指导、饮食相关症状及处理、症状管理、用药指导、膳食营养信息和等值食物交换表等。
1.3.2.3 实施干预:按照Wilson[8]提出的“CANCER”原则(访谈、评估、营养计划、并发症、再次评估、确认),由肿瘤专科护士对患者实施干预。本研究共干预5次,干预方式为面对面访谈,具体内容:①第1次:入院时,与患者深度访谈,时长30~50 min,地点在医生办公室。向患者发放自行编制的饮食管理手册,根据患者身体状况提供饮食建议。通过提问方式了解患者饮食习惯和食物偏好,并评估其营养状况。与营养师、患者共同制定饮食计划。向患者说明饮食计划与疾病预后密切相关,增强患者对饮食计划的依从性。发放“3日饮食日记”,要求患者每日记录进食时间、食物种类、摄入量、烹饪方法等,若加餐则备注说明。连续记录3 d,3 d后回收,根据填写情况评价患者对饮食计划的配合程度,并将此作为后续患者自我饮食管理的手段。②第2~3次,分别于化疗第1、2个周期进行1次访谈,每次时间约为60 min,地点在科室会议室。向患者反馈前1次营养评估结果,与患者一起探讨饮食计划的执行情况。检查患者“3日饮食日记”,若填写不完整或未能遵守饮食计划,与患者一起分析原因,并作为下阶段的干预重点。了解患者有无饮食相关症状,根据症状进行指导。如出现恶心呕吐等症状、遵医嘱肌内注射甲氧氯普胺注射液或静脉推注托烷司琼。若出现厌食症状,指导患者少食多餐,进食高蛋白、高热量或清淡食物,避免食用高脂肪或甜食等延长饱腹感的食物,必要时遵医嘱给予醋酸甲地孕酮片改善食欲。③第4~5次,于化疗第3、4周再次进行深度访谈,谈话时间20~30 min,地点在医生办公室。了解患者对饮食计划的遵守情况,再次评估患者营养状况,并据此适当调整饮食计划。鼓励患者继续严格遵守饮食计划,增强患者信心。
1.4 评价指标
1.4.1 营养状况:包括客观营养指标和主观营养指标。①客观营养指标:主要为体格检查指标,采用数字身高体重测量仪测量患者体重、身高,计算体重指数(body mass index,BMI),BMI=体重(kg)÷身高2(m2);测量患者上臂肌围(AMC)和肱三头肌皮肤褶皱厚度(TSF),TSF:上臂自然下垂,沿着皮褶方向,用拇指、食指和中指将被测部皮肤、皮下组织提起,用皮褶计量器测量上臂中围上方约2 cm处皮褶厚度,精确至0.1 mm。重复测量3次,取平均值;AMC:上臂中围(cm)-0.314×TSF(mm)。②主观指标:采用患者整体营养主观评估量表(patient-generated subjective global assessment,PG-SGA)[9]。PG-SGA由两部分组成:患者自评表和医务人员评估表,其中患者自评表包括近期内体重变化、膳食摄入、功能/活动和症状体征等4项,4项得分之和记为A;医务人员评估表包括疾病年龄、代谢应激状态、体格检查,得分分别计为B、C、D,总分为A、B、C、D得分相加,总分范围0~35分,得分越高代表营养状态越差。
1.4.2 疲乏:采用癌症疲乏量表(cancer fatigue scale,CFS)[10]。本研究采用张凤玲等[11]的中文版CRF,该量表包括躯体疲乏(7个条目)、情感疲乏(4个条目)、认知疲乏(4个条目)等3个维度,共计15个条目,每个条目按照Likert 5级评分法,从“无疲乏”到“严重疲乏”分别计分0~4分,总分范围0~60分,得分越高代表疲乏症状越严重。
1.5 质量控制 正式试验前,由研究负责人对3名肿瘤专科护士进行为期1周培训,培训结束后进行考核,考核成绩≥85分(满分100分)方可参加试验。经过培训的肿瘤专科护士对患者进行一对一访谈,使用统一指导语。研究负责人每周检查患者“3日饮食日记”,与护士、患者一起参与饮食计划,确保护理措施的落实。分别于患者入院时和化疗后,由专科护士发放调查问卷,向患者说明填写方法和注意事项,问卷填写完毕当场回收。2次共发放176份问卷(化疗前90份、化疗后86份),有效回收176份,回收率100%。

2 结果
2.1 2组患者营养状况比较 入院时,2组患者各营养指标差异无统计学意义(P>0.05);化疗后,2组患者PG-SGA得分明显增加,同时试验组BMI、AMC明显低于对照组,PG-SGA得分明显低于对照组,差异有统计学意义(P<0.05)。见表1。
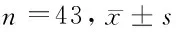
表1 2组患者营养状况比较
2.2 2组患者疲乏程度比较 入院时,2组患者CRF量表各维度得分及总分差异无统计学意义(P>0.05);化疗后,试验组情感疲乏得分和疲乏总分明显低于干预前,且试验组躯体疲乏、情感疲乏、认知疲乏和疲乏总分明显低于对照组,差异有统计学意义(P<0.05)。见表2。

表2 2组患者CRF量表得分比较 n=43,分,
3 讨论
3.1 患者参与式饮食干预可提高老年肺癌化疗患者营养状态 调查显示,癌症患者营养不良发生率为40%~60%,其中老年患者营养不良风险更高[12]。谢琰等[13]采用营养风险筛查表2002(NRS-2002)对老年非小细胞肺癌患者化疗期间营养状态进行评估,结果发现患者在化疗前营养不良占10.4%,化疗第1个周期上升至27.8%,化疗第4个周期营养风险或营养不良已高达61.7%。说明老年肺癌化疗患者营养风险较高,需要采取针对性营养支持直至化疗结束。本研究结果显示化疗后试验组BMI、AMC明显高于对照组,PG-SGA得分明显低于对照组,表明患者参与式饮食干预可改善患者化疗期间营养状态。可能原因与患者参与式饮食干预纠正了以往不良饮食习惯,提高了患者遵医行为和饮食依从性有关。本研究以“CANCER”原则为指导,鼓励患者参与到化疗期间的饮食管理,通过发放饮食管理手册,让患者掌握相关饮食知识,增强其行为自信;再加上“3日饮食日记”,评估患者饮食计划依从情况;对不遵守饮食计划的患者,与其一起分析原因,适时调整计划,使其更符合患者的需求。汪丹丹等[14]对胃癌术后患者采用了患者参与式饮食管理,证实患者饮食依从性明显提高,饮食相关症状明显减少,与本研究结果一致。但是本研究中试验组和对照组患者TSF差异无统计学意义,可能因为营养状态改善是个循序渐进的过程,饮食管理对TSF等脂肪含量指标的影响仍需要长期随访证实。
3.2 患者参与式饮食干预可缓解老年肺癌化疗患者疲乏程度 化疗药物在杀灭肿瘤细胞的同时,也会对正常细胞造成损伤,因而患者会感到严重疲乏。调查显示,50%~90%的癌症患者在化疗期间持续存在疲乏症状,30%癌症患者在完成化疗1年后仍有一定程度疲劳[15]。研究表明,肺癌患者化疗期间营养状态与CRF呈显著正相关,改善营养状态在缓解CRF中起重要作用[16]。本研究显示,试验组化疗后情感疲乏、认知疲乏和疲乏总分明显低于对照组,表明患者参与式饮食干预可有效缓解老年肺癌患者化疗期疲乏程度。可能与以下原因有关:(1)患者参与式饮食干预纠正了患者低蛋白血症、贫血等,提高了营养状态,从而缓解了躯体疲乏。(2)营养支持加速机体的新陈代谢,降低了细胞外5-羟色胺的浓度,而5-羟色胺被认为是在认知功能中起重要作用的神经递质[17],这可能与缓解认知疲乏有关。(3)在患者参与式饮食干预中,除了医务人员详尽解答患者疑问,给予心理支持外;还鼓励家属与患者一起进食,让家属督促患者执行饮食计划,通过社会和家庭支持,缓解了患者情感疲乏。另外,疲乏本身属于一种心身症状,在患者参与饮食管理过程中,积极地讨论、深刻地分析均会对患者思维、感觉产生积极刺激,通过感受器转化为神经冲动映射到中枢神经系统,中枢在神经冲动的刺激下进行调节,能产生愉快感觉,消除不良情绪[18]。
综上所述,患者参与式饮食干预能有效改善老年肺癌化疗患者营养状态,缓解疲乏症状;但随访时间短,长期干预效果需要观察。
