NMDA受体功能降低而非增强参与皮质酮诱发的海马长时程增强减弱
2021-09-07周文霞
于 琪,黄 晏,周文霞
(1.烟台大学药学院,山东 烟台 264005;2.军事科学院军事医学研究院毒物药物研究所,抗毒药物与毒理学国家重点实验室,北京 100850)
应激是指机体受到内外环境因素刺激时表现出的非特异性、全身性的神经内分泌反应。应激时,下丘脑-垂体-肾上腺系统被激活,大量分泌肾上腺皮质激素[1],在啮齿类动物中以皮质酮(corticos⁃terone,CORT)为主。有研究表明,糖皮质激素是介导应激致神经系统功能损伤的重要因素。在细胞水平,糖皮质激素不但可通过影响细胞新陈代谢等途径直接损伤海马神经元,还可加剧谷氨酸和缺氧等对海马神经元的毒性作用[2-3]。在动物水平,糖皮质激素可诱导突触可塑性和认知功能(记忆的获取、巩固和提取)损伤[4]。临床研究表明,糖皮质激素水平过度增高与认知功能障碍密切相关[5]。目前认为,糖皮质激素可通过直接诱导神经元损伤[2]、降低脑源性神经营养因子表达和蛋白质翻译[3,6]及兴奋性损伤[7]等途径损伤神经系统的功能。其中,谷氨酸诱导的兴奋性毒性被认为是糖皮质激素损害神经系统的重要途径之一。
谷氨酸是中枢神经系统主要的兴奋性神经递质,N-甲基-D-天冬氨酸(N-methyl-D-aspartic acid,NMDA)受体是其发挥作用的重要受体之一。NMDA受体是一种离子型的谷氨酸受体,通常由2个1型亚基(GluN1)和2个2型亚基(GluN2)组成的异构体复合物,其中GluN2A和GluN2B是中枢神经系统中最丰富的GluN2亚单位。通常认为,GluN2A主要分布在突触内,介导突触传递和细胞生存;GluN2B主要分布在突触外,介导兴奋性毒性和细胞凋亡[8-9]。同时,NMDA受体也是介导兴奋性毒性的重要途径之一[10]。研究表明,糖皮质激素可通过促进突触前谷氨酸释放和抑制谷氨酸重摄取使细胞外谷氨酸水平升高,进而过度激活NMDA受体,使细胞内Ca2+浓度升高,最终导致神经系统功能 损伤[4,7,11-13]。 因 此 ,很多 研究 期 望 通 过调 节NMDA受体来改善应激致神经系统功能损伤,但到底应拮抗还是增强NMDA受体功能,尚存在争议。一些研究表明,抑制NMDA受体功能对应激致神经系统功能损伤有改善作用,如NMDA受体拮抗剂美金刚ip给药14 d可显著改善应激致大鼠记忆损伤[14]。相反,另一些研究则表明,增强NMDA受体功能可改善应激致神经系统功能损伤,如NMDA受体共激活剂(coactivator)D-丝氨酸(D-serine,D-Ser)可改善应激致认知功能障碍[15-16]。此外,还有研究提示,NMDA受体拮抗剂可通过间接增强谷氨酸能神经元兴奋性来改善应激致认知功能障碍[17]。由此可见,应激致突触可塑性和认知功能损伤时,NMDA受体功能是过度激活还是抑制,目前尚不清楚。因此,阐明NMDA受体功能是过度激活还是抑制,对应激所致突触可塑性和认知功能损伤防治策略的确定和药物研发均具有重要意义。
突触可塑性是学习和记忆的重要生理学基础,长时程增强(long-term potentiation,LTP)是突触可塑性的主要功能指标之一[14],常用于学习记忆相关机制的研究中[18]。CORT致LTP减弱也常用于应激致突触可塑性和学习记忆损伤机制的研究[19-20]。本研究以LTP为指标,在小鼠离体海马脑片上观察多种NMDA受体抑制剂或激动剂对CORT致突触可塑性损伤的影响,以期明确皮质酮致LTP减弱时NMDA受体功能是过度激活还是抑制。
1 材料与方法
1.1 动物、药品和仪器
C57BL/6J小鼠,雄性,体重19~21 g,SPF级,购自斯贝福生物有限公司,许可证号:SCXK(京)2016-0002。所有动物在标准实验室条件下(12 h/12 h光暗循环,温度22~26℃,空气湿度55%~60%)适应1周后用于实验。动物饲养和所有实验方案均严格遵守军事科学院军事医学研究院实验动物伦理委员会的相关规定。
NMDA受体拮抗剂D-AP5、GluN2A拮抗剂TCN-201、GluN2B拮抗剂Ro25-6981、NMDA受体共激活剂 D-Ser、NaCl、KCl、CaCl2、MgSO4、NaH2PO4、NaHCO3、D-葡萄糖(D-glucose,D-Glu)、CORT、DMSO和其他化学试剂均购自美国Sigma公司。
pH计,北京屹源电子仪器科技公司;磁力搅拌机,上海南汇电讯器材厂;恒温水浴锅,北京长安科学仪器厂;万分之一分析天平(Sartorious-110S),美国Sartorious公司;纯水仪(Millinois-Q Biocel),德国Millipore公司;振动切片机(DTK-1000),日本DOSAKA公司;平面微电极阵列记录系统(MED64)和MED Probe(P1515A),日本Alpha MED Scientific公司;温度控制器,美国Automate公司;蠕动泵,河北保定兰格公司;正置显微镜,广州明美科技有限公司;Slice anchor(SHD-22CKIT),美国Warner公司。
1.2 工具药配制
称取适量D-AP5溶于DMSO,然后用人工脑脊液(artificial cerebrospinal fluid,ACSF)(mmol·L-1:NaCl,124;KCl,5;CaCl2,2.5;MgSO4,1.3;NaH2PO4,1.2;NaHCO3,26;D-Glu,10)[9]稀释为 10,25 和100 μmol·L-1,DMSO终浓度≤0.1%。同样方法配制CORT 1 μmol·L-1,TCN-201 1,3和6 μmol·L-1,Ro25-6981 0.25,0.5和1 μmol·L-1及D-Ser 10 μmol·L-1[21]。
1.3 海马脑片制备[22]
小鼠用异氟烷麻醉后断头取脑,剥离海马,使用振动切片机(切片速度0.2 mm·s-1,振动频率80 Hz)将海马切成厚度为300 μm的脑片,并移至预通氧(95% O2,5% CO2)1 h的ACSF 中,孵育(31~32℃)1.5 h后用于LTP实验。
1.4 小鼠海马脑片LTP记录和分析[22]
本研究使用MED64 Mobius软件对LTP进行记录和分析。药物采用循环灌流方式施加于脑片,蠕动泵速度控制在1.0~2.0 mL·min-1。实验时,将脑片置于微阵列电极中,使海马CA3-CA1区域与电极区域重合,选择0.033 Hz单脉冲刺激作为基础突触传递的刺激强度,选取位于Schaffer侧枝的电极作为刺激电极,并选择可在0.033 Hz单脉冲刺激下诱发平滑稳定的场兴奋性突触后电位(field excit⁃atory postsynaptic potential,fEPSP)波形的通道为记录电极,刺激电极和记录电极间距150~300 μm(图1A),记录fEPSP。通过观察input-output曲线将刺激电流调整至可诱发最大fEPSP斜率1/3~1/2的强度,待fEPSP稳定后开始记录15 min fEPSP斜率,取其均值作为fEPSP斜率基础值,而后施加高频刺激(high-frequency stimulation,HFS;100 Hz,100串)诱发LTP,并继续记录fEPSP斜率60 min(图1B),以HFS后fEPSP斜率与基础fEPSP斜率比值的百分数表示LTP。本研究中选取诱发LTP后第30~60分钟的LTP增幅进行统计学分析。
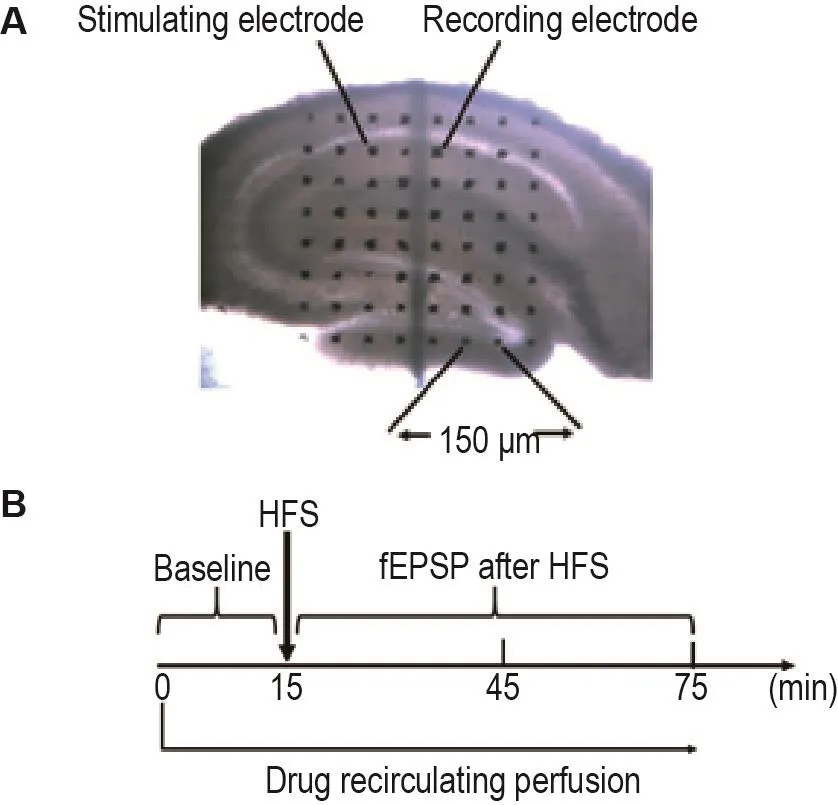
Fig.1 Diagram of relative position of hippocampal slices(A)and electrodes and experimental flow chart(B).The distance between the stimulation electrode and the recording electrode was 150-300 μm.High-frequency stimula⁃tion(HFS,100 Hz,100 trains)was used to induce long-term potenti⁃ation(LTP)in Schaffer-CA1 pathway of the dorsal hippocampal slices.Corticosterone(CORT)1 μmol· L-1,CORT 1 μmol· L-1+D-AP5 10 μmol· L-1,CORT 1 μmol· L-1+TCN-201 1 μmol· L-1,CORT 1 μmo·L-1+Ro25-6981 0.25 μmol·L-1,CORT 1 μmol·L-1+D-serine(D-Ser)10 μmol·L-1were applied by recirculating perfu⁃sion(75 min).The 15-min field excitatory postsynaptic potential(fEPSP)slope was recorded and the average value was taken as the basic fEPSP slope value,and then HFS was used to induce LTP.The ratio of fEPSP slope after HFS and basic fEPSP slope was used to indicate LTP.The average ratio durning 30-60 min after HFS was used for statistical analysis.ACSF:artificial cere⁃brospinal fluid.
1.5 不同浓度NMDA受体拮抗剂对LTP的影响
将小鼠海马脑片分为正常对照组和药物处理组(n=5),分别用ACSF或含D-AP5 10,25和100 μmol·L-1、TCN-201 1,3 和 6 μmol·L-1及Ro25-6981 0.25,0.5和1 μmol·L-1的ACSF全程(75 min)循环灌流。海马脑片LTP的记录和分析同1.4。
1.6 NMDA受体拮抗剂和共激活剂对CORT致LTP减弱的影响
小鼠海马脑片分为正常对照组、CORT 1 μmol·L-1组、CORT 1 μmol·L-1+D-AP5 10 μmol·L-1组、CORT 1 μmol·L-1+TCN-201 1 μmol·L-1组、CORT 1 μmol·L-1+Ro25-6981 0.25 μmol·L-1组和 CORT 1 μmol·L-1+D-Ser 10 μmol·L-1组(n=5),分别用ACSF或含不同药物的ACSF全程(75 min)循环灌流。海马脑片LTP的记录和分析同1.4。
1.7 统计学分析
2 结果
2.1 NMDA受体亚型非选择性拮抗剂D-AP5对CORT致LTP减弱的影响
D-AP5对正常LTP的影响如图2A所示,与正常对照组相比,D-AP5 10 μmol·L-1对 fEPSP 斜率的增幅无显著影响,D-AP5 25和100 μmol·L-1可显著降低fEPSP斜率的增幅(P<0.01)。后续实验选择对正常LTP无明显影响的浓度(即10 μmol·L-1)观察D-AP5对CORT致LTP减弱的影响。
CORT 1 μmol·L-1对基础fEPSP斜率无明显影响(图2B);HFS刺激后,正常对照组fEPSP斜率上升至(166±12)%,成功诱发 LTP;而 CORT 1 μmol·L-1组fEPSP斜率仅上升至(129±14)%,显著低于正常对照组(P<0.01)(图2C和2D),提示CORT 1 μmol·L-1在不影响基础传递的条件下显著减弱LTP。与CORT组相比,CORT+D-AP5组的fEPSP斜率增幅仅有(112.9±1.6)%,提示D-AP5 10 μmol·L-1对 CORT 致 LTP 减弱无改善作用(图2C和2D)。
2.2 NMDA受体亚型选择性拮抗剂TCN-201和Ro25-6981对CORT致LTP减弱的作用
随着浓度的增加,GluN2A拮抗剂TCN-201(图3A)和GluN2B拮抗剂Ro25-6981(图4A)均可显著降低fEPSP斜率的增幅。后续实验选择对正常LTP无明显影响的浓度(即 TCN-201 1 μmol·L-1和Ro25-6981 0.25 μmol·L-1)观察其对CORT致 LTP减弱的作用。
与CORT组相比,CORT+TCN-201 1 μmol·L-1组的fEPSP斜率增幅仅有(117±7)%,提示GluN2A拮抗剂对CORT致EPSP斜率增幅的降低无改善作用(图3B和3C);CORT+Ro25-6981 0.25 μmol·L-1组的fEPSP斜率增幅仅有(115.1±2.4)%,提示GluN2B拮抗剂对CORT致fEPSP斜率增幅的降低无改善作用(图4B和4C)。以上结果表明,NMDA受体亚型选择性拮抗剂对CORT致LTP减弱无改善作用。
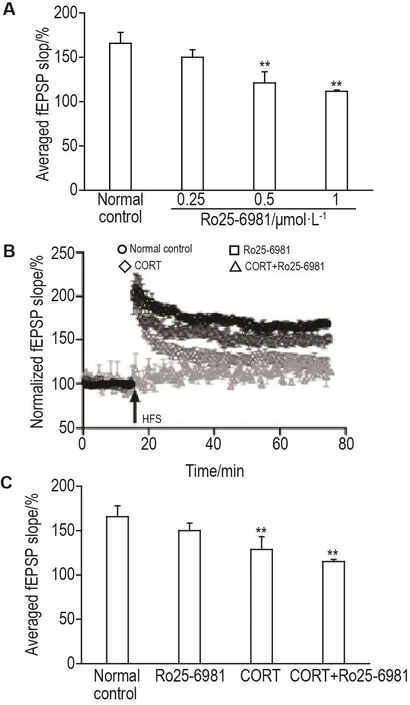
Fig.4 Effect of Ro25-6981 on CORT-induced LTP impair⁃ment.A:effect of Ro25-6981 on LTP.Hippocampal slices were recirculating perfused by ACSF with Ro25-6981 0.25,0.5 and 1 μmol· L-1for 75 min.B and C:effect of Ro25-6981 on CORT-induced LTP.See Fig.1 for the treatment,C was the quantitative analysis result of B.±s,n=5(from 3-4 mice).**P<0.01,compared with normal control group.
2.3 NMDA受体共激活剂对CORT致LTP减弱的作用
与CORT组相比,CORT+D-Ser组fEPSP斜率增幅上升至(161±11)%,即 D-Ser可显著改善CORT导致的fEPSP斜率增幅降低(P<0.01)(图5),提示增强NMDA受体功能可改善CORT致LTP减弱。
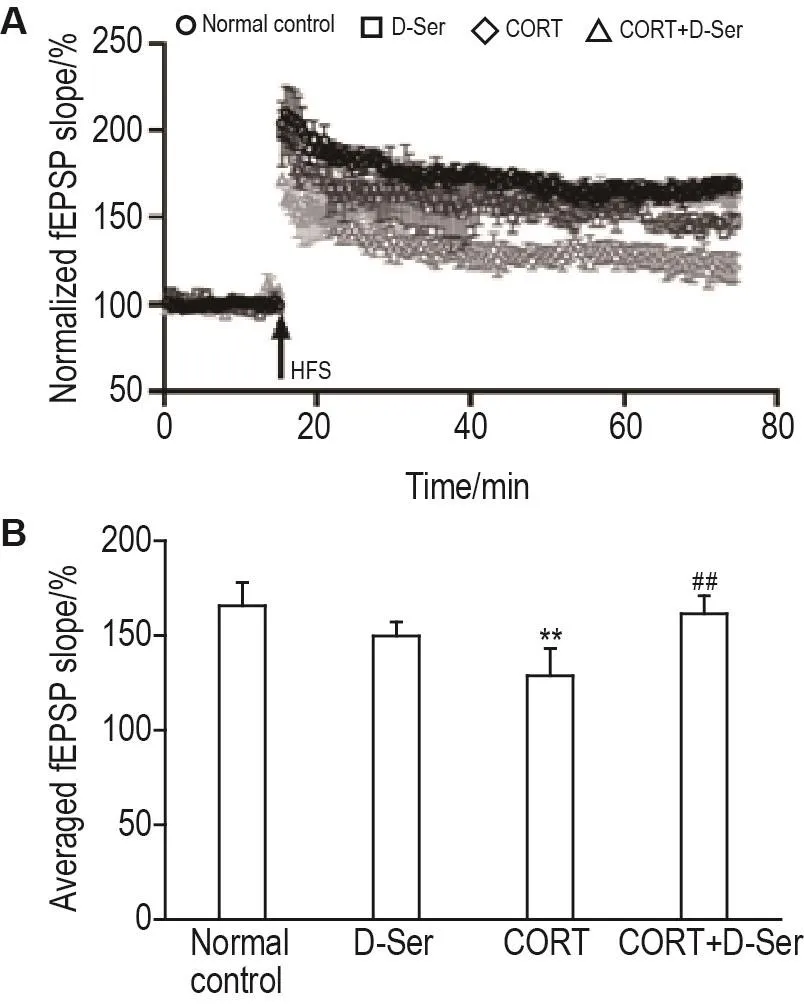
Fig.5 Effect of D-Ser on CORT-induced LTP impair⁃ment.See Fig.1 for the treatment.B was the quantitative analysis result of A.±s,n=5(from 3-4 mice).**P<0.01,compared with normal control group.
3 讨论
本研究首先观察 CORT 1 μmol·L-1对基础突触传递和LTP的影响,然后观察了NMDA受体亚型非选择性拮抗剂D-AP5、GluN2A选择性拮抗剂TCN-201、GluN2B选择性拮抗剂Ro25-6981和NMDA受体共激活剂D-Ser对CORT致LTP减弱的作用。结果表明,CORT 1 μmol·L-1可在不影响基础突触传递的条件下显著损伤海马LTP,与文献[19-20]报道一致。提示CORT 1 μmol·L-1诱导的LTP减弱并非抑制基础突触传递过程,而是干扰LTP的诱导所导致。
在海马中,LTP的诱导主要由NMDA受体介导[23-24]。为明确抑制NMDA受体功能对CORT致LTP减弱的影响,本研究选择D-AP5在对LTP无明显影响的浓度下观察其抑制NMDA受体功能对CORT致LTP减弱的影响。结果表明,D-AP5对CORT致LTP减弱无改善作用,提示CORT致LTP减弱时,NMDA受体可能并未过度激活。有研究表明,糖皮质激素不仅通过激活GluN2A增强NMDA诱发的神经毒性[25],而且可激活GluN2B,损害记忆检索功能[7],提示应激可能通过激活NMDA受体不同亚型介导突触可塑性损伤。因此,本研究选择TCN-201和Ro25-6981,在对LTP无明显影响的浓度下,观察特异性拮抗GluN2A或GluN2B对CORT致LTP减弱的影响。结果发现,GluN2A拮抗剂和GluN2B拮抗剂均对CORT致LTP减弱的无改善作用。可见,不论是NMDA受体亚型非选择性还是亚型选择性拮抗剂均对CORT致LTP减弱无改善作用。因此,有理由推测,CORT致突触可塑性损伤时,NMDA受体功能可能并非过度激活,而是降低。本研究进一步观察NMDA受体共激活剂D-Ser对CORT致LTP减弱的影响,以验证此推测。
D-Ser由L-Ser经丝氨酸消旋酶催化而成,与NMDA受体的甘氨酸位点结合发挥作用[26]。有文献报道,NMDA受体甘氨酸位点激动剂D-Ser可用于抑郁、焦虑等精神疾病的辅助治疗[15]。本研究结果表明,D-Ser显著改善CORT致LTP减弱,即增强NMDA受体功能可改善应激致LTP减弱,提示NMDA受体功能是降低而非增强参与CORT致LTP减弱。
文献报道,NMDA受体拮抗剂美金刚和氯胺酮可以改善应激小鼠的LTP减弱[14,27],提示在动物水平中抑制NMDA受体功能可改善应激致LTP减弱。但本研究在离体脑片中得到的结果却提示,激动NMDA受体才能改善CORT致LTP减弱,与文献报道存在矛盾。有文献报道,在整体动物水平,NMDA受体拮抗剂通过抑制GABA能神经元中间NMDA受体的表达和影响NMDA受体介导的自发兴奋性传递发挥抗应激作用[28-29]。如氯胺酮可优先抑制GABA能中间神经元NMDA受体的表达,导致内侧前额叶皮质锥体细胞的去抑制和兴奋性谷氨酸能神经传递的增强来治疗大鼠慢性社会挫败应激致突触可塑性损伤[17,30];D-AP5和MK-801等可阻断NMDA受体介导的静息神经传递,从而抑制蛋白质合成,导致大鼠海马CA1区突触传递增强[31-32]。这些报道表明,间接增加谷氨酸能神经元的兴奋性是NMDA受体拮抗剂在整体动物水平发挥抗应激作用的重要途径之一,与本研究通过直接增强NMDA受体功能来改善CORT致LTP减弱的结果一致,均提示谷氨酸能神经元突触传递功能降低是CORT致突触可塑性损伤的重要因素。
目前,NMDA受体过度激活所致的兴奋性损伤被认为是应激致认知功能损伤的主要因素之一。但本研究结果表明,NMDA受体功能降低是参与CORT致LTP减弱的重要因素之一,提示增强NMDA受体功能可能是改善应激致认知功能损伤的良好策略,为进一步研究应激致认知功能障碍的机制和相关药物研发提供了新的思路。
