白桦脂酸对异氟醚诱导的发育期大鼠神经细胞损伤的保护作用
2021-09-07王东伟刘海萍王庆东刘思洋胡玉红臧荣佳
王东伟,刘海萍,王庆东,赫 赤,刘思洋,胡玉红,陈 萍,臧荣佳
(佳木斯大学附属第一医院1.麻醉科,2.妇产科,黑龙江 佳木斯 154002)
异氟醚(isoflurane,Iso)是一种临床常用的吸入性全身麻醉药,其可诱导新生动物的大脑神经细胞出现凋亡,严重者可能影响脑功能[1],且该影响可长期存在,导致神经突触数量减少甚至消失,引起永久脑损伤,可表现为新生大鼠发育成熟后行为功能障碍[2]。白桦脂酸(betulinic acid,BC)是五环羽扇烷型三萜化合物。Ma等[3]研究认为,BC能通过血红素氧合酶1/核因子E2相关因子2/NF-κB信号通路抑制糖尿病模型小鼠的认知障碍。Jiao等[4]研究显示,BC能抑制脑缺血缺氧诱发的小鼠海马神经损伤,具有神经保护作用。本研究以发育期大鼠为研究对象,探讨BC对Iso诱导的发育期神经损伤的保护作用,为临床寻找能够有效减轻或消除Iso导致的发育期神经损伤的药物提供实验依据。
1 材料与方法
1.1 药品、试剂和主要仪器
Iso(江苏恒瑞医药有限公司,批号:20172831);BC(中国科学院成都生物研究所,批号:18032423);活性氧(reactive oxygen species,ROS)检测试剂盒和丙二醛(malondialdehyde,MDA)检测试剂盒(上海亨代劳生物科技公司);线粒体膜电位(mito⁃chondrial membrane potential,MMP)检测试剂盒和Ca2+荧光探针检测试剂盒(BestBios生物科技有限公司);Annexin Ⅴ-Biotin,Annexin Ⅴ-FITC和Annexin Ⅴ-PE(美国BD公司)。Fabius麻醉机(德国Drager公司);流式细胞仪(美国Beckman公司);荧光酶标仪(芬兰Thereto实验仪器公司);麻醉箱(上海玉研科学仪器公司);MindrayT8监护仪(深圳迈瑞公司);Morris水迷宫实验系统(美国National Instruments公司);血气分析仪(普朗公司);分光光度计(V-1000,翔艺仪器上海有限公司)。
1.2 实验动物、分组和样本制备
7日龄SPF级SD大鼠80只,雌雄各半,体重17~20 g,佳木斯大学基础医学院动物中心提供,生产许可证号:SYXK(黑)2016-014。幼鼠在通风良好、室温20~24℃和湿度50%~60%的环境饲养于清洁笼具中,12 h昼夜交替光照。自由进食、进水。
大鼠随机分为4组:正常对照组、Iso组和Iso+BC 100和200 mg·kg-1组,每组20只,雌雄各半。除正常对照组外,其余各组大鼠置恒温水槽上的麻醉箱内吸入1.5% Iso 6 h进行全身麻醉[5],麻醉箱内温度37~38℃。Iso麻醉前1 h,正常对照组和Iso组ip给予0.9%生理盐水,Iso+BC组分别ip给予BC 100或200 mg·kg-1预处理。处置完毕后对大鼠进行血气分析,然后每组随机取10只大鼠立即处死,每只大鼠取部分海马组织,剪碎后用胰蛋白酶消化,并用200目孔径尼龙网过滤,450×g离心5 min,弃上清,加PBS重悬后反复柔和吹打,制备成1×108L-1的单细胞悬液,用于检测细胞凋亡率、ROS、MMP和神经细胞内游离Ca2+浓度。取部分海马组织剪碎,按质量比1∶9加入预冷的生理盐水,用匀浆器制成匀浆,626×g,4℃离心15 min,取上清,-20℃保存用于检测MDA含量。余下10只返回饲养笼中喂养至6周后进行Morris水迷宫实验。
1.3 流式细胞术检测大鼠海马神经细胞凋亡率
取1.2制备的大鼠海马单细胞悬液,按照试剂盒说明操作,向细胞悬液中加入5 μL Annexin Ⅴ-FITC标记抗体,室温避光孵育20 min,再加入5 μL 0.1 g·L-1的PI细胞核染料混匀,室温避光孵育10 min,用流式细胞仪分析细胞凋亡。
1.4 DCFH-DA探针检测大鼠海马神经细胞ROS水平
按照试剂盒说明书进行操作,取1.2制备的大鼠海马单细胞悬液,加DCFH-DA(终浓度10 μmol·L-1)37℃孵育30 min后,用PBS洗涤2次,用荧光酶标仪(激发波长488 nm,发射波长525 nm)测读,以相对荧光单位(relative fluorescence unit,RFU)反映细胞内ROS水平。
1.5 硫代巴比妥酸缩合法检测大鼠海马组织MDA含量
按照试剂盒说明书进行操作,取1.2制备的海马组织匀浆,加3 mL 20%三氯乙酸,再加入1 mL 0.67%硫代巴比妥酸,用旋涡混合器混匀30 s,95℃水浴40 min,取出后流水冷却,800×g离心10 min,取上清液,用分光光度计在波长532 nm处测定吸光度值,以反映MDA含量。
1.6 Fluo-3/AM探针检测大鼠海马神经细胞内Ca2+浓度
按照试剂盒说明书进行操作,取1.2制备的大鼠海马单细胞悬液,加入Fluo-3/AM探针工作液,在37℃细胞培养箱中避光孵育20 min。加入5倍体积的含有1%胎牛血清的Hanks平衡盐溶液(Hanks balanced salt solution,HBSS),继续孵育40 min。用HBSS洗涤细胞2~3次后重悬细胞,37℃细胞培养箱中孵育10 min,用荧光酶标仪(激发波长488 nm,发射波长526 nm)测读,以RFU反映细胞内Ca2+浓度。
1.7 JC-1法检测大鼠海马神经细胞MMP
取1.2制备的大鼠海马单细胞悬液,按照试剂盒操作说明加入 JC-1染色液 10 μmol·L-1,37℃孵育 30 min,626×g,4℃离心 3~4 min,弃上清,用JC-1染色液洗涤2次后重悬细胞,在荧光显微镜下观察JC-1单体(激发波长488 nm,发射波长530 nm,绿色)及JC-1聚合物(激发波长525 nm,发射波长590 nm,红色)的荧光图像。用荧光酶标仪检测荧光强度值(fluorescence intensity,FI),用FI绿/FI红表示MMP水平(△ψm)。
1.8 Morris水迷宫实验检测大鼠学习记忆能力
经1.2处理的另10只大鼠返回饲养笼中继续饲养至6周后进行Morris水迷宫实验[6]。Morris水迷宫模型由圆柱型水池和可移动位置的平台2部分组成。水池高60 cm,直径120 cm,平台(直径10 cm)淹没固定在水池的4个象限之一。连续4 d,每天4次将大鼠从水池边放入水中进行训练。观察大鼠在水中找到平台并爬上平台的时间,记为逃避潜伏期。如果在120 s内不能找到平台,则人为将其引导到平台,停留10 s,并将逃避潜伏期记为120 s;当大鼠自行到达平台时,可被允许在上面休息30 s。记录第4天4次训练的平均逃避潜伏期。第5天,去除平台后进行空间探索实验,记录120 s内大鼠穿过原平台位置的次数和在原平台象限的探索时间。实验数据由计算机软件自动记录。
1.9 统计学分析
2 结果
2.1 BC对Iso暴露大鼠血气指标的影响
血气分析结果(表1)显示,与正常对照组比较,各组大鼠血液pH值、pO2和pCO2均无统计学差异。
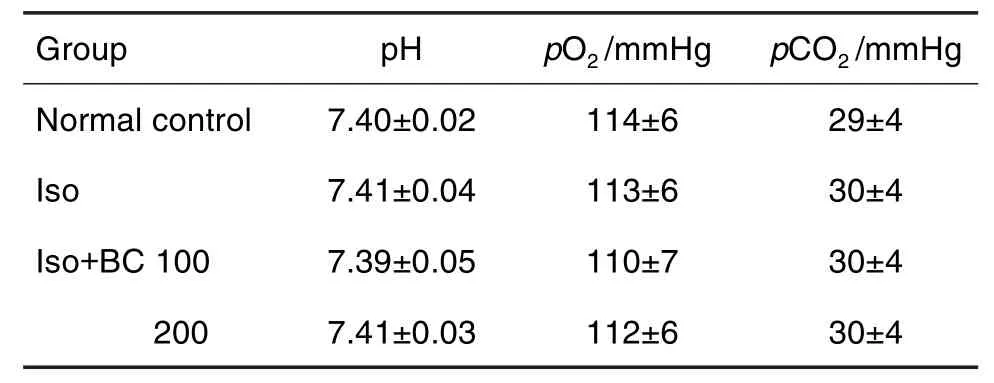
Tab.1 Effect of betulinc acid(BC)on arterial blood gas indexes in isoflurane(Iso)exposure rats
2.2 BC对Iso暴露大鼠海马神经细胞凋亡的影响
Iso组大鼠海马神经细胞凋亡率显著高于正常对照组(P<0.01),Iso+BC 100和200 mg·kg-1组海马神经细胞凋亡率低于Iso组(P<0.05),Iso+BC 200 mg·kg-1组大鼠海马神经细胞凋亡率低于Iso+BC 100 mg·kg-1组(P<0.05)(图1)。
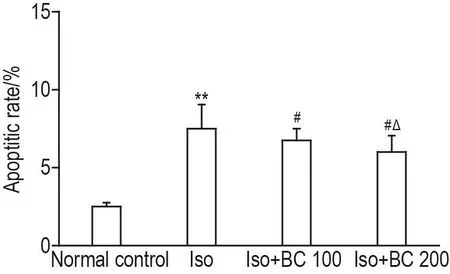
Fig.1 Effect of BC on hippocampal neuron apoptosis of Iso exposure rats.See Tab.1 for the rat treatment.±s,n=10.**P<0.01,compared with normal control group;#P<0.05,compared with Iso group;△P<0.05,compared with Iso+BC 100 mg·kg-1group.
2.3 BC对Iso暴露大鼠海马神经细胞ROS水平和MDA含量的影响
Iso组大鼠海马组织中MDA含量和海马神经细胞内ROS的水平明显高于正常对照组(P<0.01);与Iso组相比,Iso+BC 100和200 mg·kg-1组大鼠海马组织中MDA含量及海马神经细胞内ROS水平明显减少(P<0.05),且Iso+BC 200 mg·kg-1组对ROS的抑制作用强于Iso+BC 100 mg·kg-1组(P<0.05)(图2)。
2.4 BC对Iso暴露大鼠海马神经细胞Ca2+浓度和MMP的影响
实验结果如图3所示,Iso组大鼠海马神经细胞内游离Ca2+浓度明显高于正常对照组(P<0.01),Iso+BC 100和200 mg·kg-1组大鼠海马神经细胞内游离Ca2+浓度较Iso组减少(P<0.05),Iso+BC 200 mg·kg-1组低于Iso+BC 100 mg·kg-1组(P<0.05)(图3A)。与正常对照组相比,Iso组大鼠海马神经细胞MMP明显降低(P<0.05),Iso+BC 100和200 mg·kg-1组大鼠海马神经细胞MMP明显高于Iso组(P<0.05),且Iso+BC 200 mg·kg-1组高于Iso+BC 100 mg·kg-1组(P<0.05)(图3B)。
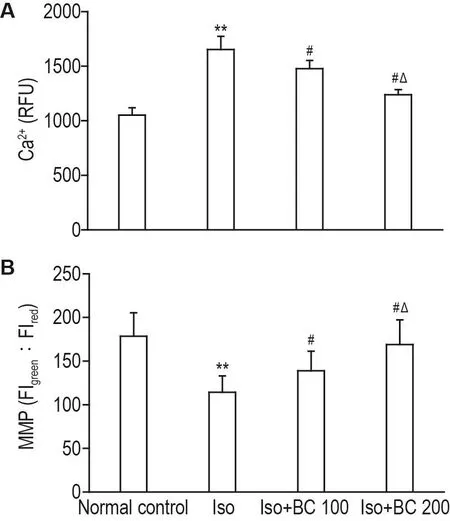
Fig.3 Effect of BC on Ca2+concentration(A)and mito⁃chondrial membrane potential(MMP,B) in hippo⁃campal neurons of Iso exposuer rats.See Tab.1 for the rat treatment.FI:fluorescence intensity.±s,n=10.**P<0.01,compared with normal control group;#P<0.05,compare with Iso group;△P<0.05,compared with Iso+BC 100 mg·kg-1group.
2.5 BC对Iso暴露大鼠学习记忆的影响
与正常对照组相比,Iso组大鼠训练第4天逃避潜伏期明显延长(P<0.01),穿越平台次数明显减少(P<0.01),平台探索时间明显缩短(P<0.01);与Iso组相比,Iso+BC 100和200 mg·kg-1组大鼠训练第4天逃避潜伏期均明显缩短(P<0.05),穿越平台次数明显增加(P<0.05),平台探索时间明显延长(P<0.05);Iso+BC 100 mg·kg-1组与Iso+BC 200 mg·kg-1组间上述指标未见明显差异(图4)。
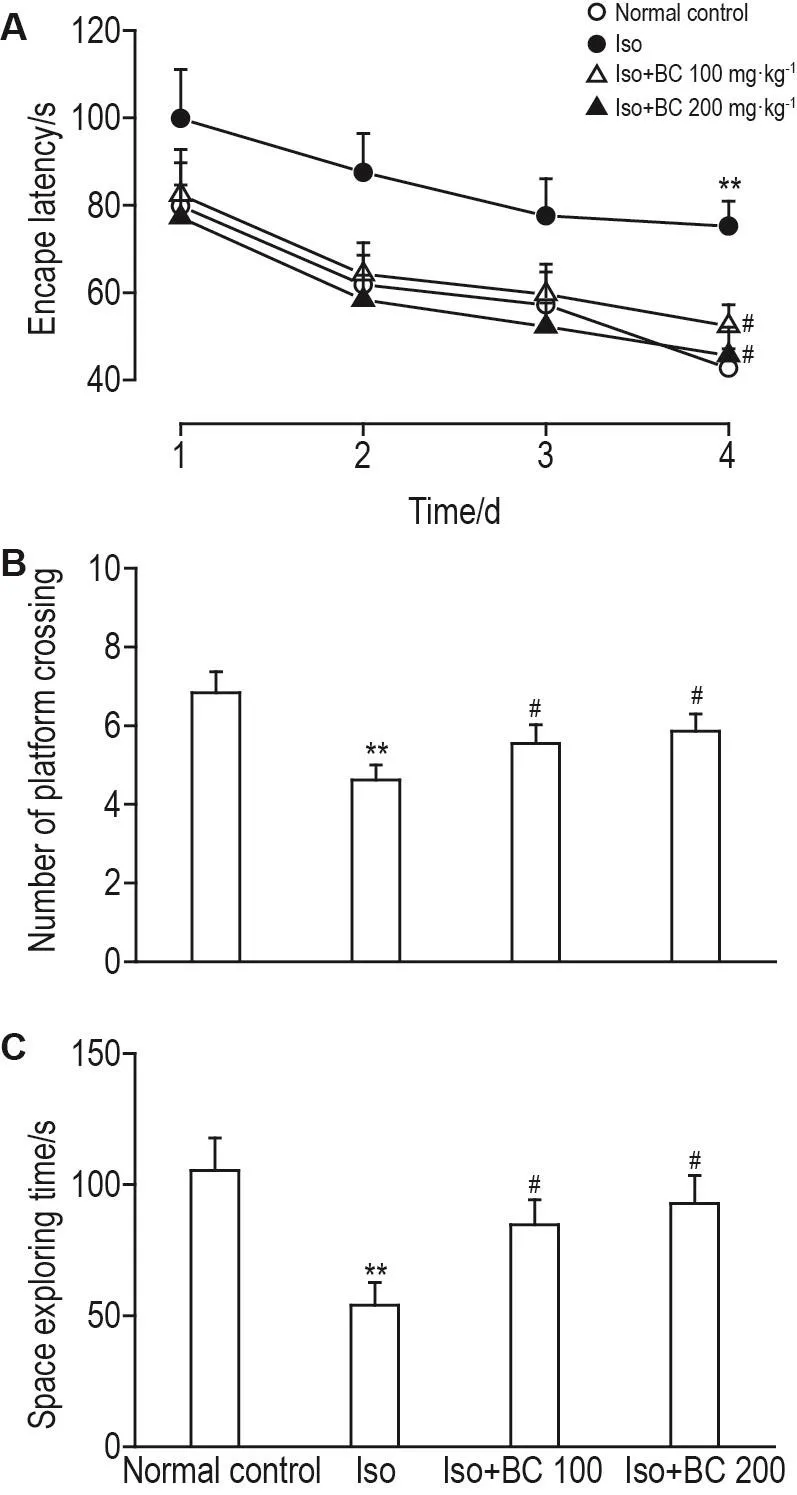
Fig.4 Effect of BC on learning and memory behavior in Morris water maze test in Iso exposure rats.See Tab.1 for the rat treatment.±s,n=10.**P<0.01,compared with normal control group;#P<0.05,compared with Iso group.
3 讨论
大量研究表明,Iso易导致神经损伤或认知障碍[7],但影响神经系统的机制尚不明确。本研究结果显示,Iso暴露可引起大鼠海马组织中MDA和神经细胞中ROS水平明显升高,胞内钙超载和神经细胞MMP明显降低,进而促进大鼠海马神经细胞凋亡;而BC预处理能改善Iso暴露诱导的发育期大鼠海马神经细胞氧化损伤,稳定MMP,进而减少大鼠海马神经细胞凋亡。Zhao等[8]报道,Iso可增加海马神经细胞内Ca2+浓度,诱导神经毒性。细胞内Ca2+升高是细胞损伤的较早期事件,Iso通过下调N-甲基-D-天冬氨酸受体或过度激活γ-氨基丁酸受体可能导致Ca2+过多进入,引起线粒体超载,线粒体膜电位去极化,胱天蛋白酶激活,导致神经细胞凋亡[9]。研究表明,氧化应激与脑神经损伤密切相关[10],过量的ROS可以引起细胞内Bax/Bcl-2比例失调,激活胱天蛋白酶3,引起细胞凋亡[11]。Iso引起的细胞内ROS蓄积是其产生神经毒性的原因之一。
本研究应用Morris水迷宫实验检测Iso暴露及BC干预对发育期大鼠远期学习记忆能力的影响。据文献报道,性激素水平影响大鼠水迷宫实验反应性和敏感性[12]。本研究选择雌雄各半大鼠,以排除激素水平对实验结果的影响。结果发现,与正常对照组比较,Iso组大鼠潜伏期明显延长,穿越平台次数和平台象限探索时间明显减少,表明Iso暴露可损伤发育期大鼠远期学习记忆能力,该结果与Jevtovic-Todorovic 等[13]和 Stratmann 等[14]的研究结果一致。本研究同时发现,Iso暴露前给予BC 100和200 mg·kg-1可使大鼠潜伏期明显缩短,穿越平台次数明显增多,表明BC对Iso暴露诱导的发育期大鼠神经细胞毒性具有保护作用,能有效改善Iso暴露诱导的发育期大鼠空间记忆功能障碍。
本研究结果表明,BC在受试剂量下对Iso暴露诱导的发育期大鼠神经细胞毒性有保护作用,但其在其他给药时间、给药途径及剂量下的作用有待进一步系统研究。
综上所述,BC对Iso诱导的发育期大鼠海马神经细胞损伤具有保护作用,表现为BC预处理能够抑制Iso暴露诱导的发育期大鼠海马神经细胞凋亡和氧化损伤,并能够改善Iso暴露诱导的发育期大鼠学习记忆功能障碍。
