不同时间点的氧糖剥夺对器官型海马脑片的影响
2016-08-08南丽红何一博福建中医药大学药学院福建福州350122
杨 澜,南丽红,何一博,郭 斌,李 煌,黄 枚(福建中医药大学药学院,福建 福州 350122)
不同时间点的氧糖剥夺对器官型海马脑片的影响
杨澜,南丽红,何一博,郭斌,李煌,黄枚
(福建中医药大学药学院,福建 福州 350122)
目的观察不同时长的氧糖剥夺对SD乳鼠器官型海马脑片的影响,探讨制备氧糖剥夺(OGD)模型的最佳时长。方法对海马脑片进行碘化丙啶染色,用微量酶标法检测培养液上清中LDH的释放量。结果培养13 d后的脑片逐渐变薄,海马结构逐渐清晰,生长情况逐渐稳定,无特异性荧光信号,LDH释放各组无明显差异性;与造模前24 h相比,随着缺氧缺糖时间的增加,海马脑片碘化丙啶染色的荧光信号强度与LDH释放量增加,以45、60 m in时长最为明显(P<0.05或P<0.01),但氧糖剥夺60 m in脑片的损伤更为严重,表现出无法恢复的趋势。结论制备SD乳鼠海马脑片氧糖剥夺模型的最佳时长为45min。
海马脑片;氧糖剥夺;碘化丙啶;乳酸脱氢酶;OGD时间点
脑卒中是一种急性脑血管疾病,因其发病突然、治疗时间窗狭窄的特点,导致病后致残率高[1]。器官型脑片培养是一种新兴的脑组织体外培养技术,兼备在体实验的部分特点和离体实验的优点,正成为脑卒中后康复研究的常用模型[2]。海马对缺血缺氧较为敏感[3],因此,器官型海马脑片被广泛应用于缺血缺氧损伤相关机制的研究。我们拟在建立器官型海马脑片制备和培养方法的基础上,探讨不同时长的氧糖剥夺(Oxygen-Glucose Deprivation,OGD)对器官型海马脑片的影响,为进一步研究药物对脑卒中后的康复治疗作用提供实验依据[4-6]。
1 实验材料
1.1动物清洁级P7-9 SD乳鼠由福建中医药大学实验动物中心提供,许可证号:SCXK(闽)2012-0001。
1.2试剂MEM培养基 (美国Hyclone公司);Hank's平衡盐溶液(美国Hyclone公司);细胞培养用青链霉素(美国Hyclone公司,批号:J130071);马血清 (美国Gibco公司,批号:1296647);D-(+)-Glucose(美国 Sigma公司,批号:071M01452V);Hepes(美国Sigma公司,批号:SLBK4575V);碘化丙啶(美国Sigma公司,批号:MKBP1360V);乳酸脱氢酶试剂盒 (南京建成生物工程研究所,批号:20140929)。
1.3实验仪器Millicell-CM插入式细胞培养皿(美国Millipore公司);5 000mz型振动切片机(英国Campden Instruments公司);Forma 371型CO2培养箱(美国Thermo Scientific公司);Galaxy CO170R型三气培养箱 (美国NBS公司);DM IL LED型倒置相差显微镜 (德国Leica公司);EVOSFL型倒置荧光显微镜 (美国AMG公司);SZ760型体视显微镜(重庆奥特光学仪器有限公司)。
2 实验方法
2.1脑片制备及培养制备方法参考Stoppini方法[7]加以改进。P7-9乳鼠以75%乙醇浸泡消毒后,断头取脑,置于预冷的解剖液中,切除小脑、脑干部分,将大脑部分沿矢状面对半切开,将裸露的脑半球冠状平面粘附固定于振动切片机载物台上。用振动切片机沿冠状平面切下400μm的脑片若干,转移至盛有预冷解剖液的培养皿中,在体式显微镜下分离出海马组织,转移至Millicell-CM微孔膜上,每个微孔膜插件放置6个海马脑片,将插件置于6孔培养板中,从孔边缘加入1mL培养液。培养液成分:25%HBSS+50%MEM+25%Horse+6.5 g/L DGlucose+25 mM HEPES,pH 7.2~7.4,培养液含双抗100 U/mL。将6孔培养板置于95%O2、5%CO2、37℃的CO2培养箱中培养,2 d后更换培养液,之后每3天更换1次培养液。
2.2脑片生长形态观察脑片培养期间,使用倒置相差显微镜对脑片生长形态进行动态观察,并于培养至第1、5、9、13天时拍照。
2.3分组及OGD损伤模型的建立培养14 d的海马脑片,分为空白对照组、OGD 15 min组、OGD 30 min组、OGD 45 min组、OGD 60 min组,每组3孔,每孔3片脑片。OGD各组脑片用PBS漂洗3遍,每孔加入1 m L PBS,移入94%N2、5%CO2、1%O2、37℃的三气培养箱孵育15、30、45、60 min后,吸弃无糖培养液PBS,更换为正常培养液1 mL,重新移入95%O2、5%CO237℃的CO2培养箱中培养。空白对照组不作任何处理。
2.4PI染色于造模前24 h、造模后1、3、5 d进行PI染色。具体方法:每孔加入含50μg/mL PI染液的培养液1 mL,于95%O2、5%CO2、37℃的CO2培养箱中孵育1 h后,于倒置荧光显微镜下观察染色情况。
2.5LDH检测于造模前24 h、造模后1、3、5 d吸取海马脑片培养液,离心取上清,根据试剂盒说明书,用微量酶标法测定脑片培养液上清中的LDH含量。
3 结果
3.1脑片生长形态培养1 d的脑片厚度迅速增加,随着培养时间的增加,脑片逐渐变薄,由边缘向中心逐渐变得透亮,组织边缘界线逐渐模糊,观察到有细胞向周围浸润生长,海马结构逐渐变得清晰可见,培养至13 d脑片生长情况逐渐稳定,见图1。
3.2PI染色情况PI染色结果显示,空白对照组海马脑片各时间点均无特异性荧光信号;OGD 15 min组缺氧缺糖1 d后仅可见极微弱荧光信号,3 d后荧光信号消失;OGD 30 min组缺氧缺糖1 d后出现弱荧光信号,3 d荧光信号有所增强,之后荧光信号逐渐减弱,提示脑组织可能在轻微损伤后启动自我修复机制完成自我修复;OGD 45 min组缺氧缺糖1 d后出现强荧光信号,3 d荧光信号明显增强,之后荧光强度维持在相对稳定水平;OGD 60 min组缺氧缺糖后出现极强荧光信号,海马区域全部红染,3 d后荧光信号强度未见明显减弱。
3.3培养液LDH含量检测各组海马脑片缺氧缺糖前培养液LDH释放量无明显差异(P>0.05),缺氧缺糖后1 d,OGD 15 min、30 min组的LDH释放量虽较空白对照组有所增高,但无统计学意义(P>0.05);OGD 45 min组、60 min组的LDH释放量明显高于空白对照组(P<0.05或P<0.01)。在缺氧缺糖后3、5 d各组的LDH释放量较1 d有所减少,与空白对照组相比,OGD 15 min、30 min组的LDH释放量无显著性差异 (P>0.05);OGD 45 min组、60 min组的LDH释放量明显高于空白对照组(P<0.05或P<0.01),见表1、图2。
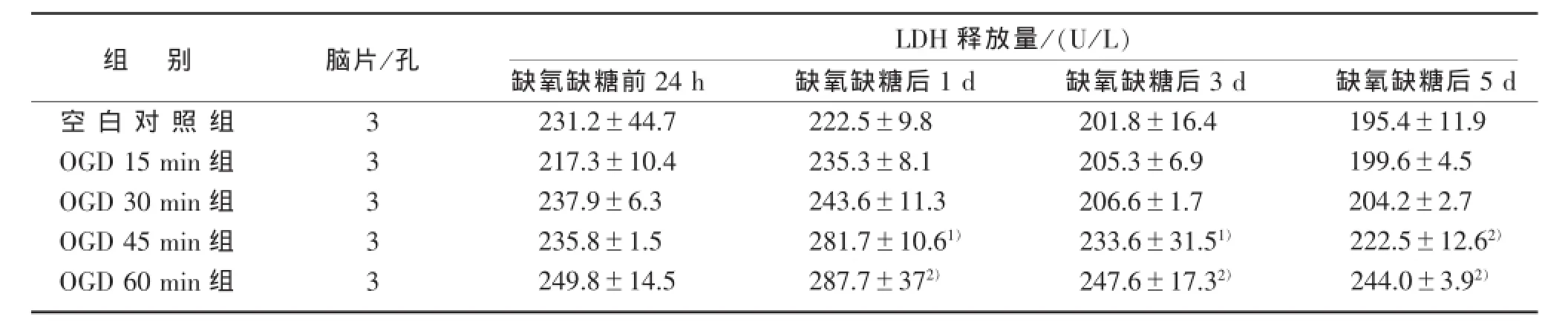
表1 不同OGD时长对LDH释放量的影响
4 讨论
4.1对脑片施加OGD处理,可以模拟脑卒中后脑组织周围缺氧缺糖的微环境。海马是与哺乳动物学习和记忆相关的关键结构,对缺血损伤较为敏感,因此海马脑片尤其适用于缺血性脑损伤的研究[8]。
4.2本实验通过对脑片生长状态的动态观察,发现培养1 d脑片厚度迅速增加,出现水肿现象,小胶质细胞大量生成,倒置相差显微镜下透光性变差。随着培养时间的增长,脑片逐渐变薄,透光性渐佳,由边缘向中心逐渐变得透亮,组织边缘界线逐渐模糊,小胶质细胞数量逐渐减少,海马结构逐渐变得清晰可见,可见清晰的CA1、CA3区域及齿状回结构。培养13 d脑片生长情况逐渐稳定,可用于后续OGD实验。国内外报道的OGD诱导的海马脑片缺氧缺糖损伤模型主要有浸没法、充N2法及三气培养箱缺氧法等,造模时长的选择更是不尽相同。本课题组在脑片培养技术成熟的基础上对造模时长进行相关探索,实验采用PI染色荧光和LDH累积释放量作为观察和检测指标,以评价不同造模时长对OGD诱导的海马脑片缺氧缺糖损伤模型的影响。PI是一种细胞核染色试剂,其无法穿过完整的细胞膜,但可穿过凋亡或坏死细胞的破损细胞膜与DNA双链结合产生红色荧光[9]。LDH广泛存在于机体的细胞中,其渗出是细胞受损的标志,检测LDH的累积释放量可反应脑片的存活状态[10]。研究表明,脑片的PI荧光信号强度和LDH释放量具有相关性[11]。
本实验PI荧光染色结果显示,造模前各组均无红色荧光信号,造模后1 d除OGD 15 min组外,其它组均出现强度不一的荧光信号,且随着造模时间的增长,荧光强度逐渐增强,说明缺氧缺糖已造成脑片的损伤。造模后3 d,除OGD 15 min组外,其它组荧光信号均有所增强,推测此现象为迟发性的细胞凋亡或坏死,可能由于海马脑片无法准确地复制在体脑缺血的神经死亡的时间模式,因此于缺氧缺糖后2~4 d在CA1区出现了损伤的加剧。造模后 5 d,OGD 30 min组的荧光信号趋于消失,OGD 45 min组荧光信号稍有减弱,但仍较为稳定,而OGD 60 min组红色荧光发散,背景红染,提示损伤进一步加剧。LDH释放量检测结果显示,造模前各组LDH累积释放量无显著差异,造模后1 d各OGD组LDH释放量均有不同程度的增加,且与造模时间的延长呈正相关,其中OGD 45 min组、OGD 60 min组LDH释放量明显高于空白组。此后各组仍维持相应趋势,且能持续一定时间。
4.3实验结果表明,在本实验条件下,缺氧缺糖15、30 min不是制备OGD海马脑片模型的最佳时长,最佳时长应为45 min以上。在本实验中我们还观察到缺氧缺糖60 min的海马脑片损伤程度较缺氧缺糖45 min的损伤更为严重,表现出无法恢复的趋势。所以,我们认为器官型海马脑片的OGD诱导时长以45 min为宜,此模型可用于后续的脑卒中康复治疗药物的筛选及作用机制研究。
[1]陶静,柳维林,黄佳,等.基于Notch1信号通路观察电针对脑缺血再灌注损伤大鼠缺血周边皮质与SVZ区神经干细胞增殖的影响[J].康复学报,2015,25(3):23-34.
[2]ULLRICH C,DASCHIL N,HUMPEL C.Organotypic vibrosections:Novel whole sagittal brain cultures[J].Journal of Neuroscience Methods,Elsevier B.V.,2011,201(1):131-141.
[3]林羽,徐伟,张玉琴,等.栝楼桂枝颗粒抗缺血性脑卒中大鼠神经元及原代海马神经元凋亡研究[J].康复学报,2015,25 (1):38-43.
[4]陈立典,励建安.发展中的中国康复医学[J].康复学报,2015,25(1):2-5.
[5]李宏玉,朱路文,唐强,等.早期介入功能性电刺激对脑梗死足下垂患者下肢运动功能的影响[J].康复学报,2015,25(1):6-9.
[6]谢鸿宇,吴毅.丰富环境对脑缺血损伤后功能代偿性恢复的作用[J].康复学报,2015,25(1):50-53.
[7]STOPPINI L,BUCHS P-A,MULLER D.A simp le method for organotypic cultures of nervous tissue[J].Journal of Neuroscience Methods,1991,37(2):173-182.
[8]M.RENIC,S.N.KUMAR D G.Protective effect of 20-HETE inhibition in a model of oxygen-glucose deprivation in hippocampal slice cultures[J].Am J Physiol Heart Circ Physiol.,2012,302(6):1285-1293.
[9]SUN X,YAO H,DOUGLAS R M.InsulinPI3K signaling protects dentate neurons from oxygen-glucose deprivation in organotypic slice cultures[J].Journal of Neurochemistry,2010,112:377-388.
[10]DIONNE K R,LESER JS,LORENZEN K.A brain slice culture model of viral encephalitis reveals an innate CNS cytokine response profile and the therapeutic potential of caspase inhibition [J].Experimental Neurology,Elsevier B.V.,2011,228(2):222-231.
[11]SRIPATHIRATHAN K,BROWN J,NEAFSEY E J.Linking binge alcohol-induced neurodamage to brain edema and potential aquaporin-4 upregulation:evidence in rat organotypic brain slice cultures and in vivo.[J].Journal of neurotrauma,2009,26(2):261-273.
R285.5
A
1000-338X(2016)01-0033-03
2015-10-21
福建省卫生和计划生育委员会资助课题(WZZY201302),福建中医药大学校管课题(X2014143、X2014127),国家级大学生创新创业训练计划项目(201510393019)
杨澜(1990—),男,2013级药理学专业硕士研究生,主要从事中药神经药理研究。
黄枚(1966—),女,教授。E-mail:hmei0303@qq.com
