脊髓Pellino1敲减对长春新碱诱导大鼠神经病理性痛的影响
2021-09-07付宝军姜静静黄玉琼林宗航
付宝军,姜静静,黄玉琼,林宗航,李 恒
(广州医科大学附属第六医院,清远市人民医院麻醉科,广东 清远 511518)
长春新碱(vincristine)是一种最常用化疗药物,在抗肿瘤治疗中发挥重要作用,该药在治疗肿瘤同时常常诱导产生化疗诱导神经病理性痛(chemo⁃therapy-induced neuropathic pain,CINP)[1],这种不良反应的严重程度通常与化疗药物使用剂量有关。目前临床治疗CINP的药物不仅疗效不理想,而且药物本身的不良反应也限制了其临床应用[2-3]。因此,阐明CINP发生发展机制,寻找新的药物作用靶点,对于开发安全有效治疗药物具有重大临床意义。随着对CINP机制研究的不断深入,胶质细胞尤其小胶质细胞在CINP中的作用得到更广泛关注[4-5]。研究表明,腹腔注射长春新碱导致 Wnt/β-连环蛋白信号激活,同时伴有小胶质细胞和星型胶质细胞活化[6]。在长春新碱诱导CINP模型中,Notch信号促进脊髓小胶质细胞趋化因子C-X3-C-基元受体 1〔chemokine(C-X3-C motif)receptor 1,CX3CR1〕/p38丝裂原激活的蛋白激酶(p38 mito⁃gen-activated protein kinase,p38 MAPK)通路活化[7],但在CINP中脊髓小胶质细胞活化调节机制仍不清楚。Pellino(Peli)是最近发现的一个E3泛素连接酶家族,包括Peli1,Peli2和Peli3[8]。最近研究显示,Peli1通过促进肿瘤坏死因子受体相关蛋白6(tumer necrosis factor receptor associated factor 6,TRAF6)的泛素化,激活心肌中MAPK和NF-κB信号通路,导致炎症反应[9-11]。另一项研究表明,在小胶质细胞中,Peli1通过泛素化激活白细胞介素1(interleukin-1,IL-1)受体相关激酶/TRAF6复合物介导 Toll样受体 4(Toll-like receptor 4,TLR4)/NF-κB信号转导促进炎症反应[12]。Peli1作为一种小胶质细胞特异性调节因子,参与实验性自身免疫性脑脊髓炎[13]、蛛网膜下腔出血[14]和西尼罗病毒脑炎的病理生理过程[15]。有研究报道,坐骨神经压迫损伤模型中,大鼠脊髓Peli1通过增加K63相关TRAF6泛素化,从而激活MAPK信号通路[16]。更值得关注的是,最近研究表明,在坐骨神经压迫致神经病理性痛和吗啡镇痛耐受中,脊髓背角Peli1蛋白表达上调,并通过活化小胶质细胞参与痛觉过敏发生和维持过程[16-17]。本研究团队前期研究发现,脊髓背角Peli1蛋白参与瑞芬太尼诱发痛觉过敏,其机制与神经炎症密切相关[18]。然而Peli1在CINP中的作用未见报道。本研究采用长春新碱诱导CINP大鼠模型,通过鞘内注射表达Peli1短发夹RNA(Peli1 short hairpin RNA,shPeli1)的慢病毒靶向抑制Peli1,探讨Peli1在长春新碱诱导CINP中的作用及其可能机制,为CINP发生机制的研究提供理论基础,为研发防治CINP新药提供新的思路。
1 材料与方法
1.1 药品、试剂和主要仪器
注射用硫酸长春新碱(浙江海正药业股份有限公司,批号:H20068151)。山羊抗大鼠Peli1、离子钙接头蛋白1(ionized calcium binding adapter molecule 1,Iba1)、胶质细胞原纤维酸性蛋白(glial fibrillary acidic protein,GFAP)、磷酸化 p38 MAPK(phospho-p38 MAPK,p-p38 MAPK)、p38 MAPK、p-c-Jun N 端激酶(p-c-Jun N-terminal kinases,p-JNK)、JNK、细胞外信号调节激酶1/2(extracellular signal-regulated kinases1/2,ERK1/2)和 p-ERK1/2单克隆抗体(美国Cell Signaling Technology公司);IL-6、IL-1β和肿瘤坏死因子α(tumor necrosis factor α,TNF-α)ELISA试剂盒(上海碧云天生物技术公司);HRP标记的兔抗山羊IgG抗体、CY3标记的兔抗山羊IgG抗体和cDNA第一链合成试剂盒(美国Invit⁃rogen公司);RT-PCR试剂盒(美国Abcam公司);干扰shRNA(scrambled shRNA,shscr)、shRNA寡核苷酸链和慢病毒质粒(上海吉凯基因化学技术有限公司)。NK3酶标仪(iMark,美国Bio Tek公司);高速离心机(5415R,德国Eppendorf公司);凝胶电泳仪(美国Bio-Rad公司);荧光显微镜(DM4000B,德国Leica公司);PE-10导管(上海瑾瑜科学仪器有限公司);Von frey纤维丝刺激针(37400,意大利Ugo Basile公司);热辐射痛刺激仪(美国,Stoelting公司)。
1.2 实验动物
雄性SPF级SD大鼠,体重200~230 g,10~12周龄,由广东省医学研究院实验动物中心提供,生产许可证号:SYXK(粤)2019-0206。12 h光照-黑暗循环、安静环境下单笼饲养,自由饮水摄食。室温21.5~22.5℃,湿度45%~65%。所有实验操作均符合广州医科大学附属第六医院动物实验中心动物伦理要求并按照实验动物使用原则进行。
1.3 慢病毒介导shRNA构建
1.3.1 shRNA寡核苷酸链设计合成
根据Peli1微RNA序列设计Peli1 shRNA(shPeli1)1,2和3及shscr(阴性对照),每条核苷酸链的中间添加茎环结构TTCAAGAGA,正、反义链的5′端分别引入GATCC和AATTC,分别与BamHⅠ和EcoRⅠ酶切后的黏性末端互补,经Blast比对,与人类其他基因编码序列无同源性。shPeli1和shscr寡核苷酸链由上海吉凯基因化学技术有限公司合成。
1.3.2 Peli1 shRNA慢病毒质粒构建
用BamHⅠ和EcoRⅠ对慢病毒质粒进行双酶切,将shRNA寡核苷酸链退火形成双链DNA并与双酶切后的质粒连接,连接产物转化感受态DH5α大肠杆菌,在氨苄青霉素琼脂培养基平板上培养,筛选阳性克隆后委托上海吉玛制药技术有限公司测序验证。Peli1 shRNA1:5′-GGATTTATGCTG⁃CAGGGTTTG-3′;Peli1 shRNA2:5′-GGTGGTT⁃GAATATACTCATGA-3′;Peli1 shRNA3:5′GGTTCACAGAAGACTCCAAAC-3′;shscr:5′-TTCTCCGAACGTGTCACGT-3′。
1.4 大鼠鞘内置管术
大鼠ip给予戊巴比妥钠50 mg·kg-1麻醉后,参照Yaksh等[19]方法进行鞘内置管。定位于大鼠L3~L4棘突间隙,常规备皮,消毒,俯卧位固定,切开皮肤,钝性分离棘突两侧肌肉与筋膜,暴露并挑破硬脊膜后将PE-10导管向头端置入约2 cm,观察大鼠是否出现甩尾反射及是否有脑脊液流出,若出现则说明置管顺利。固定导管,并将导管经皮下隧道至颈部引出,消毒缝皮后单笼饲养。置管后通过PE-10导管注射2%利多卡因15 μL,如果30 s内大鼠出现双后肢麻痹(肢体完全不能活动且不见肌肉的收缩)且30 min后运动功能恢复正常,则判定为置管成功。剔除肌力减退或瘫痪(即后爪不能完全伸展、行走时转圈或倾倒及不能自发行走)的大鼠。
1.5 大鼠分组和药物处理
1.5.1 正常大鼠脊髓Peli1敲减实验
正常雄性SD大鼠行鞘内置管术后按随机数字表法分为shscr组和shPeli1组(n=9),分别于术后第2~4天(D2~D4)每天1次鞘内注射shscr慢病毒10 μL或shPeli1慢病毒10 μL(2×108TU)。于术后D4,D6,D8,D10和D12进行机械痛觉过敏和热痛觉过敏行为学检测(机械痛觉过敏实验结束30 min后行热痛觉过敏实验),D12行为学检测后30 min处死大鼠,取大鼠L4~L5脊髓节段,分别用Western印迹法和RT-PCR检测Peli1蛋白和mRNA表达水平(实验流程见图1A)。
1.5.2 CINP模型大鼠脊髓Peli1敲减实验
正常雄性SD大鼠行鞘内置管术后随机分为正常对照组、CINP组、CINP+shscr组和CINP+shPeli1组。CINP+shscr组和CINP+shPeli1组分别于鞘内置管术后D2~D4每天1次鞘内注射shscr慢病毒10 μL或shPeli1慢病毒10 μL(2×108TU)[16]。于鞘内置管术后D5开始,除正常对照组外,其余各组隔日ip给予长春新碱125 mg·kg-1(共4次)[20],分别于鞘内置管术后D4,D6,D8,D10和D12进行机械痛觉过敏和热痛觉过敏(机械痛觉过敏实验结束30 min后行热痛觉过敏)行为学检测,以D8 MWT和TWL均降低至≤70%基础值为模型制备成功(本实验模型成功率≥94.4%,造模成功后n=18)。于D12行为学检测后30 min处死大鼠,取大鼠L4~L5脊髓节段,用于后续Western印迹、RT-PCR和ELISA检测(实验流程见图1B)。
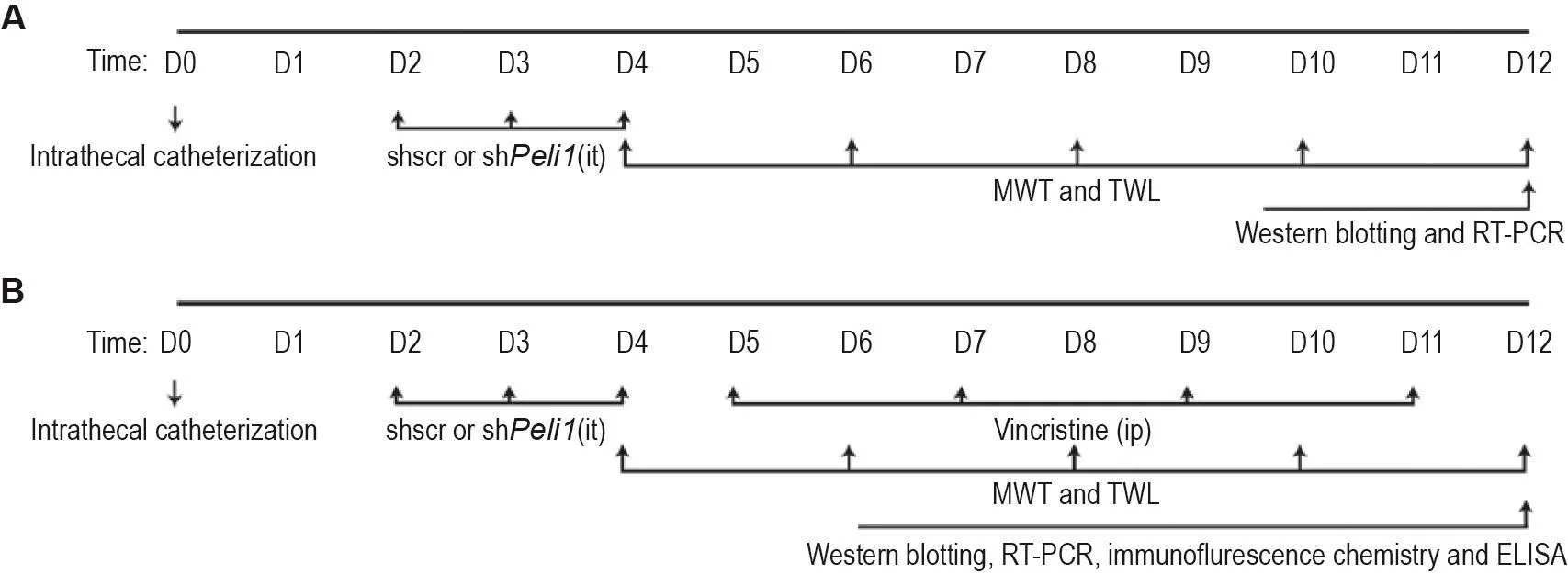
Fig.1 Experimental procedure.A:the normal male SD rats were intrathecally injected(it)with scrambled shRNA(shscr group)or Peli1 shRNA(shPeli1 group)once daily from the 2ndday after intrathecal catheterization(D2)to D4.Mechanical allodynia and heat hyperalgesia were evaluated via the mechanical withdrawal threshold(MWT)and thermal withdrawal latency(TWL)on D4,D6,D8,D10 and D12(n=6).The rats were sacrificed 30 min after the detection of behavior on D12,and the L4-L5 spinal cord was removed for the assays of Western blotting and RT-PCR(n=3).B:the normal male SD rats were randomly divided into normal control group,CINP group,CINP+shscr group and CINP+shPeli1 group after intrathecal catheterization(n=18).Rats were injected intrathecally with lentivirus expressing shscr 10 μL and shPeli1 10 μL(2×108TU)once daily from D2 to D4 in CINP+shscr group and CINP+shPeli1 group,respec⁃tively.Vincristine 125 mg·kg-1was ip injected on four alternate days from D5 in the remaining groups except the normal control group.The behavior detection of mechanical allodynia and heat hyperalgesia was performed on D4,D6,D8,D10 and D12,respectively(n=6).The rats were sacrificed 30 min after the detection of behavior on D12,and L4-L5 spinal cord segments were taken for subsequent assays.
1.6 机械痛觉过敏和热痛觉过敏行为学检测
根据文献[21]方法,用Von frey纤维丝按克数由小到大的顺序依次垂直刺激大鼠后足底中部,力度以纤维轻微弯曲为准,持续3~5 s,直到大鼠出现缩足反应,同一克数的纤维丝重复测试3次,每次间隔5 min,引起大鼠缩足反应的最小纤维丝克数即为机械缩足反射阈值(mechanical withdrawal threshold,MWT)。以up-down法推测大鼠MWT,中位数法计算50%反应阈值,以反映大鼠机械痛觉过敏。
参照文献[22]方法,将大鼠置于厚3 mm的玻璃板上适应环境15 min,用热辐射刺激仪照射大鼠后肢足底中部(刺激强度在整个实验过程中维持一致),照射开始至大鼠出现缩足或舔足的时间为热缩足反射潜伏期(thermal withdrawal latency,TWL),每只大鼠测定5次,每次间隔3 min,计算平均TWL反映大鼠热痛觉过敏。为避免组织损伤,最长照射时间设为20 s。
1.7 Western印迹法检测脊髓Peli1,Iba1和GFAP蛋白表达水平及p38 MAPK,JNK和ERK1/2蛋白磷酸化水平
大鼠分组和药物处理同1.5.2。D12,每组各取3只大鼠,处死后冰上迅速取出L4~L5脊髓节段,加入裂解液进行匀浆,4℃下17 888×g离心5 min,并用BCA试剂盒进行蛋白质定量。每份样品取30 μg进行聚丙烯酰胺凝胶电泳,转膜后牛奶封闭2 h,加入一抗(稀释倍数:GAPDH,p38 MAPK,JNK和 ERK1/2 为 1∶1000;Peli1,GFAP,Iba1,p-p38 MAPK,p-JNK和p-ERK1/2为1∶2000),4℃孵育过夜,加入HRP标记的兔抗山羊IgG抗体(1∶1000)室温孵育后洗膜、显色、曝光、显影,采用Image J软件分析蛋白条带积分吸光度,以目的蛋白条带与内参蛋白条带积分吸光度比值或磷酸化蛋白条带与其总蛋白条带积分吸光度比值反映目的蛋白相对表达水平或蛋白磷酸化水平。
1.8 RT-PCR检测脊髓Peli1,Iba1和GFAP mRNA表达水平
大鼠分组和药物处理同1.5.2。D12,每组各取3只大鼠,处死后取L4~L5脊髓,使用TRIzol®试剂提取总RNA,反转录为cDNA。引物序列见表1。扩增条件:94℃预变性 5 min,94℃ 30 s,54℃ 30 s,72℃ 20 s,共45个循环,72℃延伸10 min。用2-ΔCt法计算Peli1,Iba1和GFAP mRNA相对表达水平。
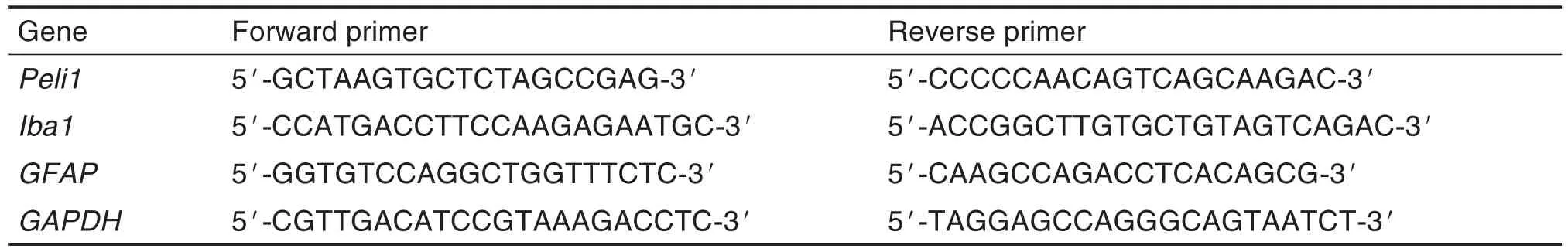
Tab.1 Sequence of primers for RT-PCR
1.9 免疫荧光化学法检测脊髓组织切片Iba1蛋白表达
大鼠分组和药物处理同1.5.2。D12,每组取3只大鼠,麻醉后迅速取大鼠L4~L5脊髓节段,4%多聚甲醛固定2 h后分别于20%和30%蔗糖溶液中脱水,冰冻切片机切片(厚度15 μm)。免疫荧光染色:PBS 0.01 mol·L-1(pH7.4)洗片 3 次,每次20 min,加5%山羊血清室温封闭2 h后加山羊抗大鼠Iba1抗体(1∶200),4℃孵育过夜;次日复温至室温后PBS洗3次,每次15 min;分别加入CY3标记的兔抗山羊IgG抗体(1∶1000),室温孵育2 h;PBS洗3次,每次20 min;晾干,封片剂封片;倒置荧光显微镜下拍照观察。每只大鼠随机选择4张脊髓切片使用Image J软件计算各组荧光强度值反映Iba1蛋白表达水平。
1.10 ELISA检测脊髓匀浆TNF-α,IL-6和IL-1 β含量
大鼠分组和药物处理同1.5.2。D12,每组大鼠取3只断头处死,迅速冰上取出L4-L5脊髓节段并匀浆,4℃,7155×g 离心10 min,取上清液,-80℃保存。TNF-α,IL-6和IL-1β含量测定按照试剂盒说明书进行。用NK3酶标仪于波长480 nm处测定吸光度值,根据绘制的标准曲线计算TNF-α,IL-6和IL-1β含量。
1.11 统计学分析
2 结果
2.1 敲减脊髓Peli1对正常大鼠机械痛觉过敏和热痛觉过敏的影响
行为学检测结果(图2)显示,正常大鼠shscr组和shPeli组鞘内置管术后D4,D6,D8,D10和D12 MWT(图2A)和TWL(图2B)差异均无统计学意义。
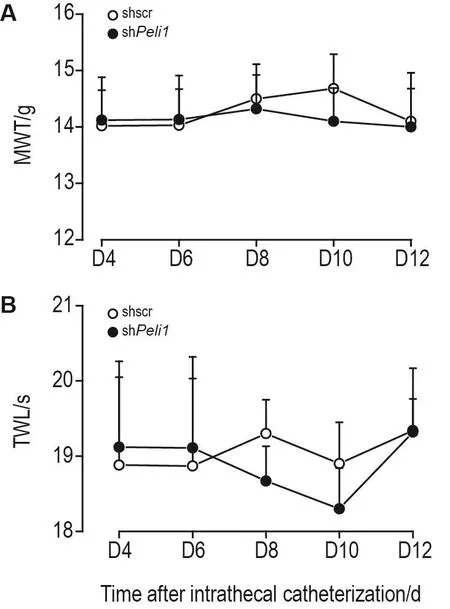
Fig.2 Effect of spinal Peli1 knockdown on mechanical allodynia(A)and heat hyperalgesia(B)in normal rats.See Fig.1A for the rat treatment.MWT:mechanical with⁃drawal threshold in mechanical allodynia test;TWL:thermal withdrawal latency in heat hyperalgesia test.±s,n=6.
2.2 敲减脊髓Peli1对正常大鼠脊髓Peli1蛋白和mRNA表达水平的影响
Western印迹法(图3A)和RT-PCR(图3B)结果显示,与shscr组相比,shPeli1组大鼠鞘内置管后D12脊髓Peli1蛋白和mRNA表达均明显下调(P<0.05)。
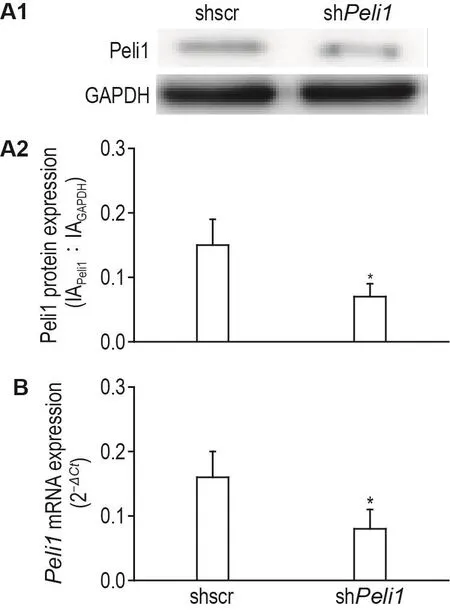
Fig.3 Effect of spinal Peli1 knockdown on protein and mRNA expression of Peli1 in spinal cords of normal rats by Western blotting(A)and RT-PCR(B).See Fig.1A for the rat treatment.A2 was the semi-quantitative result of A1.±s.n=3.*P<0.05,compared with shscr group.
2.3 敲减脊髓Peli1对CINP模型大鼠机械痛觉过敏和热痛觉过敏的影响
行为学检测结果(图4)显示,对正常对照组、CINP组、CINP+shscr组、CINP+shPeli1组大鼠的行为学结果进行重复测量方差分析显示,分组和检测时间点存在交互效应(P<0.01);鞘内置管术后D8,D10和D12,与正常对照组相比,CINP组大鼠MWT和TWL均显著降低(P<0.01);与CINP+shscr组相比,CINP+shPeli1组大鼠MWT和TWL明显增加(P<0.05,P<0.01)。
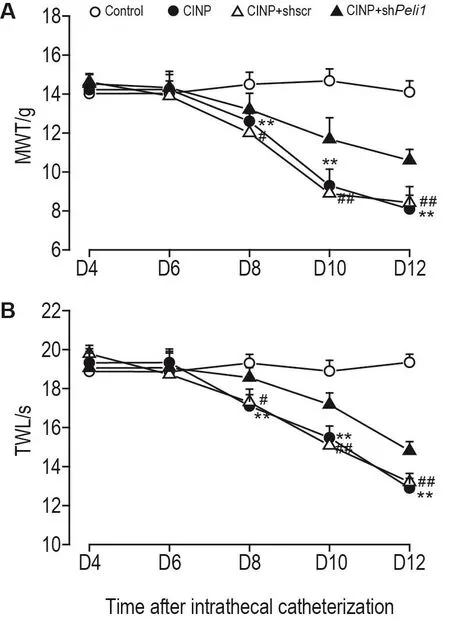
Fig.4 Effect of spinal Peli1 knockdown on mechanical allodynia(A)and heat hyperalgesia(B)in CINP model rats.See Fig.1B for the rat treatment.±s,n=6.**P<0.01,compared with normal control group;#P<0.05,##P<0.01,compared with CINP+shscr group.
2.4 敲减脊髓Peli1对CINP模型大鼠脊髓Peli1蛋白和mRNA表达的影响
Western印迹法和RT-PCR检测结果(图5)显示,与正常对照组相比,CINP组大鼠脊髓Peli1蛋白和mRNA表达明显上调(P<0.01);与CINP+shscr组相比,CINP+shPeli1组大鼠脊髓Peli1蛋白及mRNA表达明显下调(P<0.05,P<0.01)。
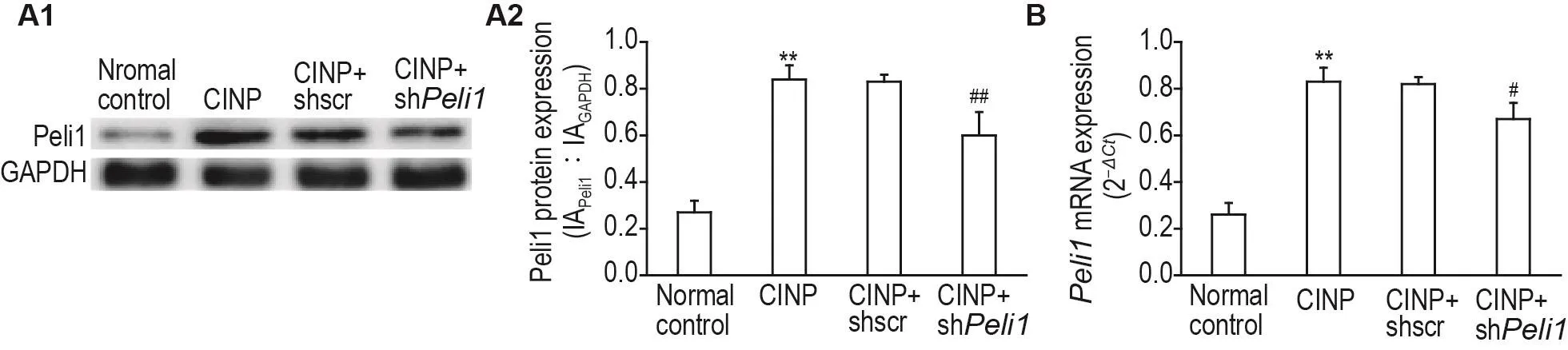
Fig.5 Effect of spinal Peli1 knockdown on protein and mRNA expression of Peli1 in spinal cords of CINP model rats detected by Western blotting(A)and RT-PCR(B).See Fig.1B for the rat treatment.A2 was the semi-quantitative result of A1.±s,n=3.**P<0.01,compared with normal control group;#P<0.05,##P<0.01,compared with CINP+shscr group.
2.5 敲减脊髓Peli1对CINP模型大鼠脊髓Iba1蛋白和mRNA的影响
Western印迹法、RT-PCR和免疫荧光化学法检测结果(图6)显示,与正常对照组相比,CINP组大鼠脊髓Iba1蛋白和mRNA表达水平均明显上调(P<0.01);与CINP+shscr组相比,CINP+shPeli1组大鼠脊髓Iba1蛋白和mRNA表达水平均明显下调(P<0.01)。
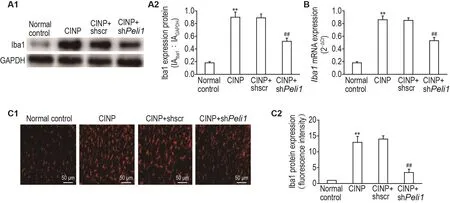
Fig.6 Effect of spinal Peli1 knockdown on protein and mRNA expression of Iba1 in spinal cords of CINP model rats detected by Western blotting(A),RT-PCR(B)and immunofluorescence chemistry(C).See Fig.1B for the rat treatment.A2 and C2 were the semi-quantitative results of A1 and C1,respectively.±s,n=3.**P<0.01,compared with normal control group;##P<0.01,compared with CINP+shscr group.
2.6 敲减脊髓Peli1对CINP模型大鼠脊髓GFAP蛋白和mRNA表达的影响
Western印迹法和RT-PCR检测结果(图7)显示,各组大鼠脊髓GFAP蛋白及mRNA表达水平无统计学差异。
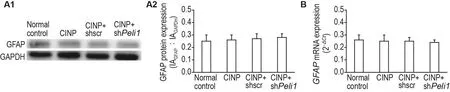
Fig.7 Effect of spinal Peli1 knockdown on protein and mRNA expression of GFAP in spinal cords of CINP model rats detected by Western blotting(A)and RT-PCR(B).See Fig.1B for the rat treatment.A2 was the semi-quantitative result of A1.±s,n=3.
2.7 敲减脊髓Peli1对CINP模型大鼠脊髓p38 MAPK,JNK和ERK1/2蛋白磷酸化水平的影响
Western印迹法检测结果(图8)显示,与正常对照组相比,CINP组大鼠脊髓p38 MAPK,JNK和ERK1/2蛋白磷酸化水平明显上调(P<0.01);与CINP+shscr组相比,CINP+shPeli1组大鼠脊髓p38 MAPK,JNK和ERK1/2蛋白磷酸化水平明显下调(P<0.05,P<0.01)。
2.8 敲减脊髓Peli1对CINP模型大鼠脊髓TNF-α,IL-6和IL-1 β含量的影响
ELISA结果(图9)显示,与正常对照组相比,CINP组大鼠脊髓组织血浆中TNF-α,IL-6和IL-1β含量明显上调(P<0.01);与CINP+shscr组相比,CINP+shPeli1组大鼠脊髓组织血浆中TNF-α,IL-6和IL-1β含量明显下调(P<0.05,P<0.01)。
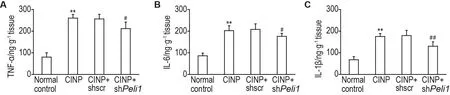
Fig.9 Effect of spinal Peli1 knockdown on contents of tumor necrosis factor α(TNF-α)(A),interleukin-6(IL-6)(B)and IL-1 β(C)in spinal cords of CINP model rats detected by ELISA.See Fig.1B for the rat treatment.±s,n=3.**P<0.01,compared with normal control group;#P<0.05,##P<0.01,compared with CINP+shscr group.
3 讨论
本研究采用文献[20]方法构建CINP大鼠模型,该模型具有可操作性强、易于模拟及与CINP临床特征相似等优点,已被广泛应用于评价药物有效性和安全性以及探讨CINP发生发展机制的研究中。本研究于术后D4,D6,D8,D10和D12采用行为学方法评价机械痛觉过敏和热痛觉过敏,结果显示,D8 MWT和TWL均降低至≤70%基础值并持续到本研究观察结束(D12),提示CINP模型制备成功。
RNA干扰技术是近年来生命科学领域重大的发现之一,是指小分子双链RNA特异性地降解同源mRNA或抑制其表达,从而抑制或关闭特定基因功能的现象,该技术为本研究阐明CINP机制提供可靠的靶向干预工具。本研究结果显示,与shscr组相比,shPeli组大鼠鞘内置管后D12,脊髓Peli1蛋白和mRNA表达均明显下调,MWT和TWL无显著差异,提示敲减正常大鼠脊髓Peli1并未诱发痛觉过敏。另外,与CINP+shscr组相比,CINP+shPeli1组大鼠脊髓Peli1蛋白和mRNA表达明显下调,MWT和TWL明显降低,提示脊髓靶向敲减Peli1的RNA干扰技术有效可靠;脊髓Peli1基因在CINP发生中发挥重要作用。
目前,CINP发生发展机制仍不清楚,现有药物疗效不佳且长期应用下不良反应明显,令患者无法耐受。因此,亟需阐明CINP发生发展机制,为新的有效治疗药物的开发提供理论基础。大量证据表明,胶质细胞在CINP发生发展机制中发挥着关键作用[24]。我们及其他团队研究表明,在长春新碱诱导CINP形成过程中,脊髓小胶质细胞活化介导CINP大鼠机械痛觉过敏和热痛觉过敏[25-26]。本研究结果表明,CINP模型组大鼠脊髓Iba1蛋白和mRNA表达水平均较正常对照组明显上调,而GFAP蛋白和mRNA表达水平在各组间均无明显差异。文献报道,与疼痛密切相关的小胶质细胞在CINP形成阶段发挥作用,而星形胶质细胞在CINP维持阶段发挥作用[27-28]。本研究时间范围(D4~D12)正处于CINP形成阶段,提示与星形胶质细胞相比,脊髓小胶质细胞在CINP形成过程中可能发挥更为重要的作用。
脊髓小胶质细胞活化介导神经病理性痛的分子机制研究一直备受关注。目前已研究证实,CC类趋化因子配体 2[29]和集落刺激因子 1[30]等均可激活脊髓小胶质细胞而导致神经病理性痛,但是在CINP形成过程中,Peli1基因对小胶质细胞活化的调控作用鲜有报道。王林等[16]研究表明,在慢性坐骨神经结扎模型中,预先鞘内注射shPeli1靶向敲减Peli1,小鼠脊髓小胶质细胞活化标志物Iba1和星形胶质细胞标志物GFAP蛋白和mRNA表达于术后D7均明显下调。本研究结果显示,鞘内置管后D12,与CINP+shscr组相比,CINP+shPeli1组大鼠脊髓Iba1蛋白和mRNA表达均明显下调,而脊髓GFAP蛋白和mRNA表达无明显差异,提示Peli1基因可作为脊髓小胶质细胞活化的新分子机制。本研究与王林等[16]研究结果在脊髓GFAP表达方面存在差异,可能与2个实验中采用的CINP模型、GFAP检测时间点和使用的动物种属不同有关,同时提示在化疗药物和坐骨神经结扎导致的CINP中,Peli1基因的作用可能存在差异,即Peli1基因通过激活不同胶质细胞发挥作用。
Peli1是一种E3泛素连接酶,可作为模式识别受体(patern recognition receptor)信号,调控先天免疫反应[31-32]。最近研究表明,Peli1通过激活Toll样受体和T细胞受体促进炎症细胞因子合成[13]。炎症细胞因子在慢性疼痛中枢敏化过程中发挥重要作用[33-34]。神经损伤后,胶质细胞合成和释放的炎症细胞因子如TNF-α,IL-6和IL-1β,可与感觉神经元表面受体结合,增加神经元兴奋性,诱发痛觉过敏[35-36]。Peli1通过激活小胶质细胞促进吗啡镇痛耐受相关的痛觉过敏的发生发展过程,同时伴有炎症细胞因子合成和释放表达上调[17]。本研究结果显示,鞘内注射shPeli1靶向敲减Peli1后,CINP模型大鼠MWT和TWL明显增加,脊髓TNF-α,IL-6和IL-1β含量明显下调,提示Peli1可能通过炎症细胞因子介导神经元敏化,从而促进CINP的发生发展。
MAPK是一组能被不同的细胞外刺激(如细胞因子、神经递质、激素、细胞应激和细胞黏附等)激活的丝氨酸-苏氨酸蛋白激酶,将外界信号经细胞表面传递至细胞核内部。有研究报道,在神经损伤的情况下,脊髓背角MAPK信号通路包括ERK,p38和JNK被激活[37-39]。另一项研究表明,在小胶质细胞内,Peli1基因缺失抑制脂多糖诱导的MAPK信号的激活[13]。小胶质细胞内Peli家族成员Peli1通过髓系分化88依赖途径参与MAPK激活,促进炎症细胞因子的合成和释放[14,40]。本研究结果显示,鞘内注射shPeli1靶向敲减Peli1,可使CINP模型大鼠脊髓p38 MAPK,JNK和ERK1/2磷酸化水平下调,脊髓TNF-α,IL-6和IL-1β含量明显下调,提示Peli1可能通过MAPK信号通路调控炎症细胞因子的合成和释放,进而促进CINP的发生发展。
综上所述,敲减脊髓Peli1可明显抑制长春新碱诱导的CINP,其机制可能与抑制大鼠脊髓小胶质细胞活化及MAPK信号通路介导的炎症反应有关。
