DNA损伤标志物γ-H2AX及其在毒性测试应用中的研究进展
2021-09-07瞿敏敏谢剑炜
瞿敏敏,陈 佳,郭 磊,徐 华,谢剑炜
(军事科学院军事医学研究院毒物药物研究所,抗毒药物与毒理学国家重点实验室,北京 100850)
DNA是最重要的生命遗传物质之一,保持DNA的完整性和稳定性对于生物体的正常生长发育和机体功能正常运转至关重要。然而,DNA会受到外源性和内源性诸多因素的影响和干扰[1],进而造成不同程度损伤,如食品污染物、环境污染物、药品杂质、紫外线、电离辐射乃至正常代谢产生的活性氧等,均会对DNA造成损伤[2-3]。其中,DNA双链断裂(DNA double-strand break,DSB)是一种最严重的DNA损伤形式,如未能及时修复,将可能导致疾病甚至诱发癌症[4]。因此,DNA损伤的检测对于基因组稳定性的监测以及及早发现并预防重大疾病具有重要意义。1998年,Rogakou等[5]首次报道,磷酸化组蛋白H2AX(γ-H2AX)是一种表征DNA损伤尤其是DSB的特异性生物标志物,且其形成的焦点数与DSB数量呈对应关系。因此,旨在检测γ-H2AX的试验(简称γ-H2AX试验)被应用于众多与DNA损伤相关的基础研究和医学诊断中。目前,γ-H2AX试验已被广泛应用于环境毒理学、辐射生物剂量学、药物研发和疗效评估等研究领域,尤其在对化合物基因毒性的体外初步筛选方面,显示出极大的应用潜力[6]。本文系统综述近年来γ-H2AX试验在基因毒性测试中的研究进展,并展望其在基因毒性风险评估中的应用前景。
1 γ-H2AX的生成及生物学意义
1.1 H2AX和 γ-H2AX
组蛋白是真核细胞特有的一类碱性蛋白质,在染色质结构的组成和基因功能调控中发挥着重要作用。通常由核心组蛋白H2A,H2B,H3和H4各2个分子组成1个组蛋白八聚体,其被147 bp的DNA包裹形成染色质的基本组成单位——核小体,而H1作为连接组蛋白,起到稳定核小体间DNA的作用[7]。H2A蛋白家族具有多样的变体,包括H2A1、H2A2、H2AX、H2AZ和其他变体[8-9]。在人类细胞中,H2AX占H2A含量的2%~10%[5],分子质量为14 ku,其编码基因位于11号染色体的q23.2~q23.3,共编码142个氨基酸。H2AX多肽链N端的120个残基与H2A1的该段氨基酸序列几乎完全一致,而C端的22个残基序列与目前已知的脊椎动物H2A家族其他蛋白序列无同源性。C端序列在进化上高度保守,包括1个含139位丝氨酸(Ser-139)的丝氨酸-谷氨酰胺-谷氨酸(Ser-Gln-Glu,SQE)结构域(图1)。SQE结构域在不同种属生物体中高度保守[10-11],该进化保守性提示H2AX的C端序列可能具有重要的生物学功能。
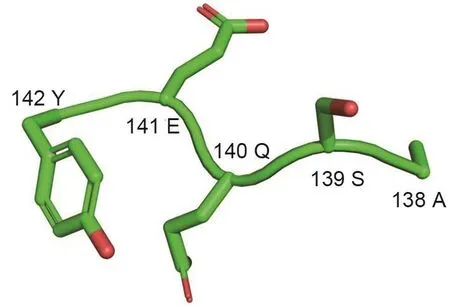
图1 组蛋白H2AX多肽链C端高度保守的丝氨酸-谷氨酰胺-谷氨酸结构域.Y:酪氨酸;E:谷氨酸;Q:谷氨酰胺;S:丝氨酸;A:丙氨酸.
1998年,Bonner团队首次发现并报道,电离辐射诱导DSB数分钟后,细胞内H2AX蛋白的Ser-139位点可被毛细血管共济失调突变基因(ataxia telangiectasia mutated gene,ATM)、ATM与Rad3相关蛋白(ATM and Rad3-related protein,ATR)及DNA依赖蛋白激酶催化亚基(DNA-dependent protein kinase catalytic subunit,DNA-PKcs)快速磷酸化,生成γ-H2AX[5]。γ-H2AX聚集在DSB处,形成γ-H2AX焦点。研究表明,γ-H2AX焦点在DSB发生数分钟内即可形成,且在30 min内达到峰值;随后γ-H2AX会随着DSB的修复而逐渐去磷酸化或被正常的H2AX取代,其半衰期约为2~7 h[12]。在哺乳动物细胞中,每产生1个DSB可导致γ-H2AX扩散到2 Mb染色质上,包括近2000个γ-H2AX分子[11]。
1.2 γ-H2AX的生物学意义
外源性因素如辐射[13]、热效应[14]、渗透压改变[15]和化学暴露物[16],内源性因素如细胞凋亡[17]、衰老[18]和有丝分裂[19],均可导致细胞内γ-H2AX形成。一旦内外源性因素诱导DSB形成,细胞即刻激活DNA损伤应答(DNA damage response,DDR)机制,于DSB处募集大量信号分子和修复蛋白,对损伤的DNA进行修复,以维持基因组的完整性和细胞的正常功能[20]。其中,γ-H2AX焦点的形成是DSB发生后早期被招募的蛋白复合体之一,并为其他修复蛋白提供结合位点。ATM,ATR和DNA-PKcs均可催化H2AX的磷酸化,ATR被认为是单链损伤及复制损伤诱导形成γ-H2AX的主要磷酸化激酶[21],DNAPKcs则介导细胞凋亡过程中H2AX的磷酸化[22]。
DSB诱导H2AX的磷酸化主要通过ATM激酶介导。细胞感应DNA损伤后,ATM发生自动磷酸化而激活,三聚复合物Mre11-Rad50-Nbs1(MRN)首先识别DNA损伤,随后募集活化的ATM到损伤位点,使ATM靶向下游底物,如H2AX蛋白、p53结合蛋白1(p53-binding protein 1,53BP1)和DNA损伤检控点介体1(mediator of DNA damage check⁃point 1,MDC1),磷酸化细胞周期检测点激酶1(checkpoint kinase 1,CHK1)和CHK2,激活周期检查点,H2AX蛋白的Ser-139磷酸化作为DNA损伤起始信号,招募细胞周期相关蛋白和修复蛋白至损伤位点,与γ-H2AX结合形成焦点(图2)。MDC1蛋白通过与γ-H2AX结合,锚定ATM以募集更多活化的ATM,进一步放大H2AX磷酸化信号。Nijmegen断裂综合征蛋白1(Nijmegen breakage syndrome protein 1,NBS1)与γ-H2AX结合促使越来越多的DDR蛋白包括53BP1和MRN复合物聚集在DNA损伤位点,即γ-H2AX作为锚点募集DDR中介物以及更多修复蛋白到损伤位点,释放生物信号并引导修复蛋白对DNA进行修复[23-25]。因此,γ-H2AX被认为是可同时表征DNA损伤和修复的生物标志物。
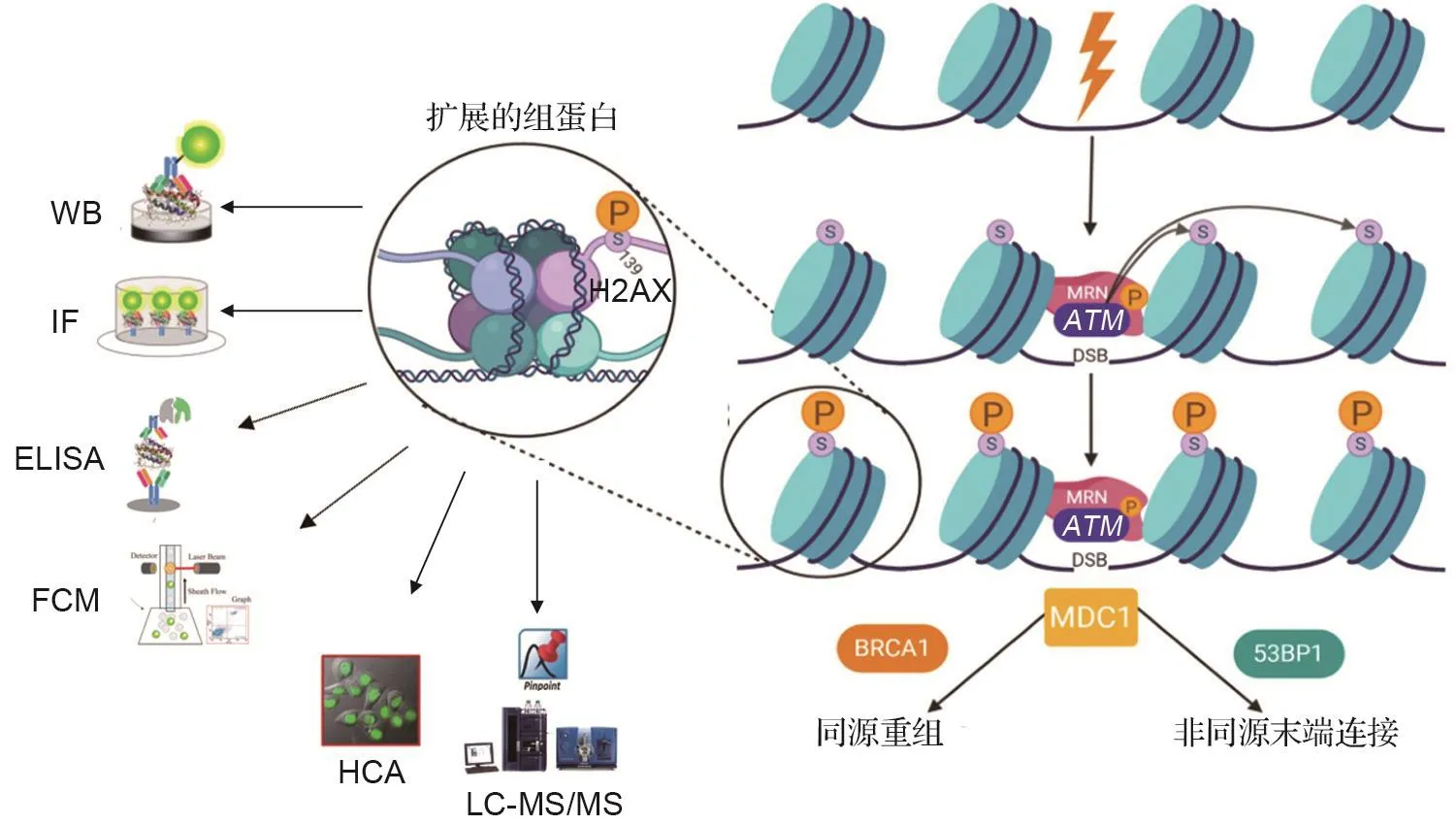
图2 磷酸化组蛋白H2AX形成过程[22]及主要检测技术.WB:Western印迹法;IF:免疫荧光显微技术;ELISA:酶联免疫吸附试验;FCM:流式细胞术;HCA:高内涵分析技术;LC-MS/MS:高效液相色谱串联质谱;S:组蛋白H2AX的139位丝氨酸;P:组蛋白H2AX的139位丝氨酸发生磷酸化;DSB:DNA双链断裂;MRN:三聚复合物Mre11-Rad50-Nbs1;ATM:毛细血管共济失调突变基因;53BP1:P53结合蛋白1;BRCA1:乳腺癌1号基因蛋白;MDC1:DNA损伤检控点介体1.
2 γ-H2AX试验在体外基因毒性评价中的应用
基因毒性物质是指能直接或间接损伤细胞DNA而导致基因突变或体内诱变的物质,具有诱发癌症的潜在威胁[26-27]。因此,建立基因毒性物质的通量筛查测试方法是安全性评估的重要组成部分。传统的基因毒性评价方法依赖动物实验,费用高,周期长,种属差异大[28]。随着21世纪“3R”原则与毒性测试替代策略的提出,细菌回复突变(Ames)试验、体外哺乳动物细胞染色体畸变试验、小鼠淋巴瘤细胞tk基因突变试验和体外微核(micronucleus,MN)试验已被较好的发展并应用,但一定程度上均存在特异性低的缺陷[29]。
近年来,为实现基因毒性物质的快速通量筛查,研究者提出了从基因损伤共性效应靶分子入手。如DNA损伤和修复的生物标志物γ-H2AX,作为一种早期敏感的基因毒性生物标志物,可由多种类型的DNA损伤(DSB、DNA加合物、DNA单链断裂、DNA氧化和烷基化)诱导产生。也有研究者提出,可将γ-H2AX作为筛选基因毒性的生物标志物并应用于监管评估中[6]。在此推动下,目前国内外已发展多种技术(图2),通过检测γ-H2AX对累计200余种化学物质的基因毒性开展了测试(表1)。
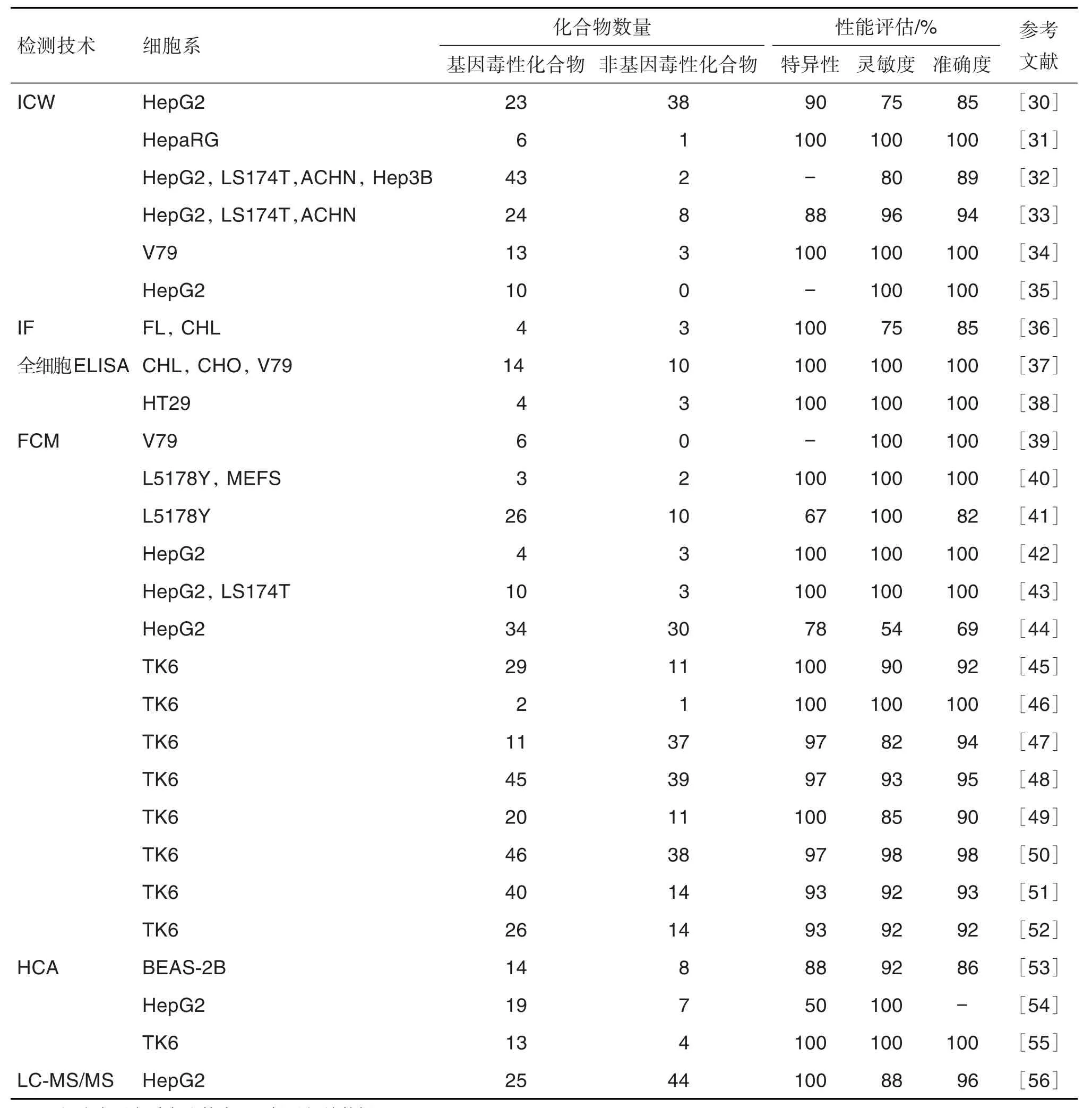
表1 不同检测技术在 γ-H2AX体外基因毒性研究中的应用
2.1 双向凝胶电泳技术
双向凝胶电泳是分离和定量组蛋白混合物的基本方法之一。最初,Rogakou等[5]应用二维凝胶电泳技术检测暴露于电离辐射后CHO细胞、SF268细胞和DBA/2小鼠形成的γ-H2AX焦点。结果表明,γ-H2AX在DNA损伤后约10 min即可被该技术检测。该技术虽是发现γ-H2AX的主要技术,但所需样本量较大,过程繁琐耗时,且无法实现高通量检测。
2.2 免疫化学检测技术
免疫化学检测技术是基于抗原抗体反应的特异性和灵敏性、以荧光素及酶等对抗原或抗体加以标记,经过化学呈色反应后,用显微镜或电子显微镜观察,对靶蛋白进行检测的技术。由于其灵敏度高、特异性强且应用范围广,可对靶蛋白进行定位、定性和定量。因此,目前γ-H2AX试验主要是基于该技术。
2.2.1 细胞内蛋白质印迹技术
Western印迹法是在凝胶电泳技术和固相免疫技术基础上发展起来的一种免疫化学检测技术。该技术通过特异性抗γ-H2AX抗体对经凝胶电泳等步骤处理过的生物样品着色,分析着色的位置和深度,对目标蛋白γ-H2AX进行定性和半定量分析。Western印迹法结果准确,稳定可靠,但其操作过程繁琐,不利于大规模的筛选分析。随着现代仪器的发展,Khoury 等[30]于 2013 年建立了一种基于Western印迹法改进的γ-H2AX试验,命名为细胞内蛋白质印迹技术(in cell Western,ICW),并首次用欧洲替代方法验证中心(European Center for Validation of Alternative Methods,ECVAM)推荐的包括基因毒性和非基因毒性在内的61个化合物在HepG2细胞中对该技术进行了验证。结果显示,ICW技术检测γ-H2AX焦点水平的特异性达90%,灵敏度为75%。之后,为了验证ICW技术,该课题组在多种细胞中评估了不同化合物的基因毒性[31-35],结果表明,基于ICW技术的γ-H2AX实验可准确评估化合物的基因毒性。
2.2.2 免疫荧光显微技术
免疫荧光显微技术是首先利用特异性抗体对目标γ-H2AX进行识别,随后利用标记荧光基团或加入偶联有荧光基团的二抗进行信号放大,通过荧光显微镜分析荧光信号,对细胞内形成的γ-H2AX焦点进行计数,以确定γ-H2AX分布和含量。2006年,Zhou等[36]利用免疫荧光显微技术首次分析了2个具直接作用的基因毒性化合物甲磺酸甲酯与N-亚硝基-N-乙基脲及2个具间接作用的基因毒性化合物苯并芘与2-乙酰氨基芴作用于人羊膜FL细胞和中国仓鼠CHL细胞后的γ-H2AX焦点水平变化,认为γ-H2AX焦点是评判基因毒性的理想指标,其结果与彗星试验结果呈现良好的相关性。
2.2.3 全细胞酶联免疫吸附试验(cell enzymelinked immunosorbent assay,Cell-ELISA)
Cell-ELISA检测γ-H2AX焦点的方法通常是利用抗γ-H2AX的单抗与经甲醇固定后的细胞培养物共孵育,再经酶标二抗识别,随后酶催化特异性底物产生一定量的显色产物,通过分析颜色信号实现γ-H2AX的定性或半定量。该技术的主要优点是操作方便简单、快速和高通量[37-38]。Matsuzaki等[37]分别应用Cell-ELISA和免疫荧光显微技术,在CHL,CHO和V79细胞中评价了6个非整倍体诱导剂、8个染色体断裂剂和10个非基因毒性化合物。结果表明,非整倍体诱导剂和非遗传毒性化合物的试验结果均呈阴性,而染色体断裂剂中除5-氟尿嘧啶在CHO细胞中的试验结果为阴性外,其余均为阳性。
2.2.4 流式细胞术
流式细胞术是将经过免疫荧光标记的细胞使用流式细胞仪进行分选检测,得出单个细胞核中γ-H2AX的荧光强度与标记细胞总荧光强度的百分比,进而得到定量结果。该技术不仅可快速定量多细胞群中的γ-H2AX,而且可同时定量分析细胞毒性和细胞周期分布[39-52]。Smart等[41]通过流式细胞仪检测细胞内γ-H2AX以评估作用机制不同的基因毒性化合物和非基因毒性化合物。结果表明,其对Ames试验的特异性达到67%,预测灵敏度高达100%;对体外哺乳动物基因毒性试验的特异性和灵敏度分别为89%和91%。Tsamou等[44]将HepG2细胞暴露于ECVAM推荐的基因毒性化合物和非基因毒性化合物,通过流式细胞仪进行γ-H2AX检测,发现其特异性为78%,灵敏度为54%,将γ-H2AX试验与其他试验如染色体畸变试验或小鼠淋巴瘤细胞突变试验等组合后则可显著提高测试的准确度。
2.2.5 高内涵分析(high content analysis,HCA)技术
HCA是一种新发展的自动化荧光显微成像技术,其作为一种化合物毒性通量检测的新方法,能在保持细胞结构和功能基础上,利用多种荧光标记物标记细胞,自动化地检测样品对细胞的生理状态和属性等影响。该技术具有快速、准确及通量检测的优点,且可自动化处理分析大批量的实验数据[53-55]。Garcia-Canton等[53]在人支气管上皮细胞系BEAS-2B中采用HCA技术评价了ECVAM推荐的包括基因毒性和非基因毒性化合物在内的22个化合物,发现基于γ-H2AX的体外基因毒性试验的特异性、灵敏度和准确度分别达88%,92%和86%。Ando等[54]用19个基因毒性化合物和7个非基因毒性化合物作用于HepG2细胞,利用HCA技术检测γ-H2AX的形成。结果显示,基于HCA的体外γ-H2AX试验的灵敏度达到100%。最近的一项研究报道,采用代谢能力强的HepaRG细胞进行γ-H2AX的HCA,证明黄曲霉毒素B1、苯并芘、7,12-二甲基苯并蒽、氟虫腈和硫丹的基因毒性,并验证了γ-H2AX试验应用于基因毒性筛查的适用性[31]。
2.3 高效液相色谱串联质谱(high liquid chroma⁃tography-tandem mass spectrometry,LC-MS/MS)技术
近20年来,随着生物质谱技术的飞速发展,逐渐利用LC-MS/MS技术解析组蛋白的变化[56-57]。Matsuda等[57]采用LC-MS/MS技术,对γ-H2AX磷酸化位点即包含Ser-139的特定肽段ATQAp⁃SQEY进行定量检测,并同时对H2AX肽段ATQA⁃SQEY进行检测,创建了一种可绝对定量分析细胞内γ-H2AX的LC-MS/MS方法。
本课题组近期亦建立了γ-H2AX质谱定量检测技术,在HepG2细胞中评估了ECVAM推荐的包括基因毒性化合物和非基因毒性化合物在内的69个化合物。结果表明,基于质谱技术的γ-H2AX试验特异性、灵敏度和准确度分别达到100%,88%和96%。基于质谱定量监测进一步获得DNA损伤及修复动力学曲线,初步揭示修复速率与基因毒性化合物的致癌性水平密切相关,致癌性强的化合物通常呈现需较长的修复时间;通过构建数学模型计算关键动力学参数,可应用于基因毒性化合物的测试及其致癌性的预测评估[56]。目前对该方法的应用加以拓展,证实可初步应用于药品中基因毒性杂质的筛查鉴定,将药品简单用水溶解后直接暴露细胞,药物成分和赋形剂均不干扰测定,具有简便、灵敏度高及准确度好的特点,可实现药品中基因毒性杂质的快速通量筛查[58]。
3 γ-H2AX试验与其他基因毒性试验的性能对比
Westerink等[59]基于体外MN试验在HepG2细胞中评估了ECVAM推荐的化合物,并比较了MN试验和γ-H2AX试验的敏感性和特异性。结果显示,γ-H2AX试验在检测基因毒性化合物方面更具优势,如可避免假阴性结果等。Khoury等[30]也表明,通过MN试验,N-亚硝基-N-乙基脲、2-乙酰氨基芴、氯化镉、对苯二酚和齐多夫定均未被检测出基因毒性特点,但在γ-H2AX实验中这些化学物质均呈现正确的阳性结果。
最近,Kim等[60]使用彗星试验和γ-H2AX试验在HepG2细胞系中检测了甲磺酸乙酯、N-亚硝基-N-乙基脲、紫外线照射与苯并[a]芘-7,8-二醇-9,10-环氧化合物的DNA损伤效应,发现低浓度的甲磺酸乙酯和N-亚硝基-N-乙基脲诱导γ-H2AX焦点生成呈现浓度依赖关系,其灵敏度比彗星试验高10倍。同样,Nikolova等[16]报道,相比于彗星试验,γ-H2AX试验能更可靠、更灵敏及更准确地评价基因毒性化合物。Dertinger等[52]亦报道,γ-H2AX试验和MN试验检测致染色体断裂化合物的结果呈现一致性。
4 体外 γ-H2AX试验注意事项
尽管γ-H2AX试验展现出良好的体外基因毒性评价前景,但在实际应用过程中仍存在一些值得关注的问题。
4.1 细胞模型的选择
在γ-H2AX试验中,细胞模型对结果的敏感性影响很大。通常,人源细胞比目前体外毒理试验中广泛使用的啮齿类动物细胞更接近人体对药物的代谢规律,因此更适合于γ-H2AX试验。如HepG2细胞,自身存在多种药物代谢酶,使用该细胞进行试验时无需再加入体外代谢活化系统,可简化试验步骤并降低试验成本[32]。本课题组近期研究亦发现,HepG2细胞对于基因毒性化合物及基因毒性杂质的毒性测试是一种理想的细胞模型[56,58]。但有研究者认为,肿瘤细胞DNA的损伤修复机制和细胞周期调控功能均发生了异常变化,而γ-H2AX参与细胞DNA损伤应答和细胞周期调节,因此正常细胞比肿瘤细胞更可靠[36]。
4.2 避免细胞凋亡导致的 γ-H2AX假阳性
细胞凋亡等内源性因素也可诱导γ-H2AX的形成,细胞毒性是γ-H2AX试验的干扰因素之一[61]。Tsamou等[44]发现,非整倍体化合物在细胞毒性较高时诱导细胞凋亡,从而产生凋亡型的γ-H2AX焦点,而致染色体断裂剂则诱导细胞形成DNA损伤型的γ-H2AX焦点。因此,建议试验时需要预先对化合物进行细胞增殖试验评价,从而选择不超过50%抑制浓度的化合物浓度,降低凋亡型γ-H2AX焦点的形成[30,62],以避免出现假阳性结果。另一方面,越来越多的研究表明,H2AX磷酸化是指征DNA早期损伤的重要指标,在DNA损伤早期时间点检测γ-H2AX,可更好地避免由细胞凋亡导致的γ-H2AX假阳性结果[52]。
5 体内 γ-H2AX试验的应用研究
大量研究表明,γ-H2AX在不同细胞系中均有表达[63],但γ-H2AX用于基因毒性评估的体内试验研究尚未广泛开展。Guerard等[64]评估了致癌物4-氯-邻甲苯胺在不同雄性大鼠组织中的基因毒性。大鼠肝组织γ-H2AX免疫组化结果显示,组织中可观察到γ-H2AX阳性的细胞核。Matsuda等[65]以LC-MS/MS技术定量分析小鼠体内γ-H2AX,发现睾丸中γ-H2AX水平最高(占总H2AX的2.3%),其次为骨髓(0.51%)、胃(0.28%)、肾(0.20%)、脾(0.20%)、肝(0.15%)和肺(0.10%)。他们进一步研究发现,小鼠分别ip给予致癌物丝裂霉素C和甲磺酸乙酯后,不同脏器中的γ-H2AX水平波动存在差异,其中骨髓、胃、肾、脾、肝和肺中γ-H2AX水平随时间发生动态变化,而睾丸中γ-H2AX水平未改变,揭示通过监测致癌物诱导的体内γ-H2AX水平变化,可检测致癌物在不同器官中的基因毒性。但目前关于γ-H2AX的体内试验研究仍较少,若将其作为现有体内标准试验的补充,则需采用更多种具不同基因毒作用模式的化学品进行研究,以明确其作为体内标志物评价基因毒性的可行性。
6 γ-H2AX与其他毒性终点标志物的互补
随着对化合物基因毒性理解的深入,研究者对基因毒性测试方法提出了更高的要求。如由于具不同基因毒性作用模式的化合物的致癌性存在显著差异[66],因此在候选药物的前期筛选过程中将会被赋予不同的去留命运,具染色体毒性的化合物会被直接淘汰,而仅具纺锤体毒性的化合物则可被留下参与后续的非临床研究。近期Motoyama等[67]撰文评述,应开发能提供基因毒性作用机制信息的评价方法,区分判断2种主要的基因毒性,即染色体毒性〔导致点突变和(或)结构性染色体突变的DNA损伤〕或纺锤体毒性(染色体数量增加或减少)。目前研究表明,将γ-H2AX和其他效应标志物相结合,将提供一种可行的区分不同基因毒性作用模式的化合物方法。
6.1 γ-H2AX与p-H3组合
在有丝分裂过程中,组蛋白H3的10位丝氨酸(Ser-10)经Aurora激酶作用而发生磷酸化,以促使染色质凝集和染色体分离。众多研究已证实,组蛋白H3的Ser-10磷酸化(p-H3)是细胞有丝分裂的生物标志物。非整倍体诱导剂导致细胞有丝分裂延迟,使组蛋白H3的Ser-10发生显著磷酸化,p-H3可作为指征非整倍体诱导剂的生物标志物[66]。Khoury等[33]在HepG2,LS174T和ACHN 3种细胞中评价了10种非整倍体诱导剂、5种染色体断裂剂和5种细胞毒性化合物,采用ICW技术,基于γ-H2AX和p-H3生物标志物的组合,有效区分作用模式不同的基因毒性化合物。
本课题组前期通过LC-MS/MS技术对γ-H2AX的磷酸化位点即Ser-139的靶肽段及p-H3的磷酸化位点即Ser-10的靶肽段进行定量检测,实现对γ-H2AX/H2AX和p-H3/H3的同时定量监测。进一步以HepG2和HeLa细胞为模型,评价了7个染色体断裂剂、7个非整倍体诱导剂、2个细胞毒性化合物和3个非基因毒性化合物。结果表明,基于质谱技术的γ-H2AX和p-H3测定方法,不仅能灵敏区分并准确定量具不同基因毒作用模式的化合物,还能动态监测基因毒性化合物对DNA的损伤、修复和转录过程[56]。
6.2 γ-H2AX与其他生物标志物组合
为进一步区分致染色体断裂化合物的作用模式,Kopp等[68]以9种作用机制不同的致染色体断裂化合物处理HepG2细胞,同时分析γ-H2AX、p-H3和其他6种参与DNA损伤信号通路的生物标志物。多参数分析表明,所选的8个生物标志物无法精确分类致染色体断裂化合物作用模式,但γ-H2AX和磷酸化P53蛋白存在相关性,结合磷酸化P53蛋白的定量可提高基因毒性的筛查效率。
最近,Wilde等[69]提出,基于蛋白质翻译后修饰可对不同药物的作用模式加以区分。该研究以96孔微孔板培养TK6细胞,采用不同药物处理细胞后,应用自动化细胞成像技术进行分析。结果显示,基因毒性药物和非基因毒性药物在TK6细胞中诱导不同的生物标志物反应,其中磷酸化的53BP1蛋白与诱导DSB的药物呈现相关性,乙酰化的P53蛋白则能区分被评价药物的基因毒性和非基因毒性。
因此,γ-H2AX与其他生物标志物的组合策略可在检测基因毒性的同时实现对不同基因毒性作用模式的评价区分。
7 结语
γ-H2AX作为同时表征DNA损伤修复的生物标志物,可作为指示基因毒性的特异性效应指标。已经建立了多种体外分析检测细胞和组织内的γ-H2AX的技术用于化合物体外基因毒性评价,其中免疫化学检测技术较为常用,相比免疫化学技术,质谱是新兴发展的一种可绝对定量检测γ-H2AX的技术,但其在通用性上还需要进一步验证。由于不同细胞模型和细胞凋亡等其它因素的干扰,γ-H2AX试验在体外基因毒性评价中仍存在一些限制。另一方面,目前关于γ-H2AX体内试验研究刚起步,有待采用更多的代表性化学物质进行动物试验以深入探讨。总之,γ-H2AX试验作为一项新的可以准确检测DNA损伤的试验,可应用于基因毒性的体外高通量筛选评价;同时,γ-H2AX与p-H3等其他生物标志物的组合检测可进一步提供一种快速有效区分化合物基因毒性作用模式的方法。但目前γ-H2AX检测方法多样,尚无统一的标准操作步骤,制约了其标准化推广,因此采用更多的化合物以进一步验证γ-H2AX试验的稳定性、可靠性以及建立相应的规范化标准具有重要价值。
