基于秀丽隐杆线虫模型的去氢骆驼蓬碱衍生物1-(4-甲氧基)苯基-9-丁基-β-咔啉神经毒性效应
2021-09-07巩月红文丽梅高惠静王建华
巩月红,文丽梅,陈 蓓,高惠静,耿 伟,赵 军,王建华
(新疆医科大学1.第一附属医院,2.省部共建中亚高发病成因与防治国家重点实验室,新疆 乌鲁木齐 830011)
去氢骆驼蓬碱(harmine,HM)是新疆民间沿用已久的地方特色药材骆驼蓬(Peganum harmala L.)籽提取物。HM属三环β-咔啉类生物碱,具有中枢神经系统毒性、细胞毒性及广泛的抗肿瘤活性,同时显示出杀虫潜力[1-2]。本课题组前期研究表明,HM对离体包虫具有良好的杀灭作用,而对寄生在宿主体内的包虫,杀灭效果不甚理想[3-4]。
鉴于此,本课题组根据HM母核β-咔啉芳香环上取代基及其位置的不同,对此类化合物的结构进行修饰,获得1000余种具有β-咔琳母核结构的HM衍生物。药效实验结果表明,其中1-(4-甲氧基)苯基-9-丁基-β-咔啉(代号:DH-004)对离体包虫的半数致死浓度(LC50)为(14.3±5.7)mg·L-1,优于HM〔(48.3±17.8)mg·L-1〕;对小鼠体内寄生的包虫囊肿的生长抑制作用优于HM[4],提示DH-004是一种具有开发潜力的抗包虫病新化合物,但其抗包虫作用机制尚不清楚。
包虫又称包生绦虫,是细粒棘球绦虫的幼虫,是我国西部地区较常见的寄生虫,常以人和家畜为宿主,具有较强的致病性和潜在的致死风险[5-6]。迄今,包虫在体外无法自行繁殖,寄生于宿主后生长周期长,较难获得。加之包虫自身结构和寄生的复杂性,不便将其作为实验对象进行药物干预和观察。而秀丽隐杆线虫(Caenorhabditis Elegans,C.elegans,以下简称线虫)结构简单、遗传背景明确、生命周期短,具有细胞模型的简易性,头部虽不存在典型的脑结构,但具有302个神经元和56个胶质细胞等结构,每个神经元都可被单独识别[7-10]。此外,线虫神经系统中含有乙酰胆碱脂酶(acetyl⁃cholinesterase,AChE)、谷氨酸和多巴胺等神经递质,控制其合成、代谢和传递的基因具有高度保守性,使线虫具有类推和预测高等动物神经毒性效应的潜力[11]。故本研究采用线虫作为实验对象,观察DH-004的神经毒性效应,并初步探讨其毒性机制,为进一步研究新型抗包虫药物提供实验依据。
1 材料与方法
1.1 药物、试剂和仪器
DH-004(化学结构式见图1),新疆华世丹药业有限公司合成,纯度≥93%,预先用DMSO配制成500 mmol·L-1的储存液,临用前稀释;他克林,纯度≥97%,北京华威锐科化工有限公司;DMSO,美国Sigma 公 司 ;NaCl,K2HPO4,KH2PO4,MgSO4和CaCl2,生工生物工程(上海)股份有限公司;琼脂、蛋白胨和琼脂糖,英国Oxoid公司。胆固醇、吖啶橙、盐酸四咪唑和丁二酮等,上海源叶生物科技有限公司;BCA法蛋白含量测定试剂盒和AChE活性检测试剂盒,北京索莱宝科技有限公司。
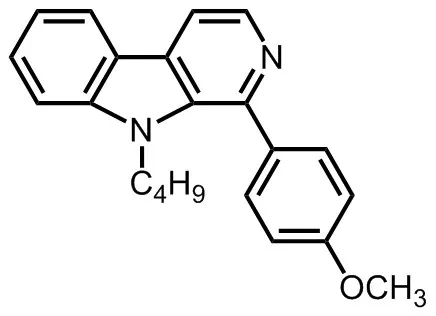
Fig.1 Chemical structure formula of DH-004.
SW-CJ-IFD超净工作台,苏州净化设备有限公司;SPX-80A生化培养箱,上海恒跃医疗器械有限公司;VCX150组织球磨仪,北京六一生物科技有限公司;Ti-S倒置荧光显微镜,日本Nikon公司;DK-8D恒温水浴箱,上海一恒科技有限公司;Varioskan Flash全自动酶标仪和Legend RT+离心机,美国Thermo公司;MS3涡旋振荡器,美国IKA公司。
1.2 动物
线虫(N2野生型)和大肠杆菌OP50(E.coli OP50)(尿嘧啶渗漏突变型)由上海巴斯德所陈昌斌教授惠赠。将线虫放置在涂布有E.coli OP50的线虫生长培养基(nematode growth medium,NGM)的培养板上,置20℃恒温培养箱内培养。NGM含NaCl 3 g·L-1、蛋白胨2.5 g·L-1、琼脂17 g·L-1和磷酸钾缓冲液(pH6.0)25 μmol·L-1,灭菌后加入抽滤除菌的胆固醇溶液 5 mg·L-1,MgSO41 mmol·L-1和CaCl21 mmol·L-1。
1.3 线虫的同步化处理
于超净工作台下,用M9缓冲液(g·L-1:Na2HPO4·12H2O 15.12,KH2PO43,NaCl 5,MgSO40.12,MgSO4·7H2O 0.25)冲洗并收集线虫置15 mL离心管中,加入等体积的线虫裂解液(将新鲜的5%次氯酸钠溶液1 mL、5 mol·L-1NaOH溶液0.5 mL和双蒸水3.5 mL混匀,现用现配),涡旋振荡裂解6 min,释放出虫卵,200×g离心2 min,弃上清。用M9缓冲液重悬沉淀虫卵,200×g离心2 min后弃上清,重复洗涤3次。最后用M9缓冲液重悬虫卵,置NGM培养板上,于20℃恒温培养箱内培养过夜,获得L1期和L4期线虫幼虫,用于后续实验。
1.4 实验分组
用DMSO将DH-004储备液倍比稀释,终浓度为0.0(溶剂对照,1.0% DMSO),12.5,25.0,50.0,100.0 和 200.0 μmol·L-1,分别均匀涂布至 NGM 培养板上。将线虫随机分为6组(n=30),各组分别移入涂布有不同浓度DH-004的NGM培养板上,于20℃恒温培养箱内培养。
1.5 线虫存活率测定
挑取经同步化处理的L1期线虫,给予不同浓度DH-004(药物处理同1.4),每组30条。从药物处理当天(实验第0天)开始,连续5 d,每天记录线虫的死亡数和丢失数,计算药物处理5 d内线虫存活率。存活率(%)=(受试线虫总数-死亡数-丢失数)/(受试线虫总数-丢失数)×100%。实验重复3次,取平均值,绘制存活率-时间曲线。利用SPSS20.0软件采用线性回归法计算DH-004的LC50。为排除受试线虫与其新产生幼虫的混杂,每隔24 h将线虫活体挑至新的涂有相同药物浓度的培养板上继续培养。线虫死亡标准为虫体丧失运动能力,多次触碰无反应,呈僵直状。
自供能电流变弹性体减振器的二维设计和实物图,如图2。电流变弹性体块夹在两铜电极板之间,分别用铜导线通过线槽与压电发电模块的上下压板相连,压电陶瓷因形变所产生的高电压可为智能电流变弹性材料体提供较强的电场,且电压幅值随激振力的大小和频率而改变,可使减振器能很好的适应振动环境,达到减振降噪的目的。
1.6 线虫头部摆动频次测定
挑取经同步化处理的L1期线虫,给予不同浓度DH-004(药物处理同1.4)分别连续处理3 d,每组每时间点30条。将线虫移至滴加K液(mmol·L-1:KCl 32,NaCl 51,CaCl23,MgSO43)60 μL且不含E.coli OP50的NGM培养板上,待其恢复1 min后,记录线虫在20 s内头部摆动的次数(头部从一侧摆向另一侧再摆回来记为1次)。实验重复3次。
1.7 线虫繁殖力测定
将每条经同步化处理的L1期线虫置于单独的NGM培养板中连续饲养,DH-004处理同1.4,每组30条。每24 h将线虫转移至新的、含相同浓度DH-004的培养板中,直至线虫丧失繁殖力。记录每条线虫的每日产卵数,并计算其有效产卵总数(即每日产卵数之和)。实验重复3次。
1.8 线虫感知能力测定
参考 Li等[12-13]、Bargmann 等[14]和Horvitz等[15]的方法以趋向和趋避行为反映线虫的感知能力。
趋向行为:制备9 cm未加CaCl2、MgSO4和胆固醇的NGM培养板,在底部中线两侧分别标记圆心相距4 cm、半径为1.5 cm的2个小圆,于其中一圆圆心处滴加1%丁二酮和1 mol·L-1叠氮化钠各1 μL,于另一圆圆心处滴加1 μL叠氮化钠0.5 mol·L-1作为对照(图2A)。将L4期线虫经DH-004处理(药物处理同1.4)2 d后,用M9溶液清洗3遍,滴加在距两圆圆心3 cm处,每组约100条,静置6 h后分别计数进入两圆内的线虫数(不计压线线虫数)。趋向系数=(丁二酮侧线虫数-对照侧线虫数)/受试线虫总数。实验重复3次。
趋避行为:制备9 cm未加CaCl2、MgSO4和胆固醇的NGM培养板,在底部画十字,将其分为4个象限,在Ⅱ和Ⅳ象限各滴加 25 μL CuSO4·5H2O(0.1 mol·L-1)涂布均匀,静置1~2 h待其渗入培养基(图2B),将经DH-004处理(药物处理同1.4)后的L4期线虫用M9溶液清洗3遍,在Ⅰ和Ⅲ象限分别滴加50条线虫,每组100条,静置6 h后分别计数进入Ⅱ和Ⅳ象限内的线虫总数(不计压线线虫数)。趋避系数=含Cu+象限线虫总数/受试线虫总数。实验重复3次。
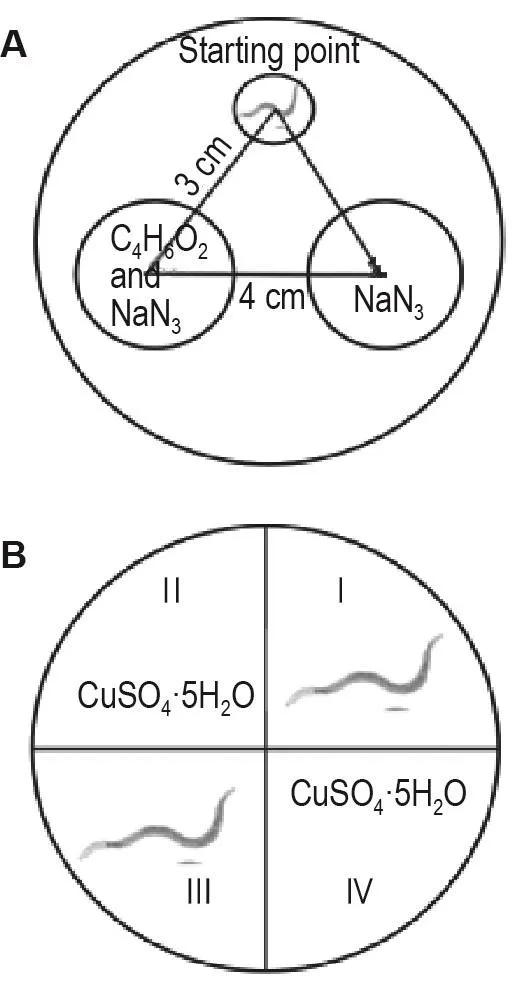
Fig.2 Area division of trend test(A)and avoidance test(B)in Caenorhabditis elegans(C.elegans).
1.9 线虫摄食行为测定
挑取经同步化处理的L1期线虫,给予不同浓度的DH-004(药物处理同1.4)分别处理1,2和3 d,每组每时间点随机挑取30条置未涂布药物的NGM培养板上,于荧光显微镜下拍摄30 s线虫咽泵运动的视频,以0.5倍慢速播放,记录每条线虫30 s内咽部收缩次数。实验重复3次。
1.10 吖啶橙染色法测定线虫细胞凋亡
参照文献[16]检测线虫细胞凋亡,每组随机挑取经同步化处理培养至L4期线虫20条,药物处理1 d(同1.4)后用M9缓冲液洗涤3~5次。将受试线虫转移至有吖啶橙染液的24孔细胞培养板中,置恒温培养箱中20℃下避光染色2 h。吸出虫体用M9缓冲液洗涤3~5次,再用苯四咪唑溶液麻醉,放置于2%的琼脂糖玻片上,倒置荧光显微镜拍照。若出现均匀的浅绿色,则表明细胞未发生凋亡;若出现橙黄色或者亮黄色,则表明细胞已经发生凋亡。采用Image软件进行分析,以平均荧光强度反映细胞凋亡水平。
1.11 线虫AChE活性的测定
1.12 统计学分析
2 结果
2.1 DH-004对线虫存活率的影响
实验结果见图3,溶剂对照组线虫存活率在5 d内无明显变化,均为(100.0±0.0)%;与溶剂对照组相比,DH-004各浓度组处理1~5 d可浓度依赖性降低线虫存活率(R2=0.949,P<0.01)。DH-004 12.5 μmol·L-1组处理 5 d(P<0.01)、25.0 μmol·L-1组处理 3~5 d(P<0.05,P<0.01)、50.0 μmol·L-1组处理2~5 d(P<0.01)及 100.0 和 200.0 μmol·L-1组处理 1~5 d(P<0.05,P<0.01)线虫存活率均显著降低。DH-004作用1~5 d的LC50分别为1045.8±14.8,921.7±10.1,135.9±5.9,39.0±1.8 和(19.7±0.6)μmol·L-1。
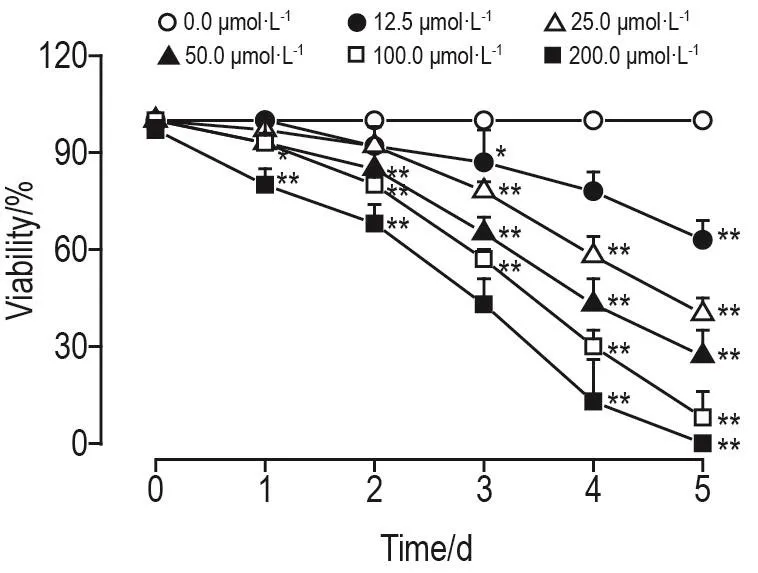
Fig.3 Effect of DH-004 on viability of wild-type C.elegans.C.elegans(L1)were treated with DH-004 0.0(solvent control,1.0% DMSO),12.5,25.0,50.0,100.0 and 200.0 μmol·L-1for 5 consecutive days,respectively.Vialility(%)=(total numbernumber of death-number of loss)/(total number-number of loss)×100%.±s,n=30.*P<0.05,**P<0.01,compared with 0.0 μmol·L-1group.
2.2 DH-004对线虫20 s内头部摆动次数的影响
实验结果见图4,与溶剂对照组相比,DH-004 25.0 μmol·L-1处理 3 d 组(P<0.01)、50.0 μmol·L-1处理1~3 d组(P<0.05,P<0.01)及100.0和200.0 μmol·L-1处理1~3 d组(P<0.01),线虫20 s内头部摆动次数均显著降低。
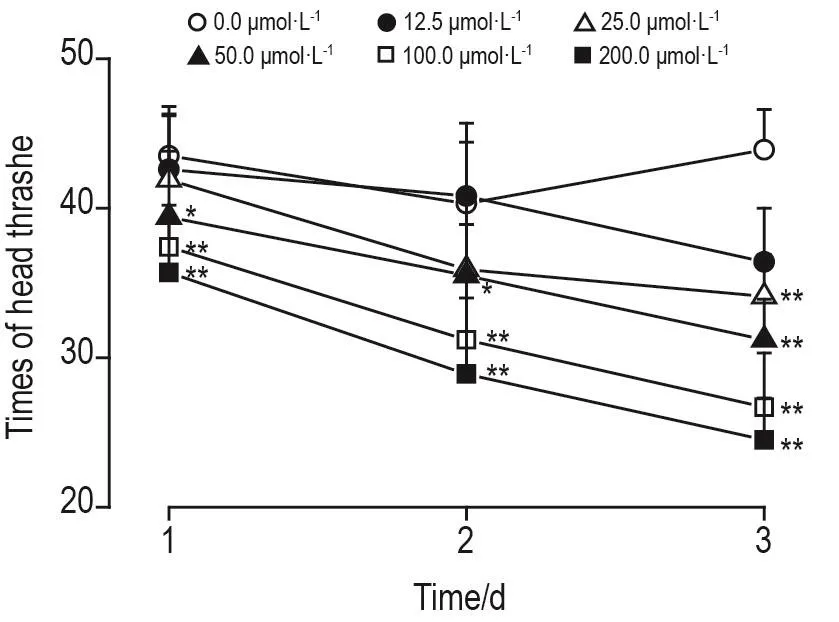
Fig.4 Effect of DH-004 on time of head thrashes of wild-type C.elegans within 20 s.C.elegans(L1)were treated with DH-004 0.0,12.5,25.0,50.0,100.0 and 200.0 μmol·L-1for 3 d.±s,n=30.*P<0.05,**P<0.01,compared with 0.0 μmol·L-1group.
2.3 DH-004对线虫繁殖力的影响
实验结果见图5,与溶剂对照组相比,DH-004 25.0,50.0,100.0 和 200.0 μmol·L-1组线虫有效虫卵总数均明显减少(P<0.01)。
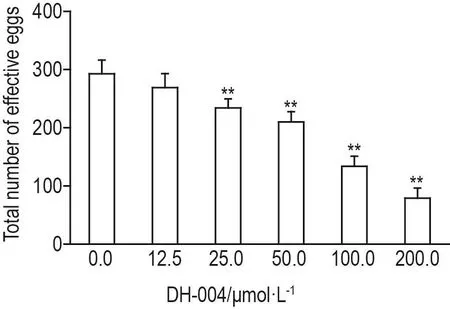
Fig.5 Effect of DH-004 on total numbers of effective eggs of wild-type C.elegans.C.elegans(L1)were treated with different concentrations of DH-004 until they lost their fecundity,respectively.±s,n=30.**P<0.01,compared with 0.0 μmol·L-1group.
2.4 DH-004对线虫感知能力的影响
趋向实验和趋避实验(表1)结果显示,与溶剂对照组相比,DH-004 25.0,50.0,100.0和200.0 μmol·L-1组趋向系数显著降低(P<0.05,P<0.01),趋避系数显著增高(P<0.01)。
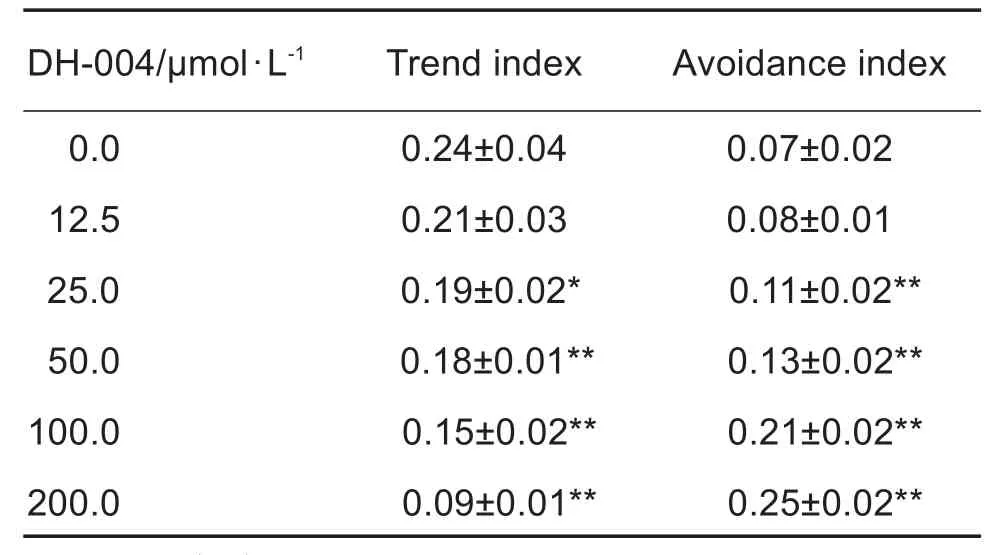
Tab.1 Effect of DH-004 on perception of wild-type C.elegans in trend test and avoidance test
2.5 DH-004对线虫摄食行为的影响
实验结果见图6,与溶剂对照组相比,DH-004各浓度组处理1~3 d使线虫咽部收缩次数均有不同程度降低。DH-004 12.5 μmol·L-1组处理2~3 d(P<0.01)及25.0,50.0,100.0和200.0 μmol·L-1组处理处理1~3 d(P<0.01)线虫咽部收缩次数均显著降低。
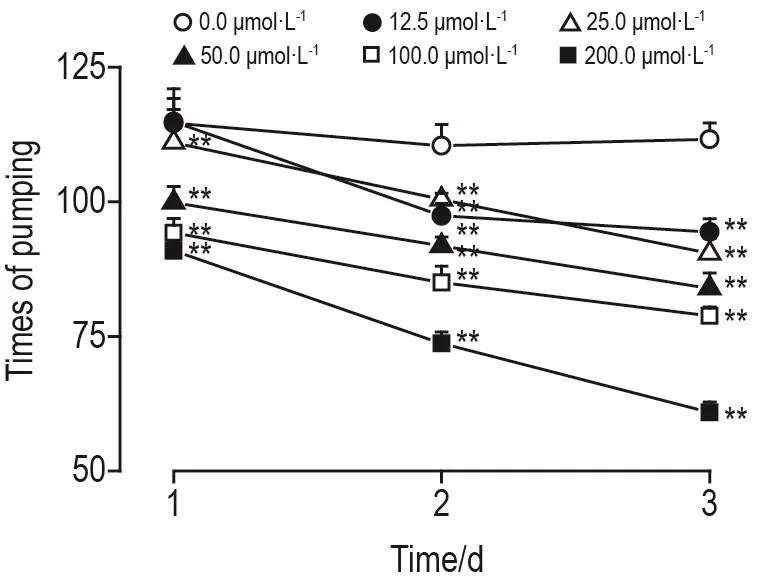
Fig.6 Effect of DH-004 on times of pumping in C.elegans.See Fig.4 for the C.elegan treatment.±s,n=30.**P<0.01,compared with 0.0 μmol·L-1group.
2.6 DH-004对线虫细胞凋亡水平的影响
线虫细胞凋亡水平如图7所示,与溶剂对照组相比,DH-004染毒处理24 h后50.0,100.0,200.0 μmol·L-1组平均荧光强度显著增强(P<0.01)。
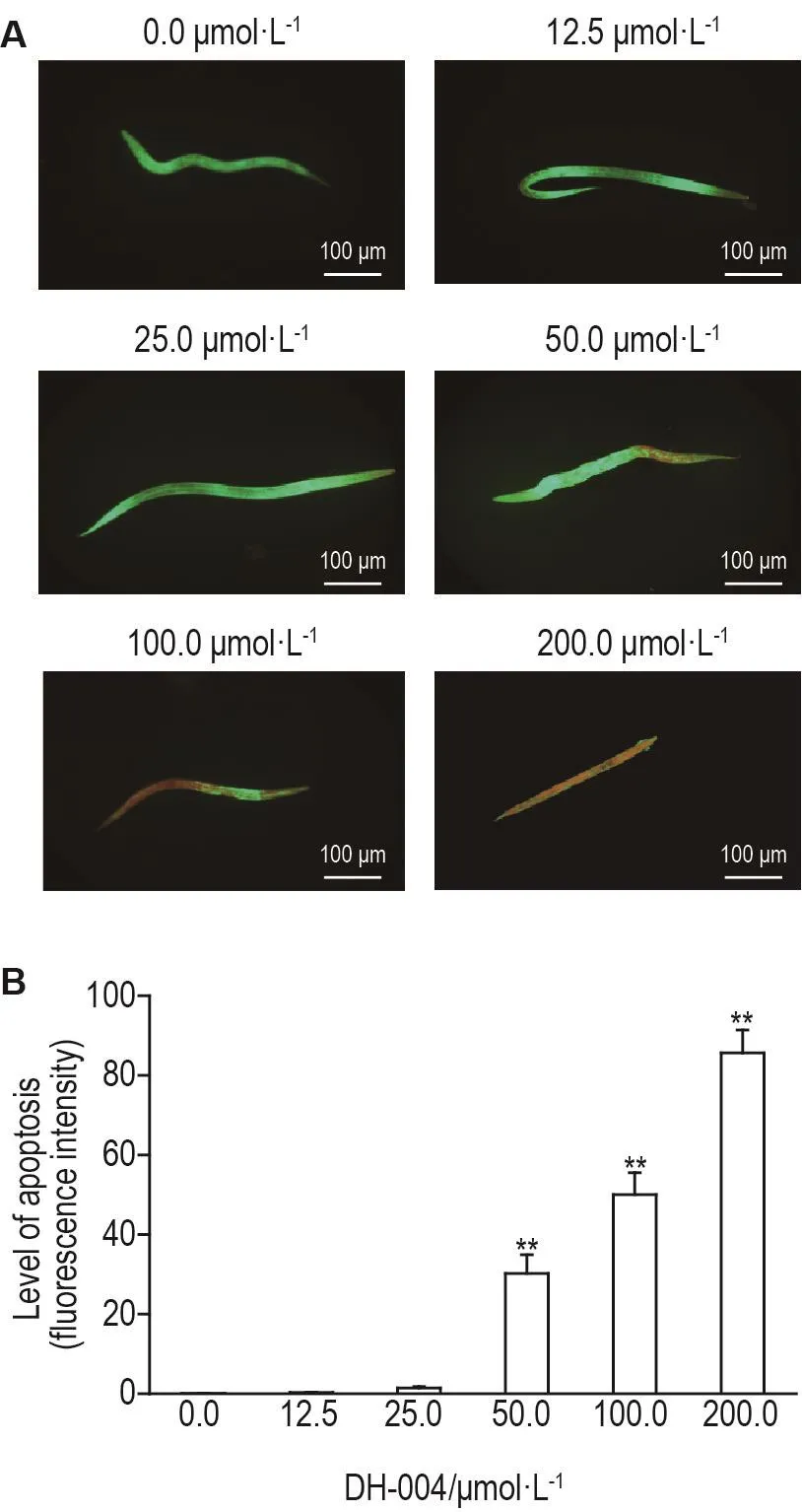
Fig.7 Effect of DH-004 on cell apoptosis in wild-type C.elegans.C.elegans(L4)were treated with DH-004 for 1 d.B was the semi-quantitative result of A.±s,n=20.**P<0.01,compared with 0.0 μmol·L-1group.
2.7 DH-004对线虫组织匀浆中AChE活性的影响
AChE活性检测结果如图8所示,与溶剂对照组相比,DH-004和阳性对照药他克林染毒处理后,线虫体内AChE活性抑制率均浓度依赖性增高,IC50分别为94.7±3.7和(82.7±4.1)μmol·L-1,R2分别为0.851和0.812(P<0.01)。
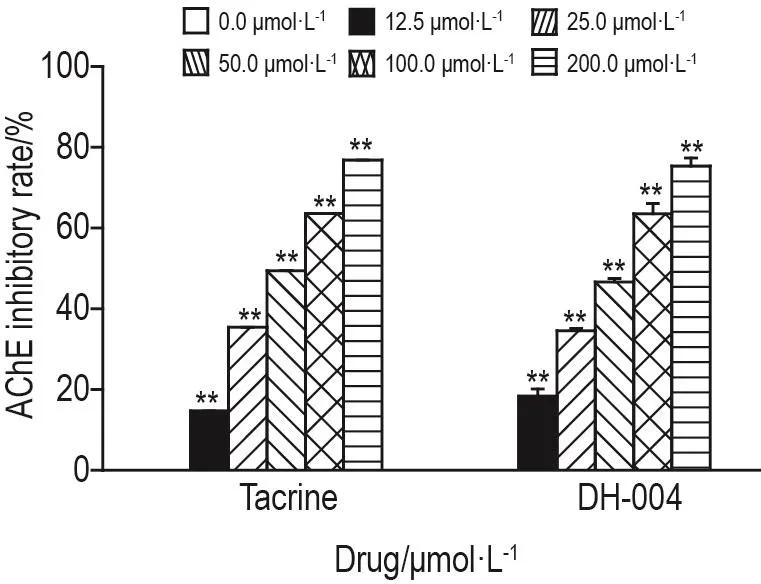
Fig.8 Effect of DH-004 and tacrine on acetylcholines⁃terase(AChE)activity in wild-type C.elegans.C.elegans(L4)were treated with tacrine and DH-004 for 4 d,respectively.Inhibition rate(%)=[absorbance A412 nmof 0.0 μmol·L-1group-A412 nmof drug group]/A412 nmof 0.0 μmol·L-1group×100%.±s,n=30.**P<0.01,compared with 0.0 μmol·L-1group.
3 讨论
线虫具有易培养、无毒无害、繁殖力强、遗传背景清晰、细胞谱系和分子通路清楚等优点[18-19],并具有神经元结构简单、基因功能与哺乳动物同源、与哺乳动物类似的神经递质(如乙酰胆碱和多巴胺等)的特点,因而在研究神经毒理学方面具有极大优势[20-23]。
本研究采用线虫对DH-004的神经毒性效应进行了评价。结果显示,随处理浓度和时间的增加,DH-004显著增加线虫的死亡率和细胞凋亡水平,降低头部摆动频次和咽泵震动频次,降低有效产卵量,表明DH-004对线虫具有毒性效应。本研究利用线虫具有趋向丁二酮和避开CuSO4溶液的特性进行了趋向和趋避实验。结果显示,随着DH-004浓度的升高,线虫的趋避系数增高,趋向系数减小,表明其感知能力下降,提示DH-004可能引起线虫化学感应神经元的损伤。线虫的运动、感知以及咽部收缩次数主要受神经系统控制,提示DH-004可能对线虫神经系统具有抑制作用。有研究认为,生物个体行为和生殖异常可能与AChE的活性有关[24]。本研究结果表明,DH-004显著抑制线虫AChE活性。
综上所述,DH-004对线虫具有明显的神经毒性作用,其机制可能与促进细胞凋亡和抑制AChE活性有关,提示其对寄生包虫的杀灭作用值得进一步深入探讨。
