大株红景天胶囊提高小鼠耐常压缺氧能力和抗疲劳作用
2021-09-07王艺博肖智勇周文霞张永祥
王艺博,王 峰,肖智勇,周文霞,张永祥
(1.广东药科大学中药学院,广东 广州 510006;2.军事科学院军事医学研究院毒物药物研究所,抗毒药物与毒理学国家重点实验室,北京100850)
组织氧供减少或氧不能充分被利用导致组织代谢功能和形态结构异常变化的病理过程称为缺氧(hypoxia),是多种疾病发生发展乃至死亡的重要原因[1]。冠心病、慢性阻塞性肺病和卒中等多种疾病伴随的病理损害与组织缺氧密切相关[2-3]。疲劳是日常生活中的常见状态,低氧也可引发疲劳[4]。缺氧还发生在高原和航空等高海拔环境中,严重影响该环境中人群的身体健康。同时,在缺氧环境下机体的活动能力明显下降,极易感到疲劳[4]。疲劳通常被认为与生理机能下降有关,往往会引发焦虑抑郁、认知障碍和身体功能障碍等一系列继发性问题[5],甚至引发生物调节紊乱和免疫系统相关疾病[6]。疲劳的病理生理机制复杂,包括能源衰竭、疲劳相关的代谢产物堆积、氧化应激损伤、中枢递质失衡、内稳态失衡、肌肉兴奋性和活动性改变和肌力下降等[7]。糖原水平、尿素氮(blood urea nitrogen,BUN)和乳酸(lactic acid,LA)等主要代谢产物的含量及超氧化物歧化酶(superoxide dismutase,SOD)和谷胱甘肽过氧化物酶抗氧化酶(glutathi⁃one peroxidase,GSH-Px)的活性等的变化在疲劳发生机制中的研究较为广泛[8-9]。
红景天是我国传统中药材,具有补气清肺、活血化瘀、补脾益气和益智养心等功效。红景天也是世界范围内公认的植物适应原(botanical adapto⁃gen),被认为具有提高机体适应能力、保护神经、抗衰老和保护心脏等多种药理活性[10]。《神农本草经》将红景天列为药用上品,《四部医典》《月王药诊》和《晶珠本草》等著作中均有关于红景天的药用记载,其中大株红景天〔R.wallichiana(HK.)S.H.Fu var.cholaensis(Praeger)S.H.Fu〕于 1977年被《中国药典》收录[11]。笔者于2021年1月20日通过国家药品监督管理总局网站对原料为一味“红景天”的药物进行检索,发现多种红景天药物的功能主治项下均有益气、活血和化瘀的表述,而仅有3种红景天药物(红景天口服液、大花红景天口服液和狭叶红景天片)被批准用于高山反应和身体虚弱。红景天的抗缺氧作用可能与其种属和来源等密切相关。研究发现,来自同一产地的狭叶红景天和唐古特红景天其活血化瘀和抗缺氧能力也有强弱之分[12]。此外,不同品系红景天在急性高原病防治以及抗疲劳方面的研究结果并不一致。有研究表明,服用红景天提取物〔含3%络塞维(rosavin)28 d后受试者的运动耐力并无提高[13],服用红景天提取物(含2.8%总络塞维)〕42 d后反而加重受试者的疲劳感[14],且红景天水提物单独使用对阻力运动后蛋白质合成、肌肉表型和运动性能也无明显影响[15]。
大株红景天是生长于高海拔地区的红景天属(Rhodiola L.)的一个亚种,其主要含有丁香酸、红景天苷、酪醇、红景天素和没食子酸等成分[16]。大株红景天胶囊(large plant Rhodiola capsules,LPRC)由大株红景天干燥根水提物制成,具有活血化瘀、通脉止痛的功效,主要用于冠心病和心绞痛的治疗,症见胸痛、胸闷、心慌和气短等[17-18]。虽然目前还不十分清楚红景天中的哪些特定化合物是活性成分,但其大多数制剂都被要求具有特定水平的标志性化合物——红景天苷。目前,临床使用的不同红景天制剂的日推荐服用量中红景天苷的含量存在较大差异。与其他红景天制剂相比,LPRC日推荐服用量中红景天苷含量>13.2 mg[19],但其改善耐缺氧能力和抗疲劳作用未见系统研究。因此,本研究采用低氧混合气体缺氧模型和密闭缺氧模型,观察LPRC对小鼠耐缺氧能力的影响,采用负重游泳实验和转棒实验评价LPRC对小鼠抗疲劳作用,并对其作用机制进行初步探讨,以期为LPRC的临床应用提供参考。
1 材料与方法
1.1 药物、试剂和仪器
LPRC(江苏康缘药业公司,国药准字号:2200-40023,批号:Z190305,红景天苷含量>2.89 mg·g-1);生理盐水(石家庄四药有限公司);凡士林、钠石灰、低氧混合气体(3% O2+97% N2)及BUN(批号:C013-2-1)、LA(批号:A019-2-1)、乳酸脱氢酶(lactate dehydrogenase,LDH,批号:A020-2)、SOD(批号:A001-3)、GSH-Px(批号:A005)和丙二醛(malond⁃ialdehyde,MDA,批号:A003-1)测定试剂盒均购自南京建成生物工程研究所;糖原含量检测试剂盒(BC0345)购自北京索莱宝科技有限公司。
自制密闭实验箱(35 cm×25 cm×25 cm)、125 mL广口瓶、自制游泳缸(30 cm×10 cm)和SA102型转棒式疲劳仪(江苏赛昂斯生物科技有限公司);2300型EnsPire多功能酶标仪(美国PerkinElmer公司);N9548智能样品研磨仪(北京赫得);EPS-2001电子天平(长沙湘平科技发展有限公司);ANY-maze动物行为分析系统(上海欣软)。
1.2 实验动物
SPF级雄性BALB/c小鼠,6~8周龄,体重20~24 g,购自北京维通利华实验动物技术有限公司,实验动物生产许可证号:SCXK(京)2016-0006。饲养环境温度23~27℃,相对湿度50%~60%,每12 h明暗交替,自由摄食饮水。动物实验遵循动物实验伦理委员会规定进行。
1.3 动物分组和给药
实验流程见图1。实验前,首先检测受试小鼠的自主活动性。经适应性饲养7 d后的小鼠,提前放入行为学实验室适应30 min,测试前在自制的自主活动箱(30 cm×30 cm×30 cm)中适应2 min后,采用Any-maze软件记录分析其20 min的运动总距离。按95%置信区间剔除自主活动过多和过少的小鼠,其余小鼠根据体重和自主活动性均衡随机分为对照组和LPRC 0.35,0.70和1.40 g·kg-1组,每组35只,共140只。分组后次日开始给药,每天ig给药1次,连续给药7 d,对照组给予相同体积的溶剂(0.9%生理盐水)。第8天,将每组小鼠分为4批,分别进行低氧混合气体缺氧实验(n=10)、密闭缺氧实验(n=10)、转棒实验和负重游泳实验(n=10)及非负重游泳实验(n=5)(图1)。药物受试剂量均依据其临床推荐人用剂量(以标准体重60 kg计)折算设置,即LPRC(每粒0.38 g)临床推荐剂量为每次4粒,每日3次,折算成小鼠每日给药中剂量为0.70 g·kg-1,小剂量和大剂量分别为中剂量的1/2和2倍,即0.35和1.40 g·kg-1。
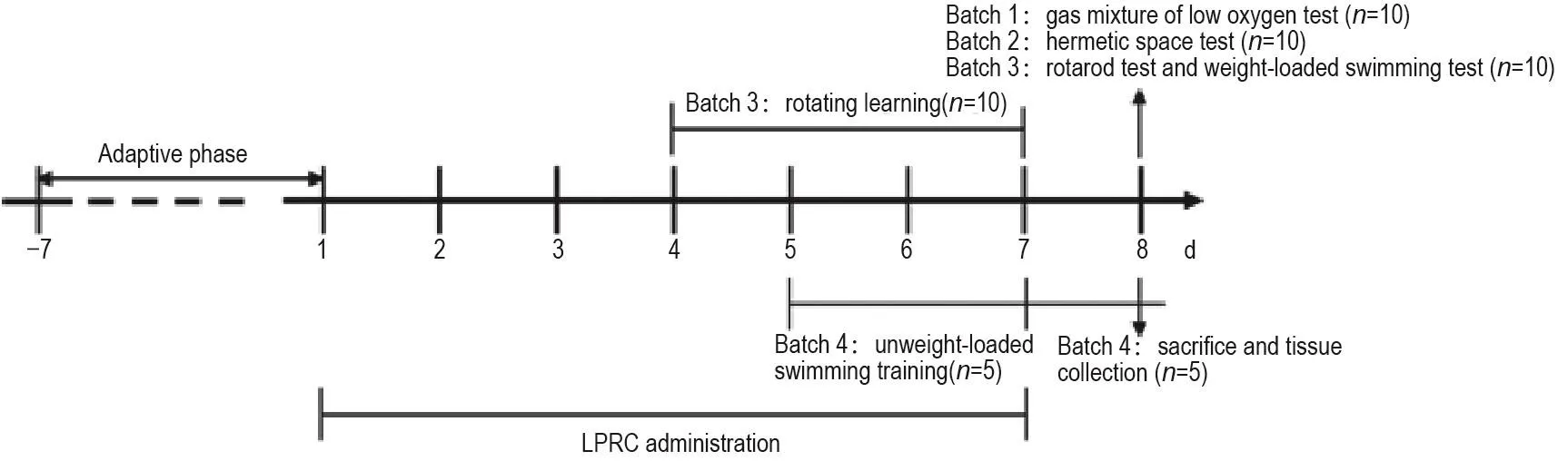
Fig.1 Experimental protocol and large plant Rhodiola capsules(LPRC)administration procedure.Mice were ig administered with LPRC 0.35,0.7 and 1.4 g·kg-1or saline(control group)once per day for 7 d before being subjected to behavioral experiments or sacrificed.
1.4 低氧混合气体缺氧实验
在低氧混合气体(3% O2+97% N2)缺氧实验中,自制密闭箱两端分别安装有进气孔和出气孔,进气口连接流量表控制气体流速。在小鼠放入前,混合气体以8 L·min-1流速预通气8 min,确保实验开始时箱内已充满低氧气体。实验中,持续向密闭箱中以4 L·min-1的流速通低氧混合气体。从小鼠放入密闭箱后开始计时,以小鼠前后趾抽搐挣扎后突然瘫软、鼻翼无煽动停止呼吸为死亡标准,记录小鼠从放入到死亡的时间,即为小鼠低氧混合气体缺氧存活时间。
1.5 密闭缺氧实验
将小鼠放入广口瓶中,瓶中装有15 g钠石灰,瓶口涂抹凡士林保证气密性,盖紧瓶盖,开始计时,小鼠死亡标准同1.4。小鼠自进入密闭广口瓶至死亡的时间即为密闭缺氧存活时间。
1.6 转棒疲劳实验
小鼠转棒疲劳实验分为学习期和测试期,其实验结果分别用于评价药物对实验动物的协调能力和疲劳耐力的影响[5,20]。第4~7天,每天给药2 h后将小鼠放于转棒疲劳仪上进行学习,第8天进行测试。学习期转棒转速设置为20 r·min-1,时间10 min,加速度7 r·min-1,记录小鼠从放上转棒到掉落的时间,即在棒时间。各组小鼠成绩稳定后进行测试实验,测试期转速设置为40 r·min-1,记录小鼠在棒时间。
1.7 负重游泳力竭实验
小鼠尾部后1/3处悬挂约自身体重10%的砝码,轻放入自制圆柱形水缸中,水深25 cm(小鼠四肢、重物均无法接触缸底),水温23~27℃。记录小鼠自放入游泳缸到沉入水中时间>10 s,记为小鼠负重游泳时间。
1.8 非负重游泳力竭小鼠肝糖原和肌糖原含量测定
根据文献[8,21]进行改进。给药第5~7天,对小鼠进行非负重游泳训练,训练时程分别为第5天30 min、第6天60 min和第7天90 min,制备小鼠力竭模型。除小鼠无负重外,其余实验条件同负重游泳实验。第8天,小鼠游泳90 min后休息30 min,随即处死小鼠,取肝和腓肠肌加入4℃生理盐水制成10%的匀浆。根据糖原检测试剂盒说明书推荐的方法进行测定。
1.9 非负重游泳力竭小鼠血清中BUN,LA和MDA含量及LDH,SOD和GSH-Px活性测定
与1.8同批小鼠,第8天小鼠游泳90 min后休息30 min,处死前眼眶取血,4℃过夜后1123×g,4℃离心10 min取血清。根据各自试剂盒说明书测定。
1.10 统计学分析
2 结果
2.1 LPRC对小鼠体重的影响
实验前各组小鼠体重均衡,给药7 d内,各组小鼠体重均随日龄增加而增长,对照组、LPRC 0.35,0.70和1.40 g·kg-1组小鼠体重分别增长1.6±0.3,1.7±0.7,1.5±0.7和(1.4±0.5)g,各组间无明显差异。
2.2 LPRC对小鼠低氧混合气体缺氧和密闭缺氧存活时间的影响
低氧混合气体缺氧实验结果显示,与对照相比,LPRC 0.70和1.40 g·kg-1可显著延长小鼠缺氧存活时间(P<0.05,P<0.01),LPRC 0.35 g·kg-1无明显影响(图2A)。密闭缺氧实验结果显示,与对照组相比,LPRC 3个剂量对小鼠缺氧存活时间均无明显影响(图2B)。
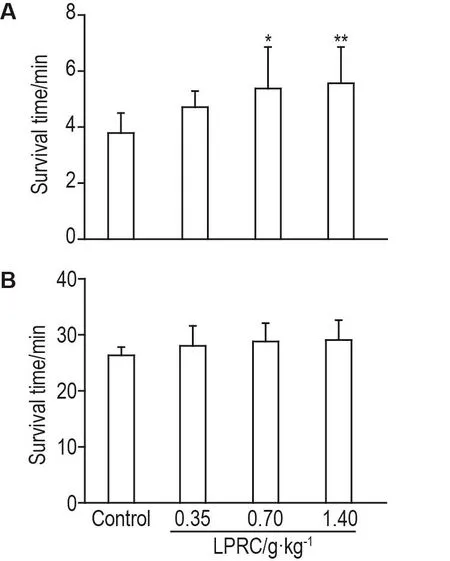
Fig.2 Effect of LPRC on survival time under gas mixture of low oxygen(A)and hypoxia in hermetic space(B)in mice.See Fig.1 for the mouse treatment.±s,n=10.*P<0.05,**P<0.01,compared with control group.
2.3 LPRC对小鼠转棒实验在棒时间的影响
学习期结果显示,随小鼠学习时间的延长,各组小鼠在棒时间均呈延长趋势,LPRC 1.40 g·kg-1组小鼠学习第2天时在棒时间显著长于对照组(P<0.05),LPRC 0.35和0.70 g·kg-1无明显影响(图3A)。测试期结果表明,连续7 d给予LPRC后,与对照组相比,LPRC 1.40 g·kg-1组小鼠在棒时间显著延长(P<0.01),LPRC 0.35和0.70 g·kg-1无明显影响(图3B)。

Fig.3 Effect of LPRC on rotarod latency in mice.See Fig.1 for the mouse treatment.The latency in learning phase(A)and test phase(B)was recorded 2 h after LPRC or saline treatment.±s,n=10.*P<0.05,**P<0.01,compared with control group.
2.4 LPRC对小鼠负重游泳时间的影响
与对照组相比,LPRC 0.70和1.40 g·kg-1可显著延长小鼠负重游泳时间(P<0.01),LPRC 0.35 g·kg-1无明显影响(图4)。
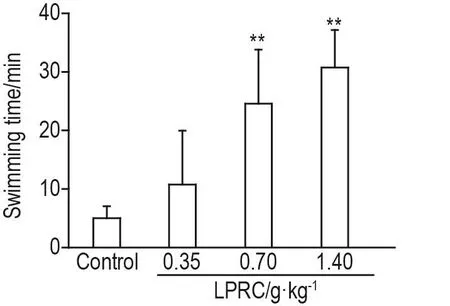
Fig.4 Effect of LPRC on weight-loaded swimming time in mice.See Fig.1 for the mouse treatment.±s,n=10.*P<0.05,**P<0.01,compared with control group.
2.5 LPRC对非负重游泳力竭小鼠肝和腓肠肌组织中糖原含量的影响
与对照组相比,LPRC 0.35,0.70和1.40 g·kg-1组游泳力竭小鼠肝糖原含量显著增加(P<0.05,P<0.01),LPRC 0.35和0.70 g·kg-1组游泳力竭小鼠肌糖原含量显著增加(P<0.05,P<0.01)(表1)。
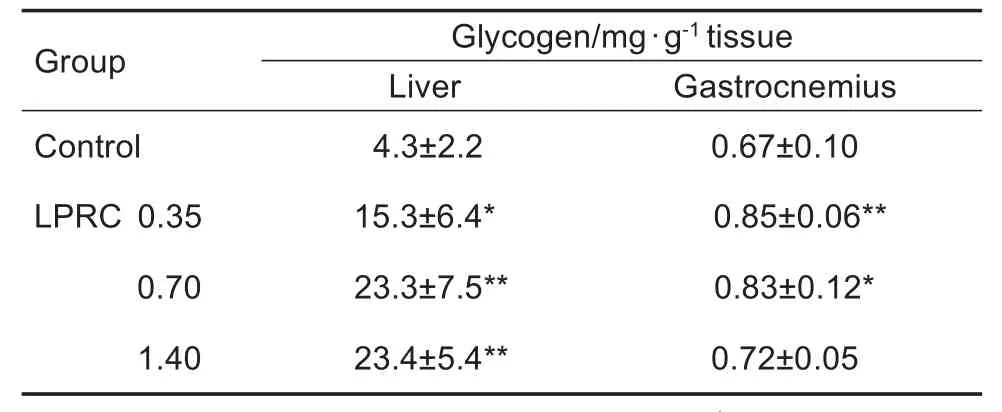
Tab.1 Effect of LPRC on glycogen levels of liver and gastrocnemius in mice after exhaustive swimming
2.6 LPRC对游泳力竭小鼠血清BUN和LA含量及LDH活性的影响
与对照组相比,LPRC 0.70 g·kg-1组BUN水平显著降低(P<0.05),LPRC 0.35,0.70和1.40 g·kg-1组LA水平均显著降低(P<0.05,P<0.01),并增强LDH活性(P<0.01)(表2)。
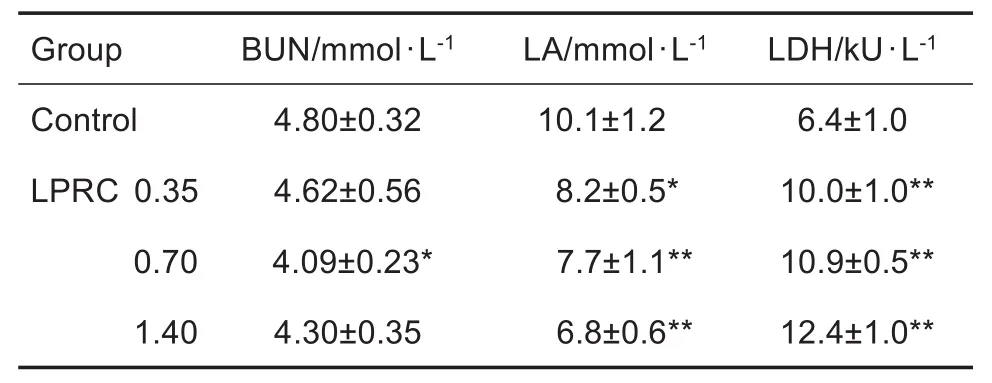
Tab.2 Effect of LPRC on levels of blood urea nitro⁃gen(BUN),lactic acid(LA)and activity of lactate dehydrogenase(LDH)in serum of mice after exhaus⁃tive swimming
2.7 LPRC对游泳力竭小鼠血清SOD和GSH-Px活性及MDA含量的影响
与对照组相比,LPRC 0.35,0.70和1.40 g·kg-1均显著增强力竭运动小鼠SOD活性,LPRC 1.40 g·kg-1显著增强GSH-Px活性并降低MDA含量(P<0.05,P<0.01)(表3)。
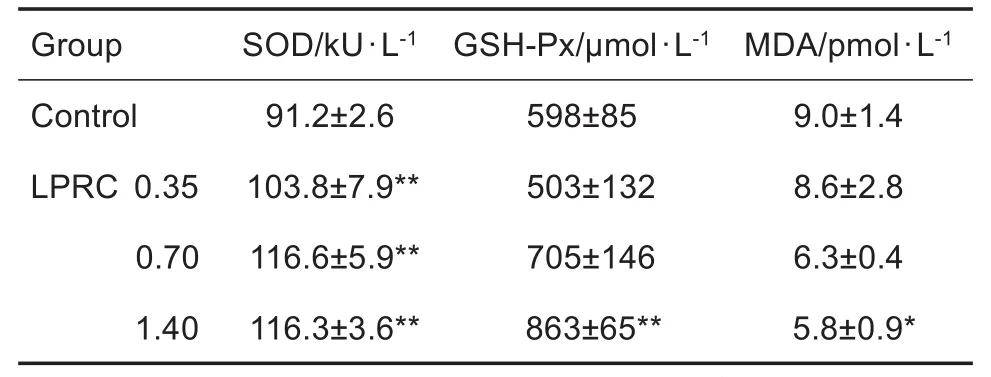
Tab.3 Effect of LPRC on activity of superoxide dismutase(SOD),glutathione peroxidase(GSH-Px)and content malondialdehyde(MDA)in serum of mice after exhaus⁃tive swimming
3 讨论
吸入气体氧分压过低是造成机体整体缺氧的重要原因,除发生于高原或高空外,也多发生于密闭环境或吸入低氧混合气体情况[22]。密闭缺氧和低氧混合气体缺氧是观察动物整体缺氧的常用方法[23]。本研究结果表明,LPRC可显著提高小鼠在低氧混合气体下的耐缺氧能力。负重游泳和转棒是评价动物疲劳耐力的经典方法。本研究结果表明,LPRC可显著提高小鼠的负重游泳时间和在棒时间,并可改善正常小鼠运动协调能力。该结果提示,LPRC具有提高小鼠耐缺氧能力和抗疲劳作用。
疲劳的病理生理机制复杂。目前关于运动性疲劳发生的理论认为,其与能量耗竭、代谢产物堆积及氧化应激等密切相关。有研究表明,运动所致的体能下降与糖原消耗同时发生,增加肝和肌糖原的储存能有效提高运动耐力[24-25]。本研究发现,LPRC能显著增加肝、肌糖原储备,与文献报道的红景天制剂作用一致[26]。机体剧烈运动时可导致LA堆积,最终引起疲劳[9,27]。LDH可减轻LA堆积,其活性可以反映药物的抗疲劳能力[28]。剧烈运动时还会导致机体蛋白质代谢终产物BUN含量升高,其水平能够反映机体对运动的耐受能力[29]。有文献报道,红景天能够清除疲劳代谢产物,发挥抗疲劳作用[30]。本研究结果表明,LPRC也具有增强LDH活性、降低LA和BUN水平的作用。机体疲劳时还可能出现氧化应激水平升高。ROS可直接影响能量供应和兴奋-收缩偶联过程中的酶活性,又能加速LA和BUN等代谢产物积累[31]。GSH-Px能将SOD催化ROS产生的过氧化氢分解成水和O2,两者是清除ROS的主要抗氧化酶[32],清除ROS是多种药物发挥抗疲劳作用的基础[33]。LPRC能显著增强小鼠抗氧化酶SOD和GSH-Px活性,并减少脂质过氧化产物MDA水平。缺氧和疲劳在机体病理生理反应上具有相似性,组织缺氧往往伴随着LA堆积和氧化应激水平增加的现象[34-35]。LPRC对LA代谢和氧化应激的调节作用可能与其提高机体耐缺氧能力及抗疲劳作用密切相关。
综上所述,LPRC可显著提高小鼠的常压耐缺氧和抗疲劳能力,其作用可能与增加糖原储备、清除代谢物堆积及增强抗氧化能力有关。本研究结果提示,将LPRC临床推荐剂量增加1倍,其提高耐缺氧及抗疲劳作用可能会增强。本研究为进一步开展其抗缺氧及抗疲劳临床研究及应用提供了实验依据。
