UPLC-MS/MS法同时测定人血浆中5种抗真菌药物的血药浓度
2021-09-04姚远卢伟吕光辉十堰市太和医院湖北医药学院附属医院儿科湖北十堰44000十堰市太和医院湖北医药学院附属医院药学部湖北十堰44000
姚远,卢伟,吕光辉*(.十堰市太和医院(湖北医药学院附属医院)儿科,湖北 十堰 44000;.十堰市太和医院(湖北医药学院附属医院)药学部,湖北 十堰 44000)
研究表明,接受骨髓移植、器官移植以及免疫抑制剂治疗的患者是真菌感染的高发人群[1]。此外,肿瘤、艾滋病、侵入性置管以及广谱抗菌药物的使用是侵袭性真菌感染的主要危险因素[2]。现阶段抗真菌药物主要包括唑类、棘白菌素类和多烯类,临床上全身给药的代表药物有伏立康唑、泊沙康唑、伊曲康唑、氟康唑和卡泊芬净[3]。
唑类抗真菌药物体内代谢特征存在个体差异,如氟康唑在肾功能不全患者或中枢神经系统真菌感染患者体内暴露量会显著增加[4];不同剂型的伊曲康唑生物利用度差异很大(胶囊和口服液生物利用度分别为55%和70%)[5];伏立康唑为非线性药动学特征,血药浓度差异很大[6];泊沙康唑在药动学方面也存在显著差异[7]。卡泊芬净为棘白菌素类抗真菌药,具有抗菌谱广、交叉耐药少以及安全性高等特点,是肝功能受损患者抗真菌药物的首选;但卡泊芬净体内药动学过程受诸多因素影响,表观分布容积改变、多器官功能衰竭以及药物间相互作用等均会导致体内血药浓度个体间差异增大,肝损伤、低白蛋白血症等同样会影响卡泊芬净血药浓度[8]。抗真菌药物也会与其他联用药物产生相互作用[9]。因此,对抗真菌药物在特殊人群中开展治疗药物监测(therapeutic drug monitoring,TDM)在药物选择和给药方案的制订中具有重要的意义。本研究选取临床中常见的抗真菌药物作为研究对象,建立同时测定5 种抗真菌药物的UPLC-MS/MS 方法,为抗真菌药物药动学/药效学(pharmacokinetics/pharmacodynamics,PK/PD)研究以及临床合理用药提供帮助。
1 仪器与试药
1.1 仪器
Waters Acquity 超高效液相色谱仪、XEVO TQ串联质谱仪[沃特世科技(上海)有限公司],纯水仪(GWAUN1,北京普析通用仪器有限责任公司),分析天平[AUW120D,岛津(上海)实验器材有限公司],涡旋混合器(VORTEX-6,海门市其林贝尔仪器制造有限公司),冷冻高速离心机(5427R,Eppendorf 公司)。
1.2 试药
伏立康唑(批号:20190522,纯度>98.0%,山东西亚化学股份有限公司),泊沙康唑(批号:K24J10M91205,纯度≥99.0%)、氟康唑(批号:J09M6B1,纯度≥98.0%)(上海源叶生物科技有限公司),伊曲康唑(批号:100631-201402,纯度:99.2%)、卡泊芬净(批号:B22D7R27470,纯度≥98.0%)、替硝唑(批号:100336-201704,纯度:99.5%)(中国食品药品检定研究院);乙腈(批号:JA031530)、甲醇(批号:L1084007014)(色谱级,Merck KGaA 公司),甲酸(色谱级,批 号:095342,MREDA TECHNOLOGY INC),水为自制超纯水。空白血浆由本院输血科提供,患者血浆来自本院各病区和检验科。
2 方法与结果
2.1 溶液的制备
2.1.1 对照品溶液 分别精密称取伏立康唑、泊沙康唑、伊曲康唑、氟康唑和卡泊芬净对照品适量,用甲醇-二甲基亚砜(50∶50,V/V)混合溶液溶解,配成质量浓度分别为1.02、1.10、1.21、4.01和1.20 mg·mL-1的对照品储备液。取适量储备液,用甲醇稀释成质量浓度分别为102.0、110.0、121.0、401.0 和120.0 µg·mL-1的混合对照品溶液。取混合对照品溶液,用甲醇稀释成系列质量浓度工作溶液(伏立康唑:10.2、5.1、2.04、1.02、0.51 和0.204 µg·mL-1,泊沙康唑:11.00、5.50、2.20、1.10、0.55 和0.22 µg·mL-1,伊曲康唑:12.10、6.05、2.42、1.21、0.605 和0.242 µg·mL-1,氟康唑:40.10、20.05、8.02、4.01、2.005 和0.802µg·mL-1,卡泊芬净:12.00、6.00、2.40、1.20、0.60和0.24 µg·mL-1)。同时采用甲醇配制质控样品溶液,氟康唑质控样品质量浓度为32.08、6.42、1.28 μg·mL-1,其他化合物质控样品质量浓度约为8.0、1.6、0.32 μg·mL-1,所有溶液置于4℃保存备用。
2.1.2 内标工作液 精密称取替硝唑对照品,加入甲醇-二甲基亚砜(V/V,50∶50)混合溶液溶解,配制成质量浓度为1.0 mg·mL-1的内标储备液。取适量储备液,采用甲醇将替硝唑稀释至质量浓度为1.0 μg·mL-1的内标工作液。
2.1.3 质控样品配制 分别精密量取“2.1.1”项下质控溶液 50 μL,氮气吹干,加入空白人血浆50 μL,涡旋2 min,制成高、中、低3 个浓度的质控样品。
2.2 色谱和质谱条件
2.2.1 色谱条件 采用Waters C18色谱柱(2.1 mm×50 mm,1.7 μm);流动相A 为0.1%甲酸水溶液,B 为乙腈溶液,梯度洗脱(0 →0.5 min,10%B;0.5 →3.0 min,10%→ 90%B;3.0 →4.0 min,90%B;4.0→4.5 min,90%→10%B;4.5→5.0 min,90%B);流速为0.3 mL·min-1;柱温为40℃;进样体积为5 μL。
2.2.2 质谱条件 采用电喷雾离子源,正离子扫描方式,多反应监测模式,脱溶剂温度为400℃,脱溶剂气流速为800 L·h-1,毛细管电压为3.0 kV,化合物质谱检测参数见表1。
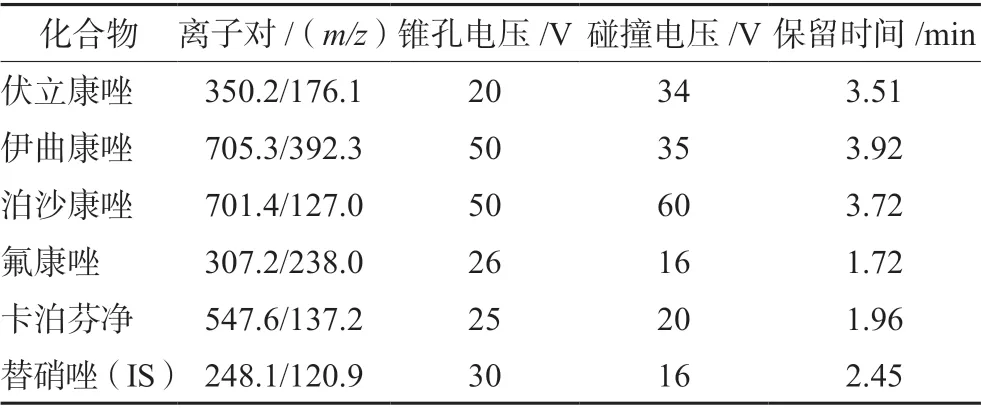
表1 5 种化合物和内标的质谱检测参数Tab 1 Mass parameters of 5 compounds and internal standard
2.3 血浆样品处理
取50 µL 血浆,加入50 µL 内标工作液,涡旋30s,加入150 µL 甲醇,涡旋2 min,14 000 r·min-1离心10 min,取上清液100 µL,加入900 µL 初始流动相,涡旋2 min,取5 µL 进样分析。
2.4 方法学考察
2.4.1 专属性 取6 份不同来源的空白人血浆,加入“2.1.1”项下混合对照品质控溶液,并将空白血浆、空白血浆+质控溶液按照“2.3”项下方法处理后进样。结果显示,不同来源的空白血清在相应色谱峰保留时间内均无干扰峰,方法特异性良好,各化合物色谱图见图1。
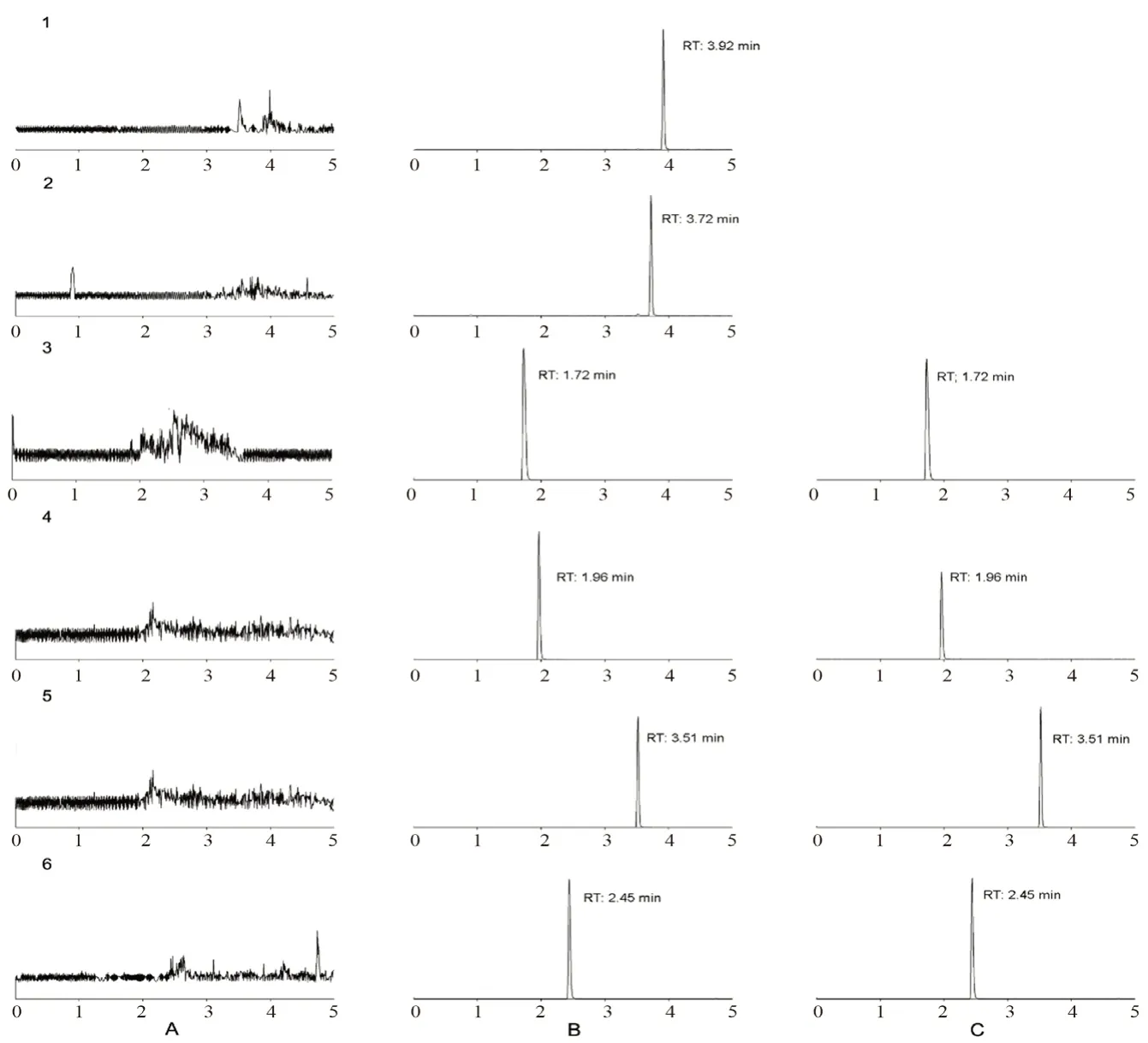
图1 各成分及内标色谱图Fig 1 Multiple reactin monitoring chromatograms of compounds and the internal standards
2.4.2 标准曲线和线性范围 取50 µL 空白血浆,分别加入50 µL “2.1.1”项下混合对照品梯度溶液和50 µL 内标工作液,按“2.3”项下条件处理,取5 µL 进样。以待测物与内标峰面积比(Y)对质量浓度(X)作线性回归,结果见表2。
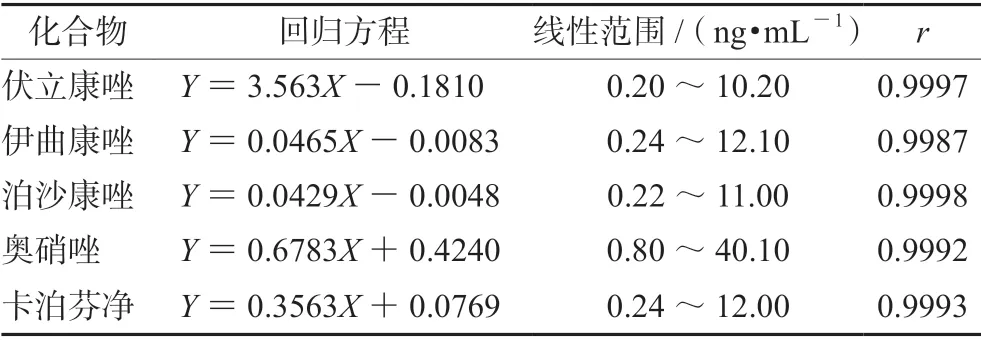
表2 5 种化学成分的回归方程、线性范围及相关系数Tab 2 Linear equation,linearity and correlation coefficient of 5 compounds
2.4.3 精密度和准确度 取高、中、低3 个浓度的质控样品,按照“2.3”项下方法于同日内制备质控样品,每个浓度平行制备5 份,连续制备3 d 并进行测定,计算准确度、日内精密度和日间精密度,结果见表3。
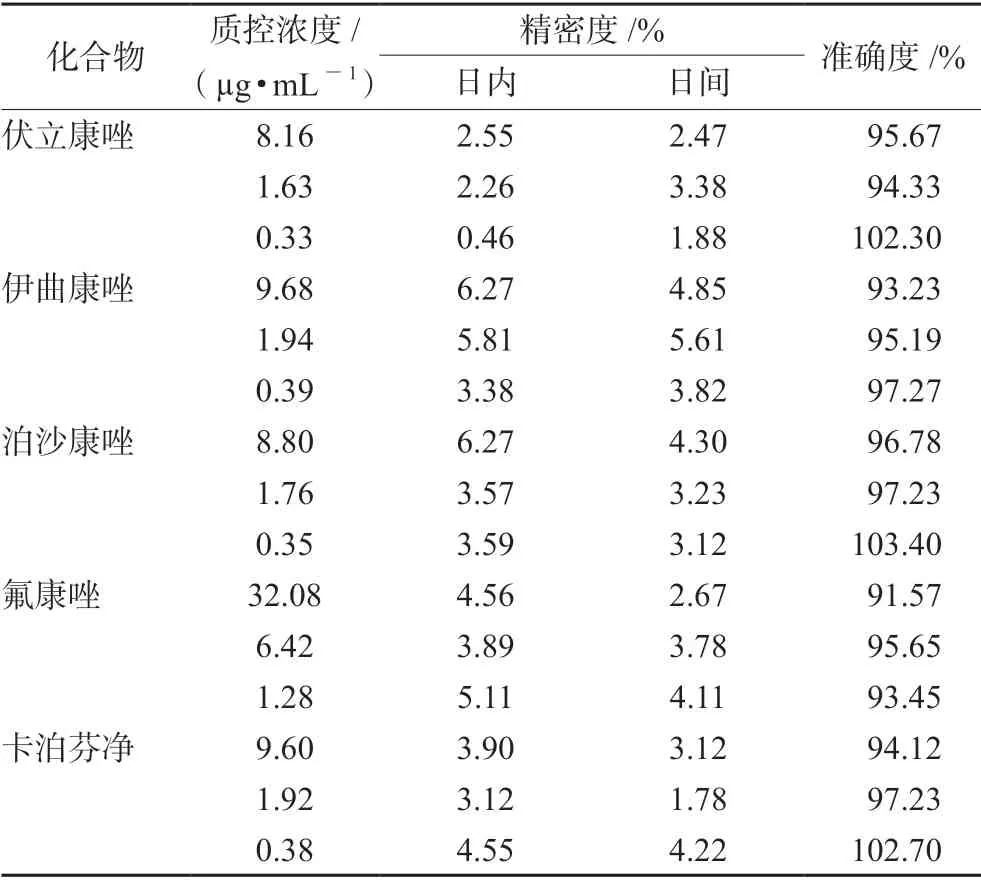
表3 5 种化合物在血浆中的精密度和准确度(n =5)Tab 3 Precision and accuracy of 5 compounds in the plasma (n=5)
2.4.4 提取回收率和基质效应 按照“2.3”项下方法分别制备高、中、低3 个浓度的质控样品,按“2.2”项下色谱条件进样分析,以对照品和内标峰面积的比值作为A1;取空白血浆按照“2.3”项下方法处理后加入3 个浓度的质控溶液,使之浓度与A1的理论浓度相同,以对照品和内标峰面积的比值作为A2;3 个浓度的质控溶液按照样品前处理方法进行处理,使之与A1的理论浓度一致,进样分析,以对照品和内标峰面积的比值作为A3。A1/A2比值为提取回收率,A2/A3比值为基质效应,结果见表4。
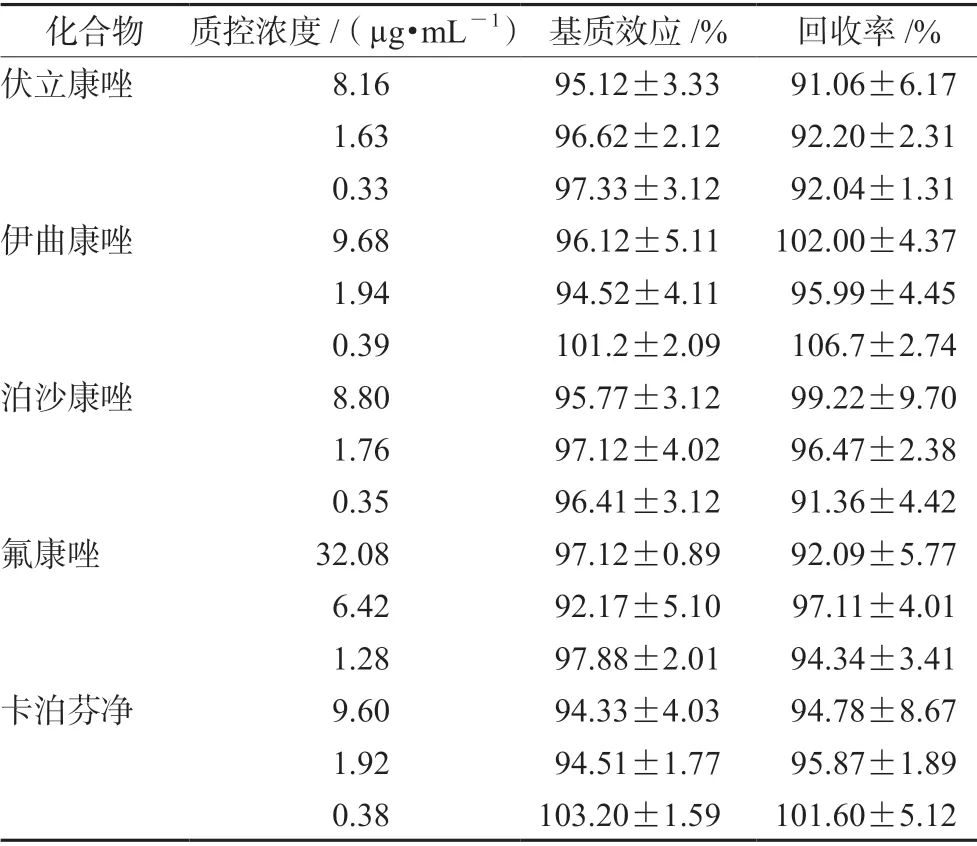
表4 5 种化合物在血浆中的基质效应和回收率(n =5)Tab 4 Matrix effect and recovery of 5 compounds in the plasma(n =5)
2.4.5 稳定性 配制高、中、低浓度质控样品,分别考察短期稳定性(室温放置6 h)、进样器中稳定性(4℃)、-20 ℃冻融循环3 次和长期稳定性(-20℃放置14 d)。结果见表5。
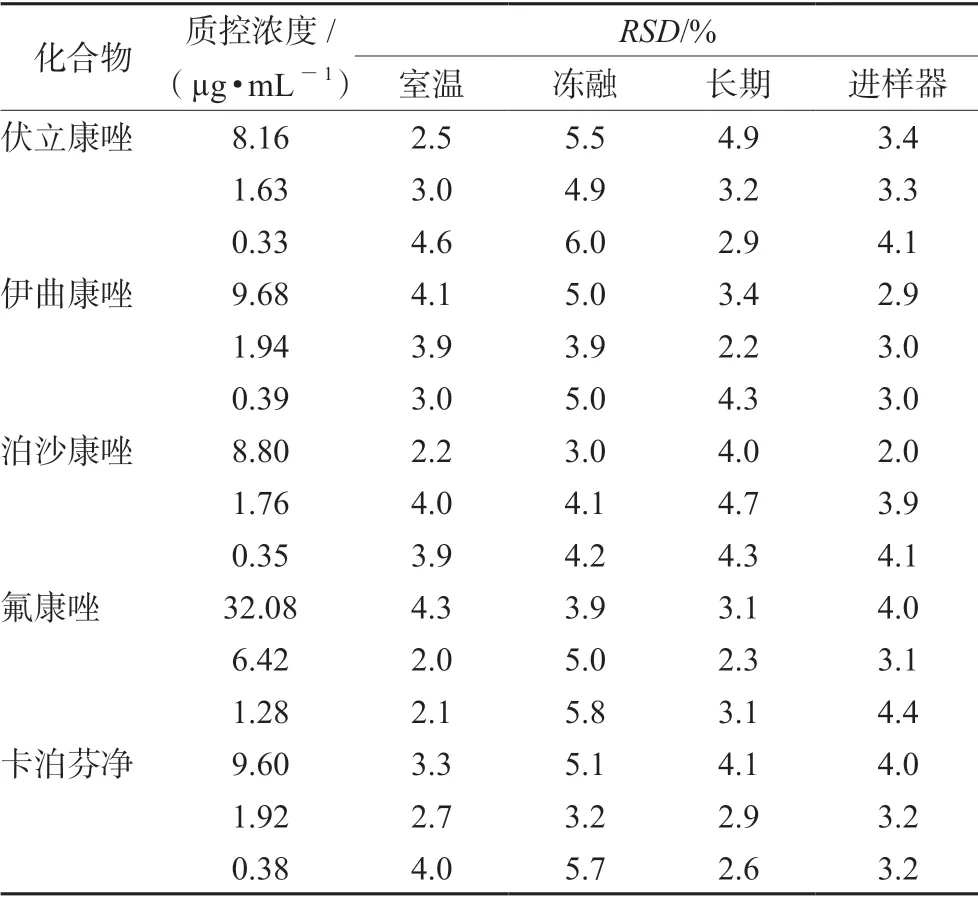
表5 5 种化合物在不同条件下的稳定性(n =5)Tab 5 Stability of 5 compounds at different storage condition (n =5)
2.5 临床应用
本研究采用建立的方法测定了2019年6月—2020年6月在本院ICU、血液科、肾病内科和呼吸科等病区中部分侵袭性真菌感染的患者使用抗真菌药物后体内药物浓度。共收集到56 例样本(男性25 例,女性31 例),其中伏立康唑32 例,氟康唑10 例,卡泊芬净14 例。研究结果显示,32 例使用伏立康唑治疗的患者中谷浓度最小值为0.54 μg·mL-1,最大值为8.91 μg·mL-1,平均谷浓度为(3.84±2.14)μg·mL-1;10 例使用氟康唑治疗的患者中谷浓度最小值为5.33 μg·mL-1,最大值为15.21 μg·mL-1, 平均谷浓度为(9.83±3.11)μg·mL-1;14 例使用卡泊芬净治疗的患者中谷浓度最小值为1.58 μg·mL-1,最大值为9.12 μg·mL-1,平均谷浓度为(5.56±2.41)μg·mL-1。从检测结果可以看出,3 种抗真菌药物在严重侵袭性真菌感染的患者中个体药动学差异较大,需密切监测血药浓度。
3 讨论
随着抗真菌药物在临床中的广泛应用,出现了越来越多耐药菌以及与抗真菌药物相关的不良反应[10]。近年来抗真菌药物PK/PD 研究概念逐渐被应用于临床[11-12],PK/PD 研究的最终目的是寻找最佳给药剂量,优化给药方案。抗真菌药物PK 研究最重要的内容是监测该类药物在患者体内的药物浓度,因此建立快速高效的血药浓度监测方法是开展PK/PD 研究的基础。
抗真菌药物血药浓度测定方法有免疫法、色谱法(HPLC)和质谱法(MS)。目前,只有伏立康唑能够采用免疫法进行检测,其他抗真菌药物尚无商业试剂盒上市。HPLC 法分析时间较长,操作复杂。随着检测技术的提高,LC-MS 法在治疗抗真菌药物监测中广泛使用,其特异性高、运行时间短并可以同时测定分析多种化学结构。本试验采用UPLC-MS 联用技术能够在5 min 内同时测定5 种常见抗真菌药物的含量,具有很高的检测效率;同时本方法只需50 µL 的血浆样品,样本需求量少,可提高监测的依存性。通过对方法特异性、线性关系、回收率等方面的验证,该方法可确保5 种抗真菌药物浓度的快速准确检测。
由于受医疗机构抗菌药物的品种和品规限制,本研究中纳入的56 样本中未使用泊沙康唑和伊曲康唑,但这两种药物检测方法的建立对其TDM 的研究同样具有重要意义。从32 例使用伏立康唑的患者监测结果中可以看出,其体内药动学个体差异较大。伏立康唑的疗效与体内药物浓度具有很强的相关性,其推荐的治疗浓度范围为1.0 ~5.5 μg·mL-1,浓度过高发生严重不良反应的可能性大大增加;卡泊芬净安全性较其他抗真菌药物高,关于人体内推荐药物浓度的研究较少,有研究报道卡泊芬净的血药谷浓度应维持在1 μg·mL-1以上[13]。氟康唑作为上市最早的三唑类抗真菌药,具有口服和注射两种给药途径,目前不推荐氟康唑进行常规的TDM 监测;有研究显示抗真菌治疗时氟康唑血药谷浓度在10 ~15 μg·mL-1时治疗效果较好,同时不良反应较少[14]。本试验发现,3种抗真菌药物在严重感染患者中药物浓度差异较大,可能与患者疾病和合并用药情况有关,特别是在严重肝功能受损和低蛋白血症患者中,其药物浓度明显增加。对56 例严重侵袭性真菌感染患者抗菌药物体内药物浓度结果的分析发现,在这类人群中开展抗真菌药物浓度监测对提高患者用药安全和疗效具有很好的促进作用。
