毛竹铵态氮转运蛋白的分子特征及基因表达模式*
2021-09-04袁婷婷朱成磊杨克彬宋新章高志民
李 真 袁婷婷 朱成磊 杨克彬 宋新章 高志民
(1.国际竹藤中心竹藤资源基因科学与基因产业化研究所 国家林业和草原局/北京市共建竹藤科学与技术重点实验室 北京 100102;2.浙江农林大学 杭州 311300)
在细菌、真菌和植物中发现700多个AMT同源蛋白(Xuanetal.,2017)。拟南芥AMT分为2个亚家族,其中AMT1亚家族AtAMT1;1、AtAMT1;3和AtAMT1;5编码的蛋白参与高亲和性铵转运系统,AtAMT1;2编码的蛋白参与低亲和性铵转运系统,并推测其参与质外体途径运输(Loqueetal.,2006)。水稻(Oryzasativa)、玉米(Zeamays)等单子叶植物AMT也分为2个亚家族,但其AMT2亚家族成员的数量远多于双子叶植物AMT2亚家族(Guetal.,2013)。水稻OsAMT1;1、OsAMT1;2和OsAMT1;3均在根中表达,OsAMT2;1则在芽中大量表达(Sonodaetal.,2003;Suenagaetal.,2003)。玉米ZmAMT1;1a和ZmAMT1;3b编码的蛋白在根和叶中表现出高铵转运活性,ZmAMT1;1b则在叶鞘中特异性表达(Dechorgnatetal.,2019)。尽管对拟南芥、水稻和玉米等植物中AMT已有深入研究,但竹子中AMT的研究却鲜有报道,其对铵态氮的吸收、运输的分子机制尚不清楚。
竹子是世界上生长最快的植物之一,快速生长的特性赋予其具有高效吸收矿质元素并快速同化的能力。毛竹(Phyllostachyedulis)是我国原产最具特色的经济竹种,分布广面积大(467.78万hm2),占我国竹林总面积的72.96%(李玉敏等,2019)。在毛竹林爆发式生长时期,毛竹各器官营养元素质量分数快速增加,并在6—7月毛竹快速生长阶段完成后达到最高峰,其中氮元素的积累量最高,占营养元素总量的58%(曾莹莹等,2015)。另外,毛竹林下土壤氮矿质化的氨化比例较高(刘琦蕊,2016),尤其是生长早期的幼竹对铵态氮具有偏向吸收性(王兴萌等,2019),因此铵态氮环境能满足毛竹快速生长对氮素的需求,对毛竹快速生鞭扩张、发笋成林至关重要。为此,本研究以毛竹为对象,从全基因组水平对其AMT的分子特征进行系统分析,并研究AMT基因在不同组织中以及不同激素和非生物胁迫处理后的表达模式,为深入研究AMT功能、筛选具有育种价值的AMT基因提供参考。
1 材料与方法
1.1 植物材料培养与处理
将毛竹种子播种于基质[泥炭︰蛭石(V/V)=3︰2]中,置于25 ℃的温室中培养,待实生苗生长至2个月大小,选择株高和长势相似的植株用20% PEG-6000溶液进行模拟干旱处理,分别在处理0、3、6、12 h时收集植株根系样品,液氮处理后保存于-80 ℃,以备用于RNA提取,进行定量PCR(qPCR)分析。
1.2 毛竹AMT的全基因组鉴定
从NCBI下载拟南芥和水稻的AMT氨基酸序列和核苷酸序列(Haoetal.,2020),在毛竹基因组数据库BambooGDB(http:∥bamboo.bamboogdb.org/)中进行Blast比对查询,并用NCBI的CDD工具确定铵转运结构域的准确性和完整性。利用在线软件protparam(https:∥web.expasy.org/protparam/)和ProtComp 9.0(http:∥linux1.softberry.com/berry.phtml)进行毛竹AMT蛋白的理化性质和亚细胞定位预测,并利用TMHMM Server v 2.0(http:∥www.cbs.dtu.dk/services/TMHMM/)和Phobius(http:∥phobius.sbc.su.se/)分别对毛竹AMT蛋白进行拓扑结构和信号肽预测。
1.3 毛竹AMT家族成员系统发育与结构分析
利用MEGA Ⅹ完成,采用Muscle进行多序列比对,基于p-distance模型采用邻接法(neighbor-joining method)生成系统进化树,对gap和缺失的序列选择成对比对删除(pairwise deletion),bootstrap设置为1 000;通过GSDS(http:∥gsds.cbi.pku.edu.cn/)进行基因结构分析,选择转录本上游2 kb的序列作为启动子序列,从PlanCARE数据库查找顺式作用元件;利用MEME V5.1.1(http:∥meme-suite.org/)进行保守基序分析,并用TBtools(Chenetal.,2020)进行可视化处理。
1.4 毛竹AMT基因的表达分析
依据本实验室的转录组数据(Zhaoetal.,2018)构建毛竹AMT基因的组织表达谱,以Log2(FPKM)的值进行表达量热图绘制。通过文献从NCBI Short Read Archive(https:∥www.ncbi.nlm.nih.gov/sra/)获取毛竹不同激素和非生物胁迫处理的转录组数据,包括2个月毛竹幼苗全株经100 μmol·L-1赤霉素(GA3)溶液处理4 h(SRR6131113-SRR6131118)(Zhangetal.,2018),1个月毛竹幼苗全株经5 μmol·L-1生长素(NAA)处理4 h(SRS2294012-SRS2294017)(Wangetal.,2017),18天毛竹幼苗经10 μmol·L-1油菜素内酯合成抑制剂(propiconazole,PPZ)处理5天后再用1 μmol·L-1油菜素内酯(brassinolide,BL)处理4 h的根(SRS4136433-SRS4136450)(Zhangetal.,2020),2年生毛竹实生苗经低温和干旱处理2 h的叶片(SRS1759772)(Huangetal.,2016)。从转录组数据中获取PeAMTs的表达量数据,以Log2(FPKM)的值进行表达量热图绘制,选择单因素方差分析中表达差异显著(P<0.05)的基因,采用Log2(FPKM+1)计算基因表达量并绘制折线图。
根据毛竹AMT基因序列,使用Primer Premier 5.0软件设计特异定量引物,由生工生物工程(上海)股份有限公司合成(表1)。用于qPCR分析的cDNA源自1.1中干旱处理不同时间的毛竹根系,通过TRIzol(Invitrogen)法从中提取RNA,用Promega反转录试剂盒合成cDNA。qPCR试验在qTOWER2.2系统上进行,体系参照Roche Light Cycler®480 SYBR Green 1 Master kit试剂盒,程序为95 ℃预变性10 min;95 ℃变性10 s,60 ℃解链10 s,40个循环。选择PeNTB作为内参基因(Fanetal.,2013),相对表达量的数据处理用2-ΔΔCt法(Livaketal.,2001)。

表1 qPCR所用引物Tab.1 Primers used in qPCR
2 结果与分析
2.1 毛竹AMT家族基因的鉴定与基因结构分析
在毛竹基因组数据库BambooGDB鉴定出13个基因编码完整的AMT蛋白,命名为PeAMT1-PeAMT13。PeAMTs的编码区长度为1 224~1 491 bp,编码蛋白长度为408~497个氨基酸(aa),分子量(molecular weight,MW)为52.25~53.08 kDa,理论等电点(pI)介于6.58~8.86之间,亚细胞定位预测均位于质膜上。拓扑结构预测显示,PeAMTs编码蛋白属于跨膜蛋白,除PeAMT13有9个跨膜区(transmembrane,TM)外,其余成员均有11个跨膜区。此外,PeAMT1、PeAMT2和PeAMT3的N端均具有信号肽(signal peptide,SP)(表2)。
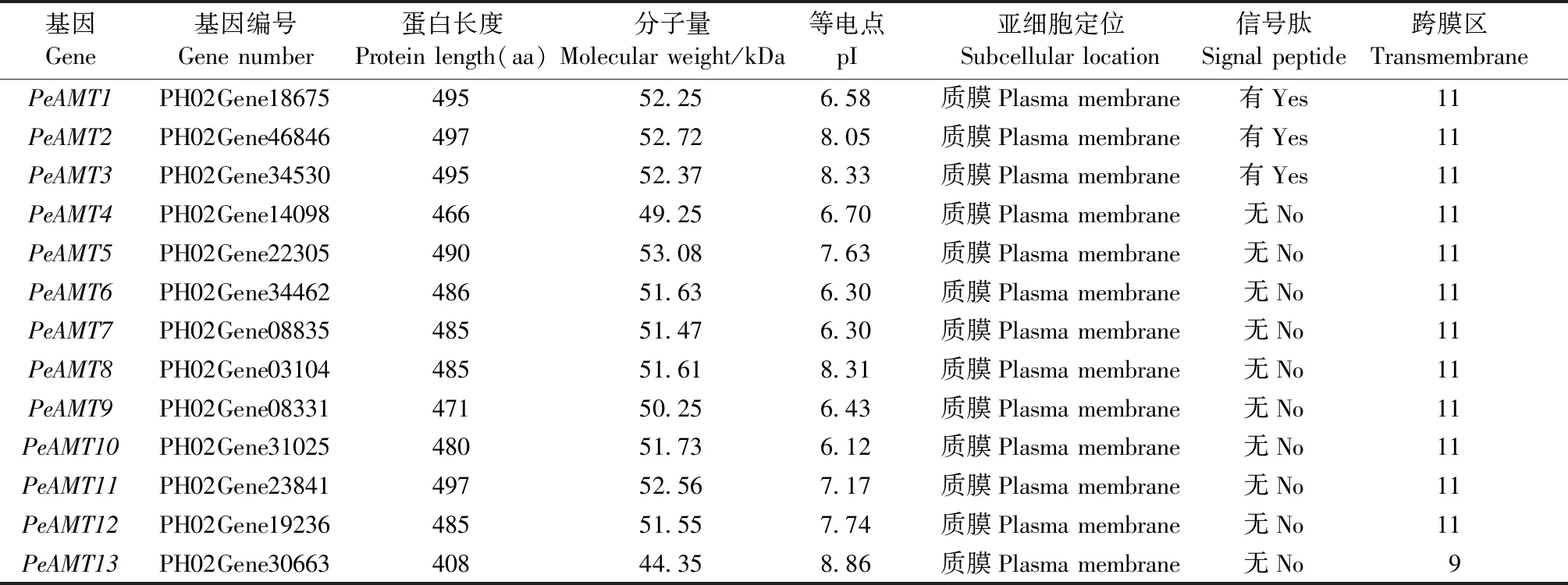
表2 PeAMTs编码蛋白的基本特征Tab.2 Basic characteristics of the proteins encoded by PeAMTs
对PeAMTs上游启动子序列分析发现,其中包含多种作用元件,如MYB、MYC转录因子结合的顺式作用元件,赤霉素、生长素、茉莉酸和脱落酸等激素响应元件以及干旱、低温和缺氧等非生物胁迫响应元件(图1A)。基因结构分析发现,PeAMT1、PeAMT2和PeAMT3不含内含子;PeAMT4和PeAMT5含有1个内含子;PeAMT6-PeAMT12均含有2个内含子,但内含子长度差异较大;PeAMT13内含子最多(3个)(图1B)。
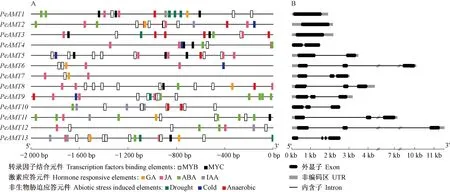
图1 PeAMTs启动子(A)和基因结构(B)分析Fig.1 Promoter(A)and gene structure(B)analysis of PeAMTs
2.2 PeAMTs的系统发育分析
为了分析不同物种之间AMT的进化关系,对PeAMTs的潜在功能做出合理推测,构建了基于毛竹、水稻、玉米、拟南芥和番茄(Lycopersiconesculentum)AMT蛋白氨基酸序列(Haoetal.,2020)的系统进化树(图2A)。结果表明,AMT成员分成了AMT1和AMT2两个亚家族,双子叶植物AMTs主要分布在AMT1亚家族中,单子叶植物AMTs主要分布在AMT2亚家族中,其中毛竹与水稻的AMT同源性最高,其次是玉米。PeAMTs属于AMT2亚家族的成员有10个,而AMT1亚家族中仅有3个成员。AMT2亚家族又聚类为3个组,仅AMT2a组中有双子叶植物AMT成员,该组包括3个PeAMTs,大部分PeAMTs成员(6个)属于AMT2b组,AMT2c组仅有PeAMT4一个毛竹成员。
为解析PeAMTs的基因进化情况,将PeAMTs定位到scaffold上并与水稻基因组进行共线性分析(图2B)。结果发现13个PeAMTs分布在11个scaffold上,其中10个基因组成8个共线性基因对,同属于AMT1亚家族的PeAMT1、PeAMT2和PeAMT3,以及同属于AMT2a组的PeAMT8、PeAMT11和PeAMT12分别彼此呈现共线性,而PeAMT4、PeAMT5和PeAMT6不具有共线性基因对。对毛竹共线性基因对进行Ka/Ks(非同义替换率/同义替换率)分析,发现全部Ka/Ks均小于1,说明毛竹AMT家族基因在进化上的保守性,全部经历了纯化选择。另外,有11个PeAMTs与8个OsAMTs之间存在共线性,包括AMT1亚家族的PeAMT1、PeAMT2和PeAMT3与OsAMT1;1和OsAMT1;2,AMT2a组的PeAMT8、PeAMT11和PeAMT12与OsAMT2;1和OsAMT2;2,这2个分支的OsAMTs分别为根部表达的铵诱导型转运体(Sonodaetal.,2003)和根芽组成型表达转运体(Suenagaetal.,2003)。具有共线性的PeAMTs数量多于OsAMTs数量,推测与毛竹进化过程中发生过基因组加倍事件有关,PeAMTs数量增加可能是毛竹为提高环境适应能力和快速生长需求而形成的。
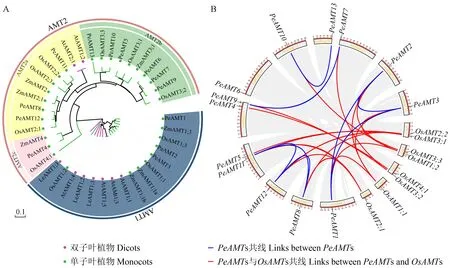
图2 AMT家族成员的系统发育分析Fig.2 Phylogeny analysis of AMT family membersA:基于AMT氨基酸序列构建的系统进化树,包括毛竹(Pe)、水稻(Os)、玉米(Zm)、拟南芥(At)、番茄(Le)的AMT氨基酸序列;B:毛竹与水稻的AMT家族基因共线性分析。A:Phylogenetic tree constructed by using the amino acid sequences of AMTs from Phyllostachys edulis (Pe),Oryza sativa (Os),Zea mays (Zm),Arabidopsis thaliana (At)and Lycopersicon esculentum (Le);B:Collinearity analysis of AMT family genes between Phyllostachys edulis and Oryza sativa.
2.3 PeAMTs蛋白保守基序分析
为深入了解PeAMTs蛋白序列的结构特性,对其氨基酸序列进行保守基序分析,共获得12个保守基序(图3A)。其中Motif 1-Motif 5和Motif 9是PeAMTs共有的基序,AMT1亚家族成员特有的基序为Motif 6和Motif 12,AMT2亚家族成员特有的基序为Motif 7、Motif 8、Motif 10和Motif 11。Motif 6位于PeAMT1、PeAMT2和PeAMT3蛋白序列的N端,与其信号肽序列位置一致,推测Motif 6与AMT的转移和定位有关。PeAMTs共有的Motif 2中包含了AMT典型保守序列D-[FYWS]-[AS]-G-[GSC]-x(2)-[IV]-x(3)-[SAG](2)-x(2)-[SAG]-[LIVMF]-x(3)-[LIVMFYWA](2)-x-[GK]-x-R(Khademietal.,2004),但AMT2b的4个PeAMTs存在单个氨基酸差异,其中PeAMT6、PeAMT7和PeAMT9保守基序中第3位的丝氨酸(S)变为与其结构相似的半胱氨酸(C),PeAMT13保守基序最后一位则由赖氨酸(K)代替了原来的精氨酸(R)(图3B),这些差异可能是进化过程中碱基突变造成的,个别氨基酸的变化可能是导致其功能差异的重要原因之一。
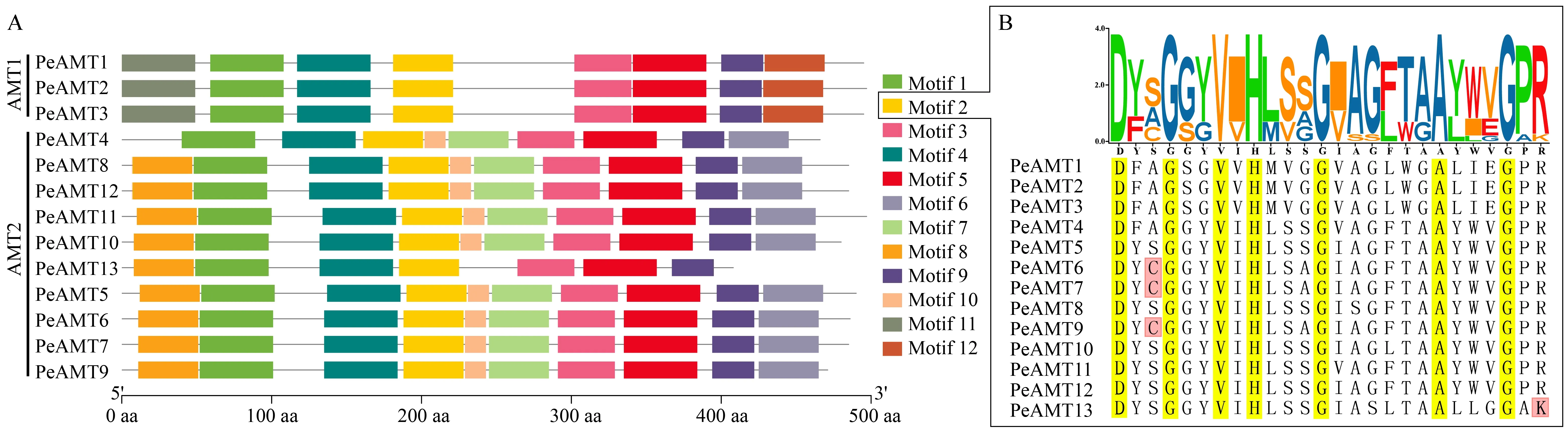
图3 PeAMTs保守基序分析Fig.3 Conserved motifs analysis of PeAMTsA:PeAMTs保守基序的分布;B:不同PeAMTs中Motif 2的氨基酸序列。A:Distribution of conserved motifs;B:Amino acid sequences of Motif 2 in different PeAMTs.
2.4 PeAMTs的组织特异性表达
基因的组织特异性表达一定程度上能反映该基因发挥作用的位置,基于毛竹26个组织的转录组数据,分析了13个PeAMTs在其中的转录水平。结果发现,各PeAMTs成员的表达模式存在着一定的差异,总体来讲PeAMTs在根部的表达水平均较高,但在芽中的表达水平均较低;发育初期笋中PeAMTs表达水平高于发育后期笋;叶和箨片中PeAMTs表达水平较高(图4)。进一步分析发现,AMT1亚家族和AMT2a组成员的表达水平高于其他成员,其中AMT1亚家族成员更倾向于在根中高表达,AMT2a组成员更倾向于在叶片中高表达且在生长初期笋中也有一定程度表达,这与同分支OsAMTs的组织表达特性相似(Suenagaetal.,2003;Sonodaetal.,2003);AMT2b组的PeAMT6和PeAMT7在箨片中高表达,PeAMT9则表现出根部表达的倾向。PeAMTs在不同组织的表达差异,反映了不同PeAMTs在毛竹生长发育过程中的生物学功能存在一定的差异,推测PeAMT1、PeAMT2和PeAMT3主要参与根部的铵转运活动,PeAMT8、PeAMT11和PeAMT12主要参与叶片和发育初期笋的铵转运活动,它们在毛竹快速生长过程中对铵盐的获取和转移可能发挥着重要作用。
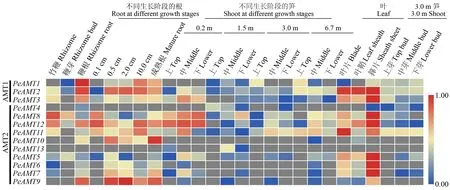
图4 PeAMTs在毛竹不同组织中的表达分析Fig.4 Expression analysis of PeAMTs in different tissues of Moso bamboo
2.5 PeAMTs对激素处理和非生物胁迫的应答
启动子顺式作用元件分析表明,PeAMTs可能响应激素和非生物胁迫的诱导。为明确PeAMTs在不同激素和非生物胁迫处理下的表达变化,利用转录组数据对PeAMTs进行了表达分析。结果表明,经GA3处理4 h后,除PeAMT13外的12个PeAMTs的表达呈现显著变化(P<0.05),其中PeAMT1、PeAMT2和PeAMT3的表达水平远高于其他成员;大部分PeAMTs在GA3处理后表达上调,而PeAMT1、PeAMT10和PeAMT12的表达显著下调(图5A)。经NAA处理4 h后,有6个PeAMTs的表达出现显著变化(P<0.05),其中PeAMT4显著下调,其他成员显著上调(图5B)。经油菜素内酯合成抑制剂(PPZ)处理5天后,PeAMT1的表达显著上调,PeAMT9和PeAMT10的表达显著下调(P<0.05),随后经油菜素内酯处理4 h,大多数PeAMTs的表达恢复到PPZ处理前相似的水平(图5C)。这些结果表明,PeAMTs受多种激素的诱导,但不同PeAMTs对不同激素的响应存在差异。
经2 h的低温胁迫处理后,有6个PeAMTs的表达水平呈现显著变化,其中PeAMT5、PeAMT11和PeAMT12的上调达到极显著水平(P<0.01),PeAMT2是唯一显著下调的成员(P<0.05);低温胁迫下,PeAMT11和PeAMT12的表达水平最高,其次是PeAMT3、PeAMT5和PeAMT2,其他成员均呈低水平表达(图5D)。干旱处理2 h后,有8个PeAMTs的表达水平呈现显著变化,其中PeAMT10显著下调,其他成员均上调(P<0.05);干旱处理下PeAMT2和PeAMT3的表达水平最高,其次是PeAMT7、PeAMT11和PeAMT12(图5E)。PeAMTs在不同非生物胁迫中的表达变化差异,表明其在逆境中将发挥不同的作用。
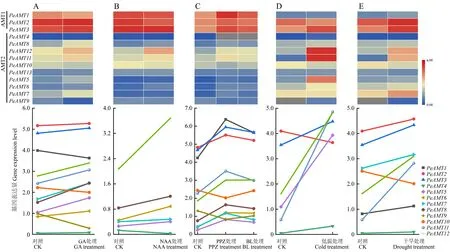
图5 不同处理前后PeAMTs在毛竹中的表达分析Fig.5 Expression analysis of PeAMTs in Moso bamboo under different treatmentsA:GA3处理幼苗;B:NAA处理幼苗;C:油菜素内酯合成抑制剂——丙环唑(PPZ)和油菜素内酯(BL)处理幼苗的根;D:低温处理叶片;E:干旱处理叶片。A:Young seedlings treated with GA3;B:Young seedlings treated with NAA;C:Roots of young seedlings treated with propiconazole(PPZ)and brassinolide(BL);D:Leaves treated with cold;E:Leaves treated with drought.
2.6 关键PeAMTs在干旱处理下的表达模式
结合其他物种已鉴定AMT成员的铵转运特性和PeAMTs的组织表达特性分析发现,PeAMT1、PeAMT2和PeAMT3倾向在根中表达,且在不同激素和非生物胁迫处理下均表现为较高表达丰度,因此认为这3个基因可能在毛竹根系吸收铵态氮过程中具有重要作用。在不同梯度的模拟干旱处理下,毛竹根中基因定量分析结果显示,PeAMT1、PeAMT2和PeAMT3的表达均受到诱导,其中PeAMT1和PeAMT2的表达随着处理时间增加呈先上升再下降的变化,而PeAMT3则表现为持续上升趋势(图6)。在处理3 h后,PeAMT1表达迅速上调达到峰值,约是处理前的3.35倍,随后开始缓慢下调,12 h后的表达仍高于处理前水平(图6A);PeAMT2的表达在处理6 h后达到峰值,约是处理前的3.85倍,在12 h时的表达仍维持较高水平(图6B);PeAMT3的表达持续上升,在处理12 h后达到最高,是处理前的23.34倍(图6C)。因此,认为毛竹中这3个基因对干旱均较为敏感,在干旱处理后能迅速响应。
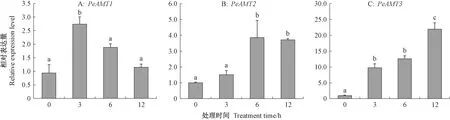
图6 干旱处理下关键PeAMTs在毛竹根中的表达分析Fig.6 Expression analysis of key PeAMTs in roots of Moso bamboo under drought treatment不同小写字母表示表达水平差异显著(P<0.05)。Different lowercase letters indicate significant difference of expression level(P<0.05).
3 讨论
PeAMTs在进化中发生了基因加倍。通过对毛竹AMT家族的全基因组分析,鉴定出13个PeAMTs,其中3个成员属于AMT1亚家族,10个成员属于AMT2亚家族(图2A)。AMT1亚家族和AMT2亚家族之间的成员数量在不同物种中的差异较大。单子叶植物中,AMT2亚家族成员显著多于AMT1亚家族成员(Suenagaetal.,2003;Guetal.,2013),双子叶植物中,AMT1亚家族成员较多或2个亚家族成员数量相似(Ninnemannetal.,1994;Santosetal.,2017)。2个亚家族在单子叶植物和双子叶植物之间的数量差异,意味着2个亚家族在单子叶和双子叶植物分化后,分别发生了不同的基因加倍事件(Von Wittgensteinetal.,2014)。共线性分析发现,部分PeAMTs存在3个旁系同源基因相互共线的现象,共线性基因PeAMT1、PeAMT2和PeAMT3在毛竹根部高表达,共线性基因PeAMT8、PeAMT11和PeAMT12在毛竹叶片中高表达(图4),而毛竹在700万~1 200万年前经历过全基因组加倍事件(Pengetal.,2013),因此这些PeAMTs很可能是为了适应快速生长过程中的铵盐获取而发生加倍。
PeAMTs的结构影响其生物学功能。对PeAMTs编码蛋白的保守基序分析证明了进化分支的可靠性,同一亚家族的成员共享多个保守基序,不同亚家族成员具有其特有的保守基序,特有保守基序可能决定了PeAMTs的功能特性。保守基序Motif 2中包含了铵转运蛋白的典型序列(图3B),该序列在植物中广泛存在,在大肠杆菌中被认为是转运铵态氮的关键基序,可能涉及铵离子通道的打开与闭合(Khademietal.,2004)。在PeAMTs启动子上发现了大量MYB和MYC结合元件,表明转录调控在毛竹N吸收同化的过程中具有重要作用。OsIDD10编码的转录因子能与OsAMT1;2启动子结合激活其表达,但在OsIDD10敲除突变体中,OsAMT1;2的转录依然存在,表明了其他转录因子对OsAMT1;2的调控作用(Xuanetal.,2013)。研究表明红藻(Cyanidioschyzonmerolae)CmMYB1与CmAMT存在共表达(Imamuraetal.,2009),欧洲赤松(Pinussylvestris)PtMYB1和PtMYB4能与氮同化相关的基因互作(Gomez-Maldonadoetal.,2004),但毛竹中MYB转录因子与AMT表达的关系仍有待研究。
PeAMTs的表达具有组织特异性并受激素和环境因子的影响。基于毛竹不同组织的转录表达谱分析表明,PeAMTs具有明显的组织表达特异性,多数PeAMTs呈现根和叶中表达的倾向,与水稻和拟南芥等植物中AMT基因的表达模式相似(Sonodaetal.,2003;Suenagaetal.,2003;Loqueetal.,2006),说明PeAMTs在根部铵盐吸收、叶片铵盐运输以及根到笋的铵盐运输过程中发挥重要作用。研究发现,番茄叶片中LeAMT1;2和LeAMT1;3的表达在昼夜间表现出相反的变化,表明其在光呼吸过程中发挥着不同的作用(Von Wirenetal.,2000),这为解释PeAMTs的功能提供了参考依据。非生物胁迫和外源激素是影响AMT基因表达的重要因素。干旱胁迫下楸子(Malusprunifolia)MpAMT1;2和MpAMT4;2的表达上调,认为铵态氮可能在改善楸子抗旱性中发挥重要作用(Huangetal.,2018);过表达星星草(Puccinelliatenuiflora)PutAMT1;1增强了转基因拟南芥对甲基铵的敏感性(Buetal.,2019);ABA和MeJ处理均能使杜梨(Pyrusbetulaefolia)PbAMT1;5的表达上调(Lietal.,2016),但其他激素影响AMT基因表达的研究却鲜有报道。本研究表明,PeAMTs对激素和非生物胁迫信号的响应存在着一定的差异(图5),其中PeAMT1、PeAMT2和PeAMT3对干旱胁迫均具有敏感性(图6)。
另外,环境供氮水平影响AMT基因表达和植物生长。研究表明,氮供应通过影响铵态氮下游同化产物谷氨酰胺的含量来调控AMT基因的表达,但氮饥饿与氮添加对不同AMT基因的诱导存在差异。如氮饥饿后玉米根部ZmAMT1.1A下调,ZmAMT2.1和ZmAMT3.2上调,但重新添加氮源后,ZmAMT1.1A和ZmAMT3.2恢复到对照水平,而ZmAMT2.1依然维持较高水平表达(Dechorgnatetal.,2019);铵盐浓度升高会导致小麦(Triticumaestivum)产生严重的毒性症状,生物量积累显著下降,氮饥饿以及向饥饿小麦幼苗再供应铵均能触发TaAMT1s表达的增加,而硝酸盐的存在则抑制了它们的表达(Ijatoetal.,2020);地钱(Marchantiapolymorpha)MpAMT1;2也在缺氮条件下表达上调,这与AMT基因对氮的亲和性有关(Guoetal.,2018);高铵浓度下AtAMTs能通过主动运输将铵离子从细胞内转运到细胞外,发挥解毒功能(Loqueetal.,2007);过量表达PbAMT1;5显著增加了转基因拟南芥的生物量(Buetal.,2019),说明AMT通过铵转运影响植物生长。因此,PeAMTs对不同氮水平的响应模式有待进一步证实。
4 结论
本研究从毛竹全基因组中鉴定出13个PeAMTs,它们分别属于2个亚家族,不同亚家族含有特异的保守基序,可能具有不同的铵转运特性。多数PeAMTs在根部和叶片中呈现高表达,这与毛竹快速生长过程中需要从土壤中吸收大量的氮素并运输到叶片中同化相一致。PeAMTs的表达受多种激素和非生物胁迫的影响,其中GA3、BL和干旱能引起大多数PeAMTs表达的显著变化,尤其是PeAMT1、PeAMT2和PeAMT3受干旱诱导,可能在毛竹抗旱和铵解毒中发挥着重要作用。本研究为解析PeAMTs在毛竹快速生长过程中的氮转运机制,以及逆境胁迫中毛竹的自我保护和铵解毒机制提供了重要参考依据。
