芥蓝Aux/IAA家族基因生物信息学与表达分析
2021-07-10王尤轩王梦雨李煜博陶晗夏楚楚黄凯美汪俏梅
王尤轩,王梦雨,李煜博,陶晗,夏楚楚,黄凯美,汪俏梅*
(1.浙江大学农业与生物技术学院园艺系/农业农村部园艺植物生长发育与品质控制重点开放实验室,杭州 310058;2.杭州市农业技术推广中心,杭州 310017)
植物激素生长素(indole-3-acetic acid,IAA)在调控植物生长发育和响应非生物胁迫中发挥着重要作用,解析生长素调控的分子网络,以及生长素与其他植物激素互作调节植物生理反应的分子机制,是植物激素领域较受关注的研究方向[1]。Aux/IAA 蛋白、生长素受体转运抑制响应蛋白(transport inhibitor response protein 1, TIR1)和生长素响应因子(auxin response factor,ARF)在生长素的信号转导过程中发挥着关键作用[2]。其中,Aux/IAA 蛋白半衰期短,与生长素早期的功能诱导表达存在密切联系[3]。在低浓度的生长素环境中,ARF 和Aux/IAA蛋白形成异源二聚体[4],并和TPL(topless)蛋白[5]、组蛋白去乙酰化酶(histone deacetylases, HDACs)结合,遏制ARF 对生长素的响应;在高浓度的生长素环境中,生长素和TIR1受体结合,生成的SCFTIR1复合物通过泛素化打破Aux/IAA 蛋白和ARF 蛋白形成的二聚体,同时,蛋白酶降解Aux/IAA 蛋白使ARF重新获得活性[6]。
近年来的研究发现,Aux/IAA基因家族有着重要的生物学功能,如参与植物应对生物胁迫和干旱等非生物胁迫以及激素响应。在模式植物拟南芥中,IAA5、IAA6和IAA19阻遏蛋白通过特异性调控脂肪族芥子油苷表达来影响植物的耐旱性[7];而IAA8 与ARF6/ARF8 蛋白结合,通过调控茉莉酸途径影响植物的开花和发育[8]。在番茄果实发育的早期,Sl-IAA9/SIARF7复合体和赤霉素生物合成途径抑制蛋白SlDELLA 共同抑制下游EXP5基因的表达[9];Sl-IAA27则可以调控NSP1进而影响独脚金内酯的合成[10]。此外,OsIAA11可以促进水稻侧根发育[11],而桃果实中Aux/IAA与成熟期呼吸跃变关系密切[12]。虽然Aux/IAA基因家族的功能在一些作物中得到解析,但其在芸薹属蔬菜中的鉴定和功能分析研究较少。
芥蓝(Brassica oleraceavar. alboglabraBailey)是一种以花薹或嫩叶为食用部位的甘蓝类蔬菜。作为一种中国特有的蔬菜,芥蓝含有丰富的营养物质和生物活性物质,并因其独特的风味和丰富的营养,越来越受到消费者的青睐,从而逐渐发展成为一种重要的芸薹属蔬菜[13]。本文通过对芥蓝Aux/IAA基因家族进行生物信息学分析,以及提供有效数据,从而更好地解析芥蓝生长素调控网络,并为探索Aux/IAA基因家族在芥蓝逆境适应性中的功能及其潜在应用奠定基础。
1 材料与方法
1.1 材料与试剂
材料:芥蓝品种为‘芥蓝27’,为本实验室自留种。
试剂:RNAiso Plus试剂盒(日本TaKaRa公司);三氯甲烷异丙醇;无水乙醇;无RNA酶(RNase free)ddH2O;PrimeScript RT 主混合物(日本TaKaRa 公司);凝胶纯化试剂盒[Omega Bio-Tek(中国)公司];pEASY载体克隆试剂盒(北京全式金生物技术有限公司);DH5α感受态细胞;质粒提取试剂盒[Omega Bio-Tek(中国)公司];氨苄;Luria-Bertani(LB)培养液(1 L 培养液中包括10 g NaCl,5 g 酵母抽提物,10 g蛋白胨;固体培养基中加15 g/L琼脂);10 μmol/L生长素;10 μmol/L 2,4-表油菜素内酯(2,4-epibrassinolide,EBR);10 μmol/L 脱落酸(abscisic acid,ABA);160 mmol/L NaCl;TB-Green 嵌合荧光试剂盒(日本TaKaRa公司)。
1.2 芥蓝Aux/IAA 基因与氨基酸序列的获取
在拟南芥基因数据库[The Arabidopsis Information Resource(TAIR),https://www.arabidopsis.org/]中搜索得到拟南芥Aux/IAA基因家族的序列号和基因序列信息。从芸薹属植物数据库(BrassicaDatabase,https://brassicadb.org/brad)中找到“syntenic gene”选项并搜索芥蓝和拟南芥Aux/IAA基因家族的同源基因,记录基因和氨基酸序列。
1.3 芥蓝Aux/IAA 基因家族的理化性质、染色体定位与进化分析
在ExPASy数据库(https://web.expasy.org/prot param/)中找到“ProtParam”选项[14],对芥蓝和拟南芥Aux/IAA 蛋白家族的氨基酸大小、分子质量、等电点、不稳定指数、亲水性等基本信息进行查找和记录。利用Tbtools工具定位Aux/IAA基因在染色体上的位置;利用DNAman 软件分别对拟南芥、芥蓝的基因和氨基酸序列进行多重比对;使用MEGA 6.0软件构建Aux/IAA蛋白家族系统发育树。
1.4 芥蓝Aux/IAA 家族亚细胞定位和保守基序(motif)分析
利用在线软件Wolf(https://wolfpsort.hgc.jp/)对Aux/IAA基因家族进行亚细胞定位;使用在线软件MEME(http://meme-suite.org/)将预测的基序数目设置为20,对芥蓝Aux/IAA基因家族的保守基序进行预测与分析。计算基序的期望值(E),如果E>0.05,说明此结构域未到达显著水平,并统计E<0.05 的基序数目。随后,将预测数目修改成统计的基序数值再进行一轮预测,得到预计结果。
1.5 芥蓝Aux/IAA 基因家族部分成员的实时荧光定量表达分析
在锥形瓶中加入芥蓝种子和ddH2O,于28 ℃条件下,在200 r/min摇床中过夜振荡培养;第2天挑选250粒大小相似、健康的发芽芥蓝种子,均分放置于水培箱中,置于相同培养条件下生长5 d 后进行处理。设置生长素(IAA)、油菜素内酯(brassinosteroid,BR)、脱落酸(ABA)和NaCl 处理:分别将水培箱中的培养液换成提前配置好的10 μmol/L IAA、BR、ABA 以及160 mmol/L 的NaCl 溶液;于处理后0、1、3、6 h分别收集不同处理下芥蓝幼苗的叶片(一次取5~6株),取0 h清水处理下的芥蓝幼苗叶片作为对照(CK);液氮冷冻后置于-80 ℃冰箱中保存。使用RNAiso Plus 试剂盒提取芥蓝叶片的RNA,使用PrimeScript RT主混合物试剂盒将上述提取的RNA反转录为DNA,并用ddH2O 稀释1 倍。选取芥蓝Aux/IAA家族成员基因BoIAA2(第Ⅴ亚族)、BoIAA3-1(Ⅴ)、BoIAA3-2(Ⅰ)、BoIAA4(Ⅴ)、BoIAA5(Ⅲ)、BoIAA9-1(Ⅳ)、BoIAA9-2(Ⅳ)、BoIAA19-1(Ⅲ)和BoIAA19-2(Ⅲ),在NCBI 数据库(https://www.ncbi.nlm.nih.gov/)上设计实时荧光定量聚合酶链式反应(real-time quantitative polymerase chain reaction, qRTPCR)所需的引物(表1),在ABI PRISM Step One PlusTM实时荧光定量PCR系统中使用荧光染料进行qRT-PCR 分析,反应程序如下:95 ℃预变性30 s;95 ℃变性5 s,58 ℃退火1 min,35个循环。其中,以BoActin7为参考基因,以2-△△CT计算其他基因的表达情况。以0 h 清水处理的芥蓝叶片为对照,将qRTPCR数据统一以对数2为底处理来制作基因表达热图:红色表示基因表达量升高,绿色表示基因表达量受到抑制。
2 结果与分析
2.1 芥蓝Aux/IAA 基因家族的理化性质、染色体定位与进化树分析结果
从TAIR 和芸薹属植物数据库中搜索得到41个芥蓝Aux/IAA同源基因,其命名如表2 所示。从中可知:芥蓝Aux/IAA 蛋白BoIAA10-1 的氨基酸残基数最多,为777,其余蛋白的氨基酸残基数都分布在128~427 之间,等电点分布在4.38~9.73 之间。根据不稳定系数越大、蛋白质越稳定的原则,可以看出,最不稳定的蛋白质是BoIAA3-2(18.17),最稳定的是BoIAA30-1(70.69)。不同蛋白间脂肪指数的差异也较大,其中BoIAA3-2 的脂肪指数最大,为123.31,而BoIAA2-1 和BoIAA4-1的脂肪指数最小,均为60.63。除BoIAA3-2 和BoIAA6-1 具有疏水性外,其余的Aux/IAA 蛋白都为亲水性蛋白。

表1 qRT-PCR引物Table 1 Primers used for qRT-PCR
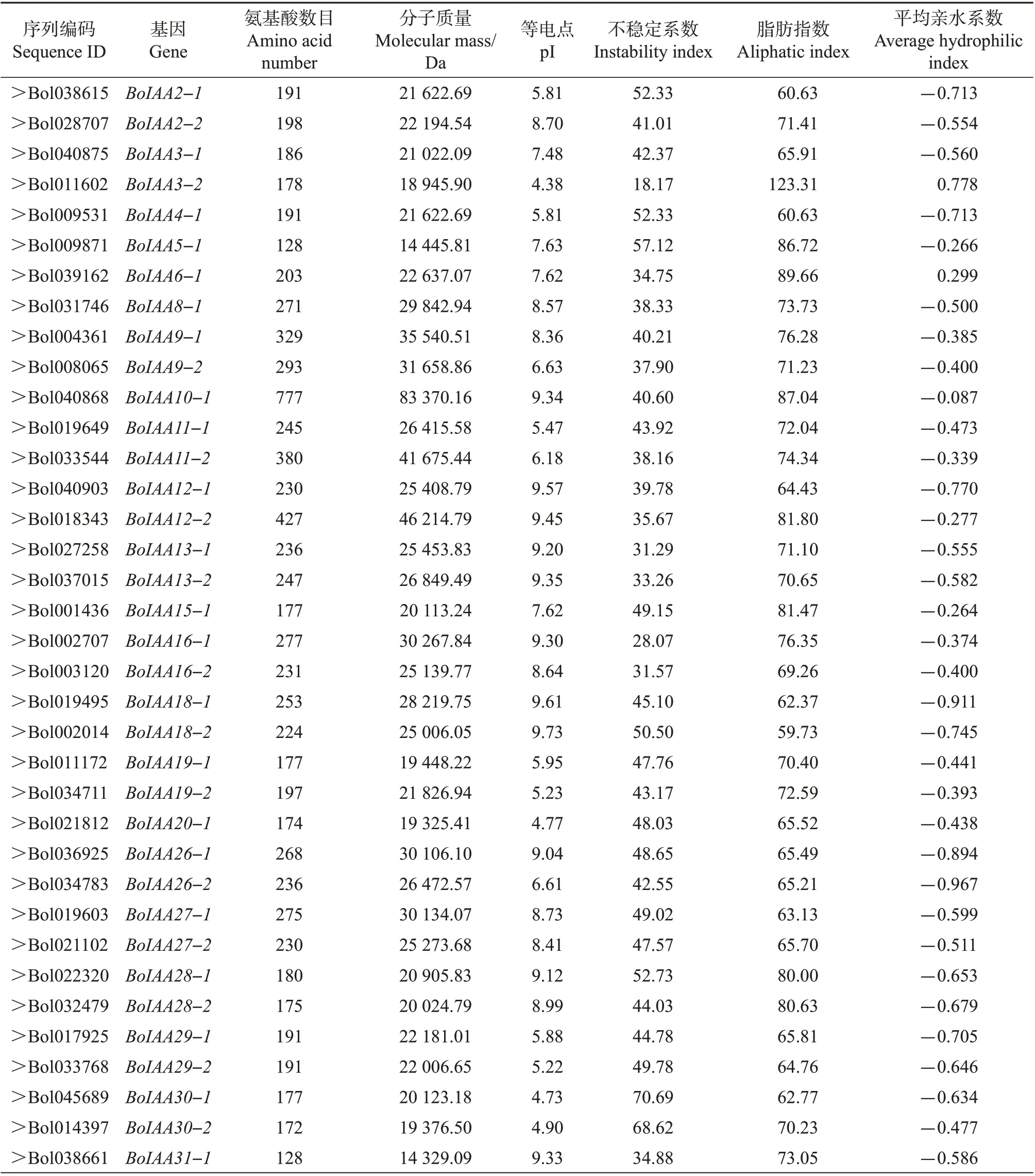
表2 芥蓝Aux/IAA家族信息及理化性质Table 2 Information and physicochemical properties of Aux/IAA family in Chinese kale

表2(续)Continuation of Table 2
芥蓝BoIAA基因在染色体上的分布如图1 所示,34个基因均匀分布于9条染色体上,其中染色体C01和C05上分布的基因最多,有6个。此外,有7个基因(BoIAA4-1、BoIAA8-1、BoIAA9-1、BoIAA15-1、BoIAA16-1、BoIAA16-2、BoIAA18-2)的分布未知。进化树分析结果(图2)表明:芥蓝Aux/IAA 家族分成8个亚族,其中,第Ⅷ亚族包含8个蛋白质,分别为BoIAA26-1、BoIAA26-2、BoIAA18-1、BoIAA28-2、BoIAA28-1、BoIAA20-1、BoIAA30-1和BoIAA30-2;而第Ⅰ亚族只包含BoIAA3-2和BoIAA18-2这2个蛋白质。
2.2 芥蓝Aux/IAA 家族蛋白质保守基序(motif)分析和亚细胞定位
对芥蓝Aux/IAA 家族进行亚细胞定位预测发现,大部分基因编码的蛋白分布于细胞核、叶绿体和细胞质中。其中,在细胞质和叶绿体中均分布着30 个BoIAA 蛋白,且BoIAA 蛋白在细胞质和叶绿体中的分布情况一致。BoIAA32-1 在细胞中分布的区域最广。
保守基序的分析预测结果(图3)和部分基序的结构图(图4)显示,在BoIAA基因家族蛋白质保守基序的41 个成员中,最长保守序列基序17 由50 个氨基酸残基组成,最短保守序列基序10 由10 个氨基酸残基组成。而BoIAA3-2、BoIAA18-2 和BoIAA10-1 不含有保守基序,其中BoIAA3-2 和BoIAA18-2 都属于第Ⅰ亚族。转录因子C 端由基序5、基序11、基序3、基序14 和基序17 这5 种基序组成,其中基序5 的数目最多,包含1 个功能域Ⅰ,其具有“LxLxL”保守基序。转录因子N端由基序1、基序4、基序6和基序8这4种基序组成,其中基序1和基序8 数目最多,而BoIAA9-2 与BoIAA31-1 的N端分别仅由基序6和基序4组成,基序3包含功能域Ⅱ的“GWPPV”保守基序,和Aux/IAA蛋白的稳定性相关[15];而BoIAA20-1、BoIAA30-1、BoIAA30-2、BoIAA32-1、BoIAA32-2、BoIAA33-1、BoIAA33-2、BoIAA34-1蛋白结构域Ⅱ缺失,均不含基序3,其降解能力受到一定的影响。基序1包含功能域Ⅳ特有的“GDVP”基序,能加强蛋白的静电作用[16]。在所有的保守基序中,基序2在每个Aux/IAA基因中的数目最多,包含功能域Ⅲ的基序。此外,我们还发现,有些保守基序为某个亚族所特有,比如基序6仅存在于第Ⅵ亚族中,基序7 仅存于第Ⅶ亚族。以上结果表明,BoIAA家族不同的基因存在特有的保守基序,而在不同亚族中保守基序的组成也存在很大的差异。
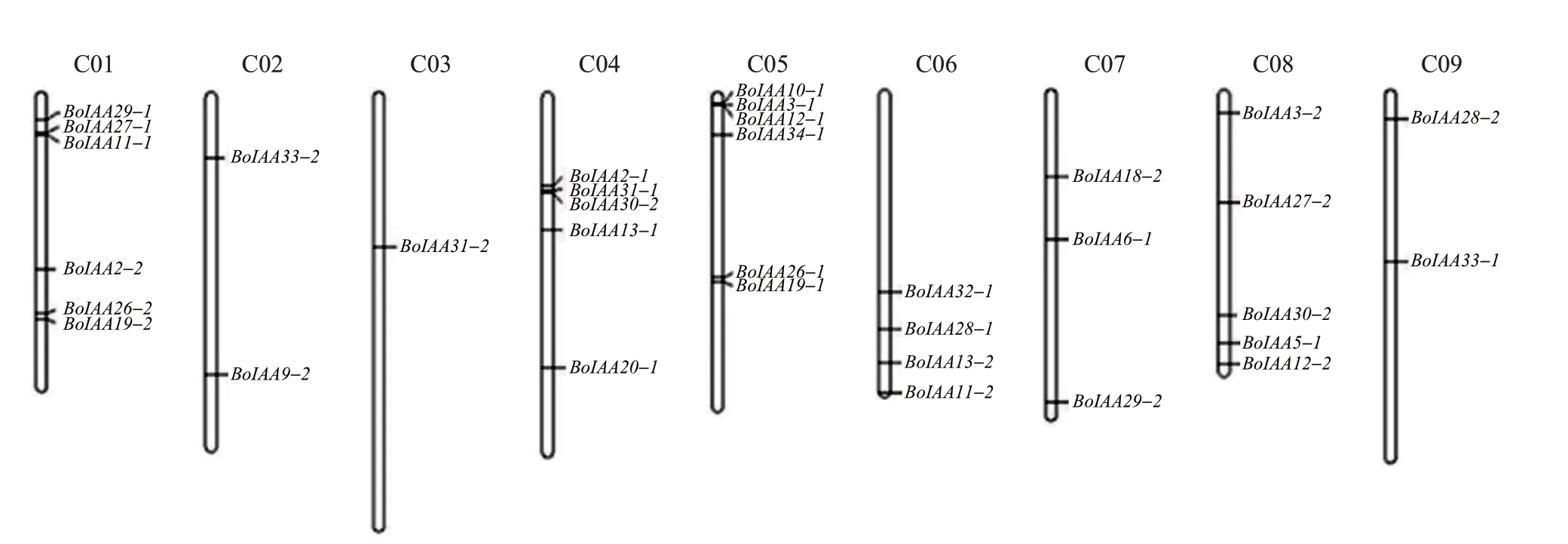
图1 芥蓝Aux/IAA基因家族的染色体定位Fig.1 Chromosome mapping of the Aux/IAA gene family in Chinese kale
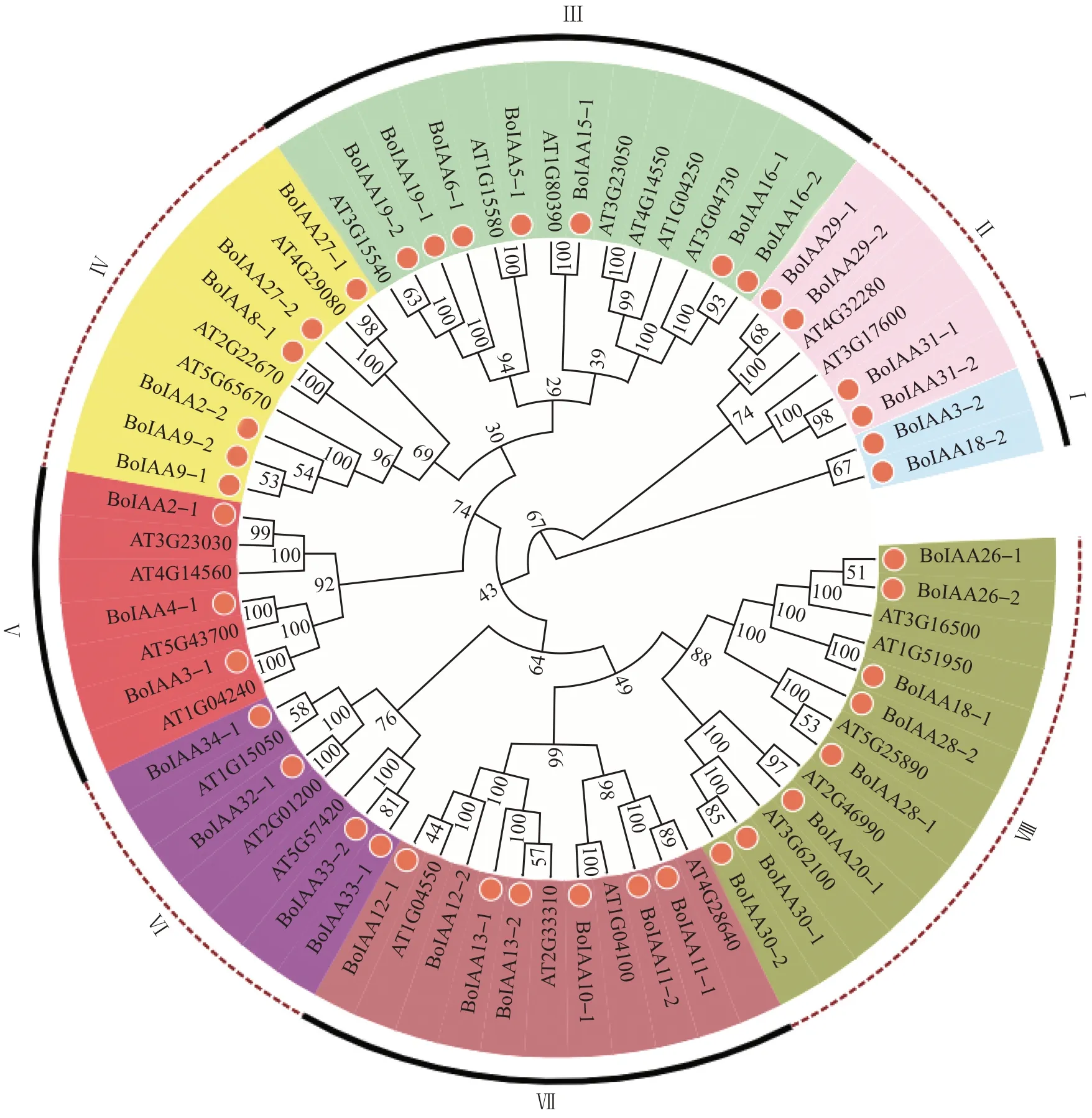
图2 芥蓝Aux/IAA蛋白家族系统进化树分析Fig.2 Phylogenetic tree analysis of Aux/IAA family protein in Chinese kale
2.3 芥蓝Aux/IAA 基因家族部分成员在外源植物激素和盐胁迫处理下的荧光定量表达情况分析
如图5所示:在10 μmol/L IAA处理下,Aux/IAA基因的表达量变化较大,其中BoIAA3-1、BoIAA19-1的表达量先上调后下降,BoIAA3-2、BoIAA9-1的表达量先受到抑制后上调。与对照组相比,在IAA处理后0~3 h 内BoIAA2-1和BoIAA19-2表达量显著升高,4~6 h内迅速下降,其中IAA处理3 h后BoIAA2-1的表达量上调6 倍,BoIAA19-2的表达量上调9 倍;而IAA 处理6 h 后BoIAA2-1的表达量下调至对照组的36%。10 μmol/L ABA 处理使BoIAA2-1、BoIAA3-1、BoIAA5、BoIAA19-2、BoIAA9-2的表达水平显著下降,而BoIAA3-2、BoIAA9-1、BoIAA19-1的表达水平则显著升高,其中ABA处理6 h后,BoIAA3-2的相对表达量上调幅度最大,约为对照组的2.8 倍。在10 μmol/L BR 处理下,只有BoIAA9-1和BoIAA9-2的表达量升高,其余基因的表达均受到抑制,且BoIAA3-1、BoIAA3-2、BoIAA4、BoIAA19-1、BoIAA19-2均表现为在BR处理前期表达量升高,在BR处理后期表达量下降。
如图6 所示:在160 mmol/L NaCl 处理下,BoIAA2-1和BoIAA19-1的表达量极显著升高,在NaCl 处理3 h 后,BoIAA2-1的表达量上调了18 倍,BoIAA19-1的表达量上调了2 倍。在NaCl 处理6 h时,BoIAA3-1、BoIAA9-1、BoIAA4和BoIAA5的表达受到抑制,BoIAA3-1 和BoIAA3-2、BoIAA9-1和BoIAA9-2这2对同源基因的表达量变化趋势相似,均为先上调后受到抑制。

图3 芥蓝Aux/IAA家族蛋白质保守序列基序分析Fig.3 Analysis of protein conserved sequence motif of Aux/IAA family in Chinese kale
3 讨论
Aux/IAA基因家族在植物生长素的响应途径中发挥着关键作用。最早从大豆受生长素诱导的基因中分离得到Aux/IAA基因[17],之后更多物种的Aux/IAA基因家族的理化性质及特异性功能得到挖掘与鉴定,包括拟南芥的29个Aux/IAA基因家族成员[18]、玉米的31 个成员[19]、小麦的84 个成员[20]、大豆的63个成员[21]、番茄的26个成员[22]以及三月李的26个成员[23]等。本试验对中国特产蔬菜芥蓝Aux/IAA基因家族进行生物信息学分析,发现芥蓝Aux/IAA基因家族由41个成员组成,可分为8个亚族。这与油菜Aux/IAA基因存在7 个亚族的情况[24]大致相符。41个基因大多数均匀分布于C01~C09 这9 条染色体上,有7 个基因无法在染色体上定位。对BoIAA基因家族进行亚细胞定位发现,该家族基因多数在细胞核、细胞质和叶绿体中都有表达,说明BoIAA家族对植物生理活动有着广泛的影响。

图4 Aux/IAA蛋白质保守结构域Ⅰ、Ⅱ、Ⅲ、Ⅳ的结构Fig.4 Structures of Aux/IAA proteins’conserved domain Ⅰ,Ⅱ,Ⅲand Ⅳ
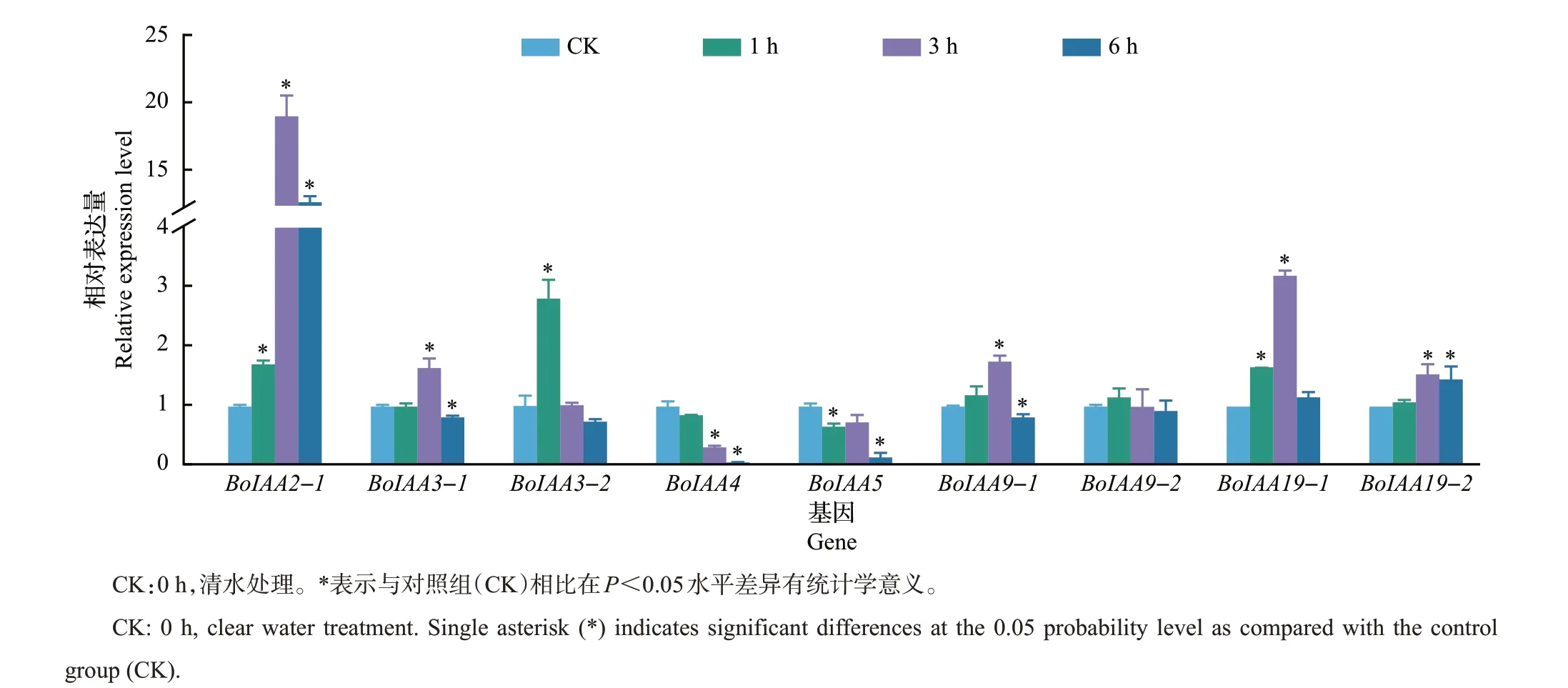
图6 部分Aux/IAA基因家族成员在盐胁迫处理下的定量表达情况Fig.6 Expressions of some Aux/IAA gene family members under salt stress treatments
有研究表明,Aux/IAA 蛋白存在4 个保守的功能域[25],使用在线软件MEME 对芥蓝BoIAA家族基因进行分析发现:该家族基因的C 端由5 种基序组成,其中基序5数目最多,含有功能域Ⅰ的保守基序“LxLxL”,可以招募TPL 辅抑制因子从而影响下游基因的表达[26];N端由基序1、基序4、基序6和基序8这4种基序组成,基序1数目最多,含有功能域Ⅳ特有的“GDVP”基序。在所有的保守基序中,基序2在每个Aux/IAA蛋白中数目最多,包含功能域Ⅲ的基序,能影响ARF和Aux/IAA蛋白的同源或异源二聚化[27]。而功能域Ⅲ、Ⅳ和ARF蛋白羧基末端结构域共同组成PB1 蛋白结构域[28],能和ARF 蛋白互作调节ARF活性。基序3包含功能域Ⅱ特有的保守基序,可以直接和SCFTIR1泛素连接酶复合物互作,影响Aux/IAA 蛋白的降解[29]。功能域Ⅱ的降解子(degron)序列是转录抑制剂反应/生长素F-box(TIR/AFB)蛋白的结合位点[30],且降解子序列侧翼基因区域一些赖氨酸残基的柔性热点与TIR1 介导的泛素化相关[31]。目前发现,5 种Aux/IAA 蛋白IAA20、IAA30、IAA32、IAA33、IAA34 缺少功能域Ⅱ[32],导致上述蛋白降解受到影响,而芥蓝中的BoIAA20-1、BoIAA30-1、BoIA30-2、BoIAA32-1、BoIAA32-2、BoIAA33-1、BoIAA33-2、BoIAA34-1蛋白均缺少包含功能域Ⅱ序列的基序3,和拟南芥中发现存在5种Aux/IAA蛋白缺少功能域Ⅱ这一结果相一致。除了这类非典型Aux/IAA蛋白,芥蓝中的24个蛋白包含4个功能域,17个蛋白存在不同程度的功能域缺失。烟草有77个Aux/IAA蛋白,而所有的蛋白都缺少功能域Ⅰ[33]。每个亚族和蛋白都有特殊的保守基序,这些基序的多样性可能使Aux/IAA蛋白在响应过程中发挥不同的生物学功能。
本研究中,针对部分BoIAA基因家族成员分别测定其在IAA、ABA、BR和NaCl处理下的实时荧光定量PCR表达情况,发现芥蓝Aux/IAA基因家族成员对外源处理表现出不同程度的响应。在10 μmol/L IAA处理下,BoIAA2-1和BoIAA19-1表达量的变化趋势相似。在结球甘蓝中对真叶期幼苗叶片进行IAA处理,发现BoIAA2-1和BoIAA19-1的表达量变化和芥蓝中的类似,即IAA 处理后2 个基因的表达量上调,且在IAA诱导3 h后达到较高值,随后表达量下降,推测BoIAA2-1和BoIAA19-1可能通过与BoTIR1和BoARF8识别响应IAA浓度的变化[34]。在160 mmol/L NaCl胁迫处理后BoIAA2-1和BoIAA19-1的表达量极显著上调,其中BoIAA2-1在NaCl 处理后3 h 表达量是对照组的19 倍,表明BoIAA2-1可能直接响应并调控芥蓝的抗盐能力,而BoIAA19-1在NaCl 处理3 h 后表达量是对照组的3 倍,说明BoIAA19-1可能间接调控芥蓝抵御盐胁迫。这一结果与在拟南芥中发现IAA19和MYB 转录因子互作影响植物非生物胁迫抗逆性的结论一致。综上所述,芥蓝Aux/IAA基因家族成员在植物激素信号转导的过程中发挥作用,BoIAA基因可以根据外源激素的变化来调整自身的表达,通过与其他基因互作的形式影响植物的生命活动,从而实现对外源激素的响应,而具体的调控机制需要后续深入探究。另外,BoIAA基因在植物响应非生物胁迫方面也存在潜在影响,且不同基因家族成员的功能存在差异,通过对不同处理条件下Aux/IAA基因家族成员的表达分析能帮助我们更好地探究BoIAA基因家族在信号转导、激素响应和抗逆性等方面潜在的影响与功能。
4 结论
本实验对芥蓝Aux/IAA基因家族进行全基因组分析,利用生物信息学分析的方法挖掘到芥蓝有41个Aux/IAA同源基因。利用基序分析发现,有3 个(BoIAA3-2、BoIAA18-2 和BoIAA10-1)Aux/IAA蛋白家族成员不含保守基序,有8 个(BoIAA20-1、BoIAA30-1、BoIAA30-2、BoIAA32-1、BoIAA32-2、BoIAA33-1、BoIAA33-2、BoIAA34-1)成员缺少包含功能域Ⅱ的基序3,且这8个蛋白成员的稳定性较高,不同亚族与基因基序的组成存在很大的区别。在不同植物激素影响下,定量分析特定BoIAA基因的表达情况发现,不同成员对植物激素响应存在差异。在盐胁迫处理下,BoIAA2-1和BoIAA19-1的表达量在处理前期显著上调,说明在盐胁迫处理下,这2个基因可能有直接或间接调控植物抵御盐胁迫的能力,能够帮助我们从新的角度分析植物生长和抗性之间的关系。
