基于胃肠动态消化系统分析两种不同藻油剂型的消化特性和生物可及性
2021-09-02陈琼郑奕锐汤新陈文荣许丹玲赵小淦李伟
陈琼,郑奕锐,汤新,陈文荣,许丹玲,赵小淦,李伟
(1.仙乐健康科技股份有限公司,广东汕头 515000)(2.南京农业大学食品科学技术学院,江苏南京 210095)
二十二碳六烯酸(Docosahexaenoic acid,DHA)是人体重要的一种长链多价不饱和脂肪酸(Polyunsaturated fatty acid,PUFA),属于Omega-3不饱和脂肪酸家族中的重要成员,是大脑细胞膜和视网膜的重要组成成分,对眼睛、神经系统和哺乳动物神经系统的发育至关重要[1]。大量研究表明,DHA还具有消炎[2]、降低血栓的发生率和动脉硬化[3,4]、提高机体免疫力、预防心脑血管[5]、炎症疾病和防癌等作用[6]。目前用于食品营养补充剂的DHA主要来源于鱼油和藻油。与鱼油DHA相比,微藻来源的DHA无鱼腥味、无环境污染而得到广泛关注。藻油提取自藻类植物,属于植物性DHA,因未经食物链传递,是世界上最纯净和最安全的DHA来源。作为大脑中长链PUFA的主要类型,DHA约占大脑总脂肪酸的15%。由于PUFA的需求量很大,PUFA的传统来源鱼油被认为是一种枯竭的资源,因此开发新型植物性DHA藻油作为PUFA的新型替代来源具有重要意义[7]。目前,含有约 50%EPA和DHA的藻油被开发为可持续的Omega-3脂肪酸来源[8]。然而,分子结构中的不饱和键使DHA容易受到氧化剂、光和高温的影响,从而导致产品保质期有限[9]。因此,为了更好地投入功能性食品市场,DHA需要以某种形式保护不被氧化,通常是选用不同的辅料与优化制备工艺来提高藻油稳定性,同时评估不同配方及制成工艺对于藻油的释放及生物可及性等的影响[10]。目前市场上较多的DHA藻油产品多为DHA软胶囊,本研究中的DHA藻油凝胶糖果优化了藻油产品的制备工艺,采用特定乳化技术制成。
为了评估DHA藻油凝胶糖果和DHA软胶囊两种不同剂型藻油产品的消化特性及生物可及性,建立了体外动态胃肠模拟消化模型,通过对两种剂型的藻油样品进行体外动态胃肠消化,在模拟肠液中添加胰酶和未添加胰酶的两种消化条件下,探讨消化过程中消化产物混合体系的分散情况、粒径大小及表面电势、游离脂肪酸的释放、脂滴微观结构和DHA释放量以及其生物可及性等方面进行综合分析。以期找到能提高功能性油脂消化特性及生物可及性的剂型,为丰富藻油等功能性油脂产品市场提供数据参考。
1 材料与方法
1.1 原料与试剂
胃蛋白酶(≥400 u/mg,货号P7125-100G,CAS:9001-75-6)、胰液素(8 u/mg,货号P7545-100G,CAS:8049-47-6)、胃膜素(货号 M2378-100G,CAS:84082-64-4)、胆汁盐(货号48305-50G-F)、尼罗蓝、尼罗红,美国SIGMA公司;游离脂肪酸(NEFA)测试盒,南京建成有限公司;脂肪酶(100 u/mg),上海麦克林生化科技有限公司;甲醇钠、甲基叔丁基醚(MTBE),上海阿拉丁生化科技有限公司;乙腈:色谱纯;DHA甲酯标准品,上海安谱实验科技股份有限公司;萃优酪TMDHA藻油凝胶糖果(批号20201104,萃优酪TM商标正在注册中,以下简称 DHA凝胶糖果),仙乐健康科技股份有限公司特定技术制备;DHA藻油软胶囊(批号20210107,以下简称DHA软胶囊),仙乐健康科技股份有限公司制备;氯化钾、磷酸二氢钾、碳酸氢钠、氯化钠、六水合氯化镁、碳酸铵、盐酸均属于分析纯。
1.2 主要仪器设备
动态仿生胃肠消化系统,南通东概念有限公司;PB-20型pH仪,德国Sartorius公司;HH-6型数显恒温水浴锅,常州国华电器有限公司;HYQ-2121A型旋涡混匀器,苏州捷美电子有限公司;722可见分光光度计,上海菁华科技仪器有限公司;Waters高效液相色谱仪,沃特世科技(上海)有限公司;荧光显微镜(Nikon ECLIPSE 80i),尼康光学仪器(中国)有限公司;马尔文Malvern Zetasizer Nano ZS90纳米粒度电位仪,英国马尔文仪器有限公司。
1.3 试验方法
1.3.1 样品处理
DHA软胶囊样品:取一粒DHA软胶囊(单粒质量151 mg,DHA含量32 mg,主要辅料为明胶、甘油等),以完整颗粒形式放入仿真小鼠胃中,进行体外模拟消化。DHA凝胶糖果样品:取一粒DHA凝胶糖果(单颗质量1500 mg,DHA含量200 mg,主要辅料为明胶、木糖醇和山梨糖醇等),剪碎成细小碎块,颗粒大小最大长度小于3 mm,称取剪碎后的样品240 mg(DHA含量32 mg),放入仿真胃中,进行体外模拟消化。
1.3.2 体外动态仿生胃肠消化
应用本实验室前期建立的动态仿生胃肠消化系统进行模拟体外消化[11-13]。
1.3.2.1 胃消化液的配置
配置每100 mL胃消化液,称取氯化钾51.44 mg、磷酸二氢钾12.25 mg、碳酸氢钠210.03 mg、氯化钠275.84 mg、六水合氯化镁2.03 mg、碳酸铵7.86 mg,盐酸调节溶液至pH为1.6。
1.3.2.2 肠消化液的配置
配置每100 mL肠消化液,称取氯化钾50.70 mg、磷酸二氢钾10.89 mg、碳酸氢钠714.09 mg、氯化钠224.41 mg、六水合氯化镁6.71 mg,盐酸调节溶液至pH为7.0。
1.3.2.3 模拟胃消化
称取6.25 mg胃蛋白酶与15 mg胃膜素,分别溶于10 mL胃消化液中,于37 ℃水浴锅中水浴活化20 min后混合,即为模拟胃液。用注射器吸取15 mL模拟胃液用于胃消化。将样品填塞进入体外动态仿生胃中,加入5 mL纯水或口腔消化液,再加入600 μL模拟胃液。安装好动态仿生胃肠消化仪器,仪器运行参数为:胃液注射泵速度为52 μL/min,排空注射泵速度为 70 μL/min,胃倾斜角度为 8 °,胃挤压速度为 3 rpm/min,胃滚轮速度为12 r/min,消化时间为2 h。消化产物置于沸水浴10 min灭活酶,于-20 ℃冰箱中保存。
1.3.2.4 模拟肠消化
取81.7 mg胆汁盐与56.2 mg胰液素溶于20 mL肠消化液中,于37 ℃水浴活化20 min,即为添加胰酶组模拟肠液;称取81.7 mg胆汁盐溶于20 mL肠消化液为未添加胰酶组的模拟肠液。用胃液注射器吸取15 mL模拟胃液,肠液注射器吸取15 mL模拟肠液。将样品填塞进入仿真小鼠胃中,加入5 mL纯水或口腔消化液,再加入600 μL模拟胃液。安装好动态仿生胃肠消化仪器,仪器的运行参数为:胃液注射泵速度为52 μL/min,肠液注射泵速度为52 μL/min,排空注射泵速度为100 μL/min,胃倾斜角度为8 °,胃挤压的速度为3 r/min,胃滚轮速度为12 r/min,肠滚轮速度为12 r/min,消化时间为2 h,每30 min取样,消化产物置沸水浴中10 min灭活酶,于-20 ℃冰箱中保存。
1.3.3 粒径大小与表面电势
根据动态光散射技术,使用马尔文Zetasizer Nano ZS90型ζ电位与纳米粒度仪分析消化后DHA藻油混合体系的ζ电位和粒径分布,测定条件:测定温度25 ℃,吸取消化后的样品0.5 mL后稀释至2 mL。每个样品测定3次后取平均值,得到粒径大小与体积百分比分布曲线[14]。
1.3.4 微观结构
使用Nikon ECLIPSE 80i显微镜观察DHA凝胶糖果和DHA软胶囊胃肠消化产物的微观结构。配制质量分数0.02%(m/V)尼罗红和0.1%(m/V)尼罗蓝溶解于1,2-丙二醇和水的混合溶液(50:1,V/V)中,混合均匀后于4 ℃下避光保存[15]。观测时,将2.5 µL混合染料加入50 μL样品中,充分混匀后取20 μL制片,使用荧光显微镜观察并采集图像。激发滤光片参数:激发波长 540/25 nm,分光波长 565 nm,发射波长605/55 nm。
1.3.5 游离脂肪酸释放量
使用游离脂肪酸(Non esterified fatty acid,NEFA)测试盒测定游离脂肪酸含量。将棕榈酸标准品定容至25 mL,浓度为800 μmol/L。向0.2 mL标准品与各样品管中依次加入缓冲液、铜试剂和氯仿试剂,混匀抽提2 min,3500 r/min离心10 min,吸弃上层蓝色液体及蛋白凝块,取剩余的下层有机相2 mL加入显色剂0.25 mL,涡旋10 s后静置2 min,于440 nm下测定吸光度,以氯仿为空白管调零比色。按以下公式计算样品的游离脂肪酸释放量。
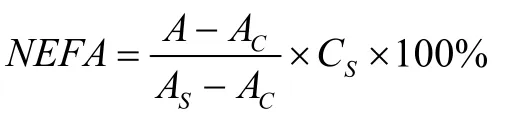
注:A:样品管吸光度;Ac:空白管吸光度;As:标准管吸光度;Cs:标准品浓度。
1.3.6 DHA含量
使用HPLC来评估不同消化阶段消化液中DHA的含量。通过对配制的系列浓度的对照品溶液,按照设计的色谱条件进样,以组分的峰面积为纵坐标,对应的浓度(μg/mL)为横坐标作图,求得回归方程。具体操作为:10 mg DHA甲酯标准品用乙腈定容至10 mL,依次稀释为浓度100 μg/mL~0.313 μg/mL的标准品溶液。消化后的样品通过12000 r/min离心90 min后取胶束相溶液。DHA甲酯化处理:向胶束相溶液中加入0.6 mL叔丁基甲基醚和0.3 mL的0.2 M甲醇钠的甲醇溶液。涡旋1 min,室温静置2 min。加入0.5 M硫酸20 μL以中和溶液,涡旋5 s。加入0.6 mL超纯水,涡旋10 s,4000 r/min离心5 min。吸取上清液约400 μL,氮气吹干。产物用2 mL乙腈溶解,即为甲酯化样品[16]。DHA甲酯用高效液相色谱(High performance liquid chromatography,HPLC)测定,可避免高温对DHA稳定性的影响[17]。色谱条件:Eclipse Plus C18色谱柱(4.6 mm×150 mm,5 μm);二极管阵列检测器,波长为210 nm,柱温设置为25 ℃,流速1 mL/min,进样量10 μL,流动相:乙腈/水(95/5,V/V)等度洗脱[18,19]。按以下公式计算消化样品的DHA释放倍数(以DHA含量计)。

注:S1:凝胶糖果DHA释放量总峰面积;S2:软胶囊DHA释放量总峰面积。
1.3.7 数据处理与分析
数据以平均值±标准差表示,采用SAS 8.1软件进行统计分析。*代表差异显著(p<0.05),**代表差异极显著(p<0.01)。实验数据绘图由Origin 2018软件完成。
2 结果与讨论
2.1 粒径大小与粒径分布
在生物学领域研究中,粒子的粒径是重要的考虑因素,尤其是对于新型油脂性产品载运系统的研发。脂肪颗粒大小降低至亚微米级时,能够增强水难溶性物质的分散性[20]。本研究中对DHA凝胶糖果和DHA软胶囊(如图1)两种剂型的藻油样品进行体外动态消化,分析不同消化时间和消化方式中两种剂型的消化特性。a组的模拟肠液中含有胰液素(混合酶体系)和胆盐,b组肠液不添加胰液素,其它消化条件一致。通过添加胰酶组(a组)反映样品水解后的胶体混合物粒径大小与分布,以未添加胰酶组(b组)为对照,分析藻油样品被胆盐乳化过程中乳浊液的液滴粒径变化。测得消化产物的粒度大小结果如图2。由图2a可知,DHA软胶囊胃消化的粒度低于其肠消化,且其粒度范围在1600~2200 nm内,变化幅度平缓;DHA凝胶糖果在肠消化30 min时粒度大小达到最高,说明在肠消化前期DHA凝胶糖果由固体形态先被消化液乳化分解成大小不同的液滴,后续消化中粒径大幅减小。在胃消化和肠消化前期,DHA凝胶糖果与DHA软胶囊样品粒度无显著差异。但在肠消化60 min后,DHA凝胶糖果消化产物粒径大小快速降低,极显著低于DHA软胶囊粒径,说明DHA凝胶糖果所含的油脂在肠消化中被胆盐很好地乳化成较均一的小液滴。由图2b可得,DHA软胶囊组肠消化30 min、90 min粒度显著大于DHA凝胶糖果(p<0.05),胃消化与肠消化下的粒度结果无显著差异。与加胰酶(a组)相比,未添加胰酶组(b组)的肠消化粒度变化幅度变小。整体添加胰酶组的样品粒度结果更大。

图1 两种剂型的DHA藻油产品的外观结构图Fig.1 The appearance and structure of two forms of DHA algal oil product
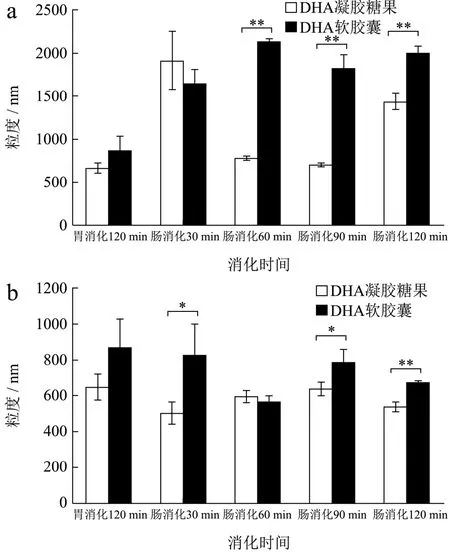
图2 不同消化阶段下DHA凝胶糖果和DHA软胶囊消化产物的粒度大小Fig.2 The particle diameter of DHA gel candy and DHA softgel of digestive products for different digestion stage
在脂肪消化过程中,乳液的比表面积决定了胆盐、脂肪酶在油-水界面的吸附位点,因此乳状液粒径大小对脂肪消化速率影响显著[21]。图3表明了消化产物的粒度分布。DHA软胶囊消化产物颗粒的相对体积分数峰值整体低于DHA凝胶糖果,分散范围较大,主要在80~1500 nm之间。有研究对市售藻油粉进行体外消化,其粒径分布在1~1000 nm之间,最高体积分数低于10%,分布相对不集中[22]。不同处理下的粒径分布也有差异,DHA软胶囊胃消化的粒径在 300~600 nm有较多分布,肠消化30 min时粒径集中在250 nm左右,肠消化60 min后粒径分布向两侧分化,大小接近150 nm和1000 nm的颗粒数量增加。DHA凝胶糖果消化产物的颗粒相对体积分数的散布范围窄且对称,粒径分布较集中。不同处理下的样品颗粒大小分布范围接近,集中在200~1000 nm之间,结合样品较高的ζ电位值可说明分散系稳定均匀,DHA凝胶糖果肠消化120 min的相对体积分数峰值最高。
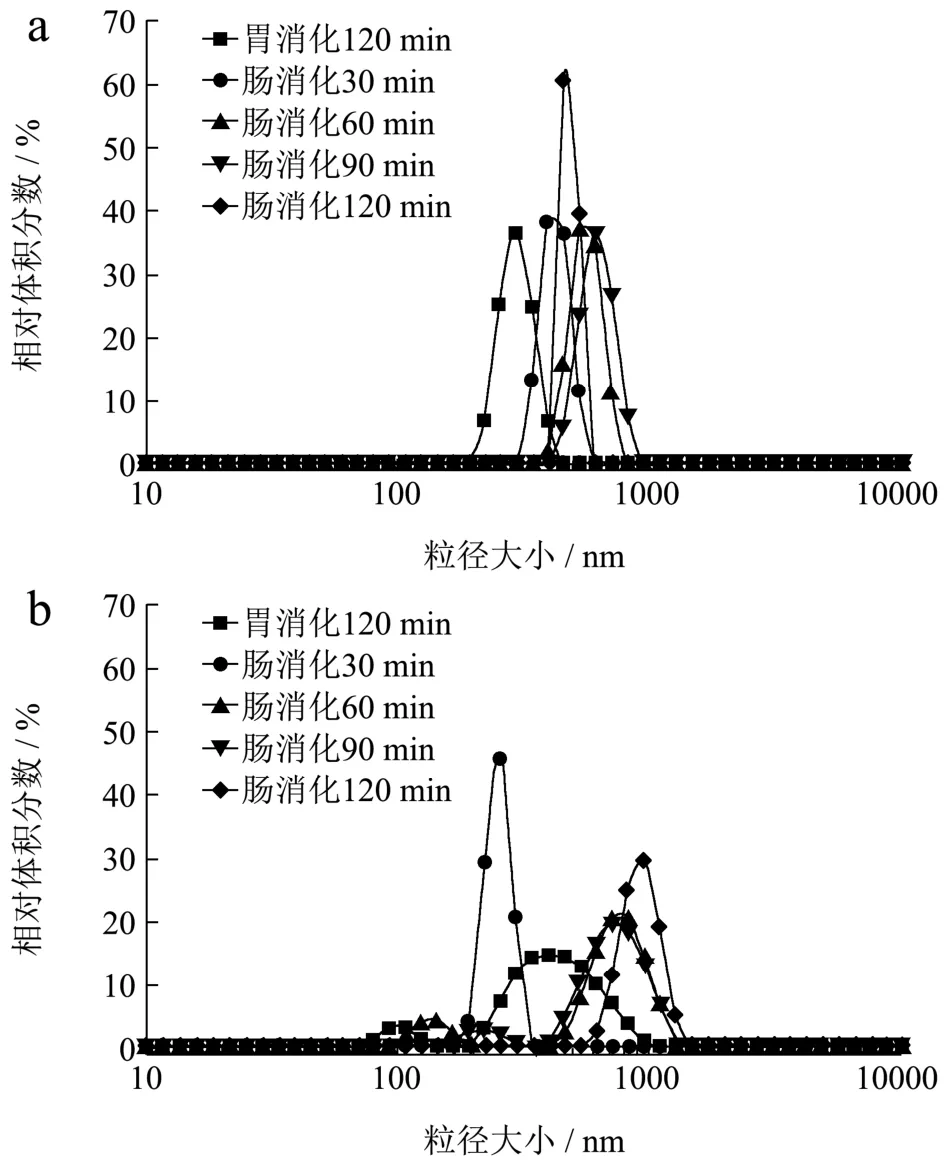
图3 不同消化阶段下添加胰酶组的消化产物的粒度分布Fig.3 The range of the particle diameter of digestive products for different digestion stage
2.2 ζ电位绝对值
乳状液的稳定性与ζ电位绝对值有关,ζ电位绝对值越大,乳液越趋于稳定[23]。胃消化ζ电位为正,数值较小;肠消化ζ电位为负,且绝对值较大。添加胰酶组(a组)的ζ电位可表征消化后辅料与DHA胶体混合体系的电位,未添加胰酶组(b组)的结果为样品崩解后辅料与藻油液滴乳浊液的电位。由图4可知,添加胰酶组(a组)和不添加胰酶组两种剂型的样品在不同消化阶段的ζ电位绝对值差异极显著(p<0.01)。添加胰酶组(a组)中,DHA凝胶糖果肠消化产物ζ电位绝对值随消化时间增加而增大,且均高于30 mV,说明颗粒的分散体系稳定程度高(图4a)。DHA软胶囊肠消化产物也有较好的颗粒稳定性,但其ζ电位变化与消化时间没有明显关系。除肠消化30 min以外,其他消化情况下的DHA凝胶糖果ζ电位绝对值均机显著高于软胶囊(p<0.01),表明DHA凝胶糖果在胃肠消化中具有更好的分散体系稳定性。未添加胰酶组(B组),DHA软胶囊ζ电位绝对值均极显著大于DHA凝胶糖果(p<0.01),不同消化处理无显著效应差异(图4b)。可知未添加胰酶组(b组)的情况下,DHA凝胶糖果肠消化电位绝对值降低,接近胃消化电位绝对值。Han等[24]在模拟消化后含长链甘油三酯(LCT)和中链甘油三酯(MCT)的乳液中发现胃阶段有大量油滴积聚,尤其在LCT乳液中,模拟胃消化ζ电位降低。在小肠阶段油滴出现积聚,但 MCT乳液也含有一些相对较大的颗粒。这与我们两种藻油剂型的ζ电位在胃肠阶段变化一致。
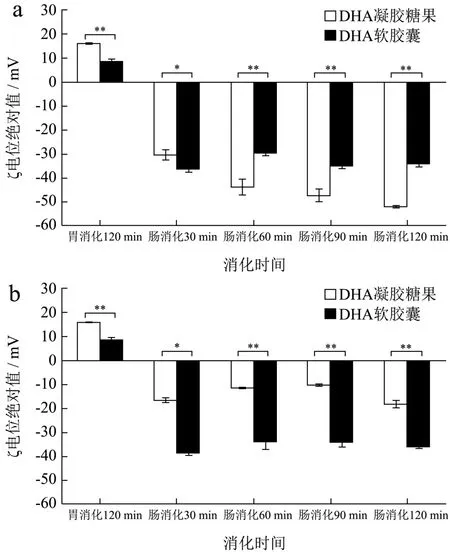
图4 不同消化阶段下的DHA凝胶糖果和DHA软胶囊消化产物的ζ电位绝对值Fig.4 The zeta-potential of DHA gel candy and DHA softgel of digestive products for different digestion stage
2.3 游离脂肪酸释放量
有研究表明疏水性生物活性化合物的生物可及性和生物利用度可以通过将它们与游离脂肪酸的结合形成混合胶束来提高[25]。通过游离脂肪酸(NEFA)试剂盒分析评估不同藻油类型样品脂质消化程度的影响。在小肠阶段测定消化产物中胶束释放的游离脂肪酸量(图5)。胃消化几乎不产生NEFA。DHA凝胶糖果在各消化阶段的 NEFA浓度均有极显著性差异(p<0.01),且随着肠消化时间变长,NEFA释放量显著增加,在肠消化120 min达到最高浓度。DHA软胶囊在肠消化中 NEFA含量始终保持在 1.75~2.25 mmol/L范围内,与消化时间无明显关系。通过比较发现,胃消化产物NEFA含量差异不显著,而肠消化均有极显著差异(p<0.01)。在肠消化30 min时,DHA凝胶糖果NEFA浓度低于DHA软胶囊,在接下来的消化过程中浓度逐步增加。表明DHA凝胶糖果基质体系在肠消化90 min时仍未被完全破坏,对DHA藻油有较好的保护作用,达到了明显的缓释效果。
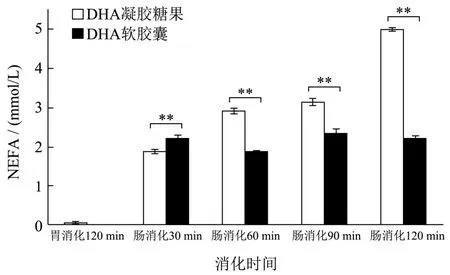
图5 不同消化阶段下DHA凝胶糖果和DHA软胶囊消化产物的NEFA释放量Fig.5 The NEFA content of DHA gel candy and DHA softgel of digestive products for different digestion stage
2.4 DHA含量
进行消化前的样品DHA含量一致,但随着消化时间的不同,消化产物释放的DHA含量不同。由标准曲线求得DHA甲酯标准品回归方程:у=2.4×107х+4.3×104(R2=0.9997)。对两种样品消化产物胶束相进行甲酯化并进行DHA释放量分析,结果如图6所示。DHA凝胶糖果肠消化的DHA释放量随着消化时间的增加而增加,但DHA软胶囊消化后释放的DHA含量变化不具有时间依赖性,与游离脂肪酸结果对比,凝胶糖果肠消化随着时间的增加 NEFA的浓度增加,DHA软胶囊的NEFA与时间不呈依赖性,二者变化趋势一致(图5)。肠消化120 min测得的DHA含量显示凝胶糖果 DHA含量极显著高于软胶囊含量(p<0.01),肠消化30 min凝胶糖果与胶囊DHA含量具有显著性差异(p<0.05)。DHA凝胶糖果的总DHA释放比例为63%,DHA软胶囊的总DHA释放比例为4.77%。进一步分析两种样品的 DHA释放倍数(按1.3.6中公式计算),结果显示DHA凝胶糖果DHA释放量为DHA软胶囊的6.75倍。
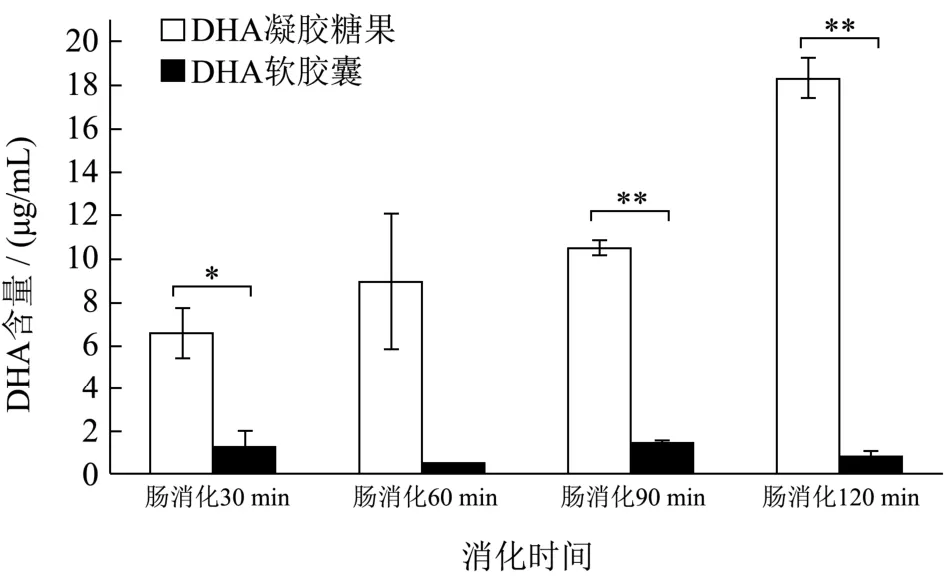
图6 不同消化阶段下DHA凝胶糖果和DHA软胶囊消化产物DHA含量变化Fig.6 The DHA contents of DHA gel candy and DHA softgel of digestive products for different digestion stage
2.5 微观结构
有研究指出食品或者营养补充剂的微观结构的破坏可能会影响消化道中某些营养物质的释放、转化和随后的吸收,因此评价加工过程或食物摄入过程中与基质-营养素相互作用相关的微结构变化类型对其生物利用度具有重要指导作用[26]。尼罗红可与油脂特异性结合产生强烈荧光,而胰酶消化后的游离脂肪酸无法被染色观察,因此使用不添加胰酶组的样品分析产物在消化过程中的微观形态变化。观察消化样品微观结构结果如图7所示。
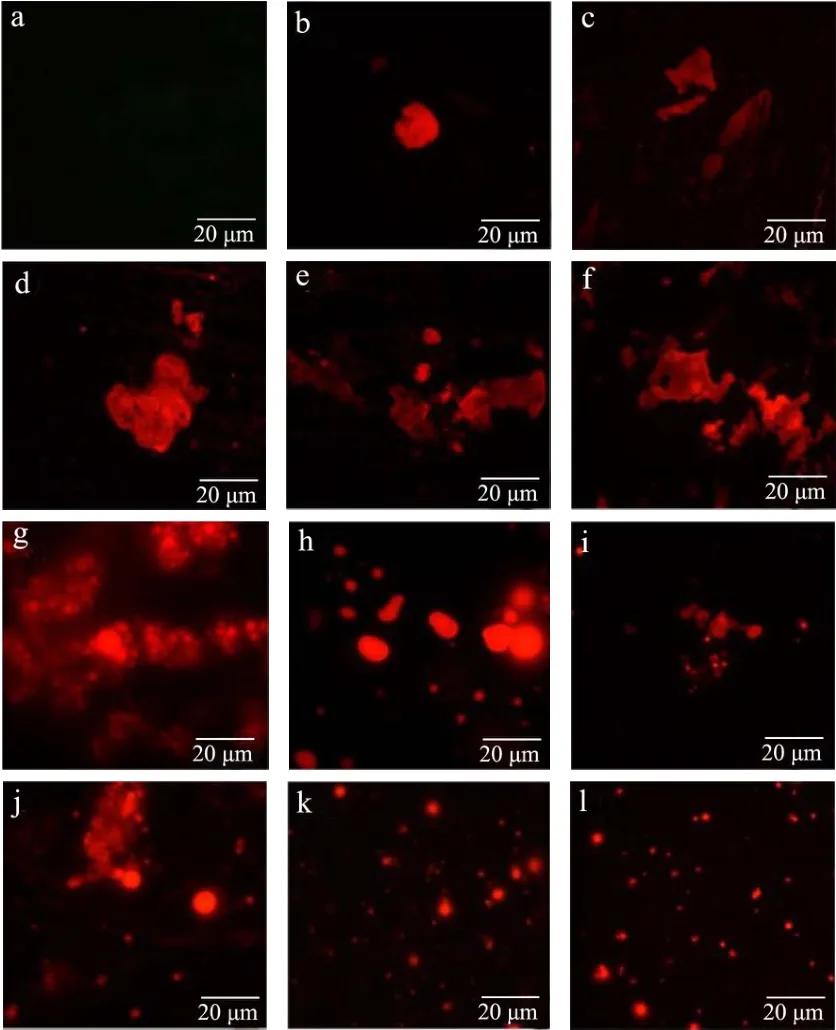
图7 消化产物微观形态结构Fig.7 Microstructure of digestive products
首先对DHA凝胶糖果样品未消化前进行微观结构分析,DHA凝胶糖果在水中可形成较稳定的乳浊液(静置2 h未分层),而DHA软胶囊未消化无法在水中形成稳定的乳浊液,无法进行荧光拍摄(图7a)。荧光图7g显示DHA凝胶糖果初始时基质与油滴相互连接,不同大小的油滴聚集成团,形成有空间结构的复合体。上述电位图中表明DHA凝胶糖果消化产物有较高的ζ电位(图4a),肠消化初期虽然脂滴大小有差异,但相比于DHA软胶囊样品轮廓清晰,较少聚集,对应图7中不同处理下DHA凝胶糖果样品均有较好的颗粒分散性。DHA软胶囊ζ电位总体低于凝胶糖果,荧光染色显示其颗粒更易相互吸引聚集,镜检观察分布不均匀。DHA凝胶糖果肠消化30 min有较大的颗粒,而在后续消化中逐渐变小,DHA凝胶糖果基质的崩解使DHA藻油缓慢释放,有利于脂滴乳化,不易连接成片或聚集成团,肠消化2 h后的粒径呈均匀分布状态(图7l),多数粒径在1~2 μm左右。DHA软胶囊在肠消化30 min时分离出的脂滴较少(图7b),后续数量逐渐增加,易形成较大的颗粒,乳化效果不如DHA凝胶糖果。结合DHA凝胶糖果样品较高的ζ电位值可说明DHA凝胶糖果肠消化后分散系稳定均匀(图4a),符合荧光图像中出现的大量形态大小相似且分散均一的小液滴。DHA软胶囊脂滴的形态大小各异,总体分布不如凝胶糖果消化均一。梁丽[27]对不同油脂乳液消化后的微观结构进行观察,其中藻油在口腔和胃消化的显微图像中分布较少,在肠消化后脂滴数量增加,且脂滴存在一定程度的聚结情况,与图7F结果相符。
3 结论
通过体外动态模拟胃肠消化模型,我们得出DHA藻油凝胶糖果在消化各个阶段消化特性及油脂的释放与分散性能较DHA藻油软胶囊表现更为良好。DHA凝胶糖果消化产物粒径分布较集中,ζ电位值较高,分散系稳定均匀,经过消化后体系分散均一,更利于被吸收;且DHA凝胶糖果释放的游离脂肪酸在消化初期浓度较低,后续消化过程中逐步增加,具有缓释效果,消化结束后释放的DHA含量较高。DHA软胶囊消化后产物粒径较分散,形成的颗粒较大,乳化效果不如DHA凝胶糖果。综上所述,基于现有的制备工艺和条件,DHA软胶囊和DHA凝胶糖果两种使用不同辅料及制备工艺的产品对于藻油的释放和生物可及性具有不同的影响,DHA藻油凝胶糖果具有较好的生物可及性,其生物可及性为DHA藻油软胶囊的6.75倍(以DHA含量计)。
