三七叶水提物对5-氟尿嘧啶诱导小鼠肠道黏膜炎的预防作用
2021-09-02祁新戴天浥赵红梅田洋白忠彬
祁新,戴天浥,3,赵红梅,田洋,3,白忠彬
(1.云南农业大学食品科学技术学院,云南昆明 650201)(2.国家辣木加工技术研发专业中心,云南昆明 650201)(3.云南省生物大数据重点实验室,云南昆明 650201)
目前,恶性肿瘤的年发病率在继续增加,并且成为世界范围内关注的焦点[1]。化疗是恶性肿瘤患者主要的治疗方式,常见的化疗药物以5-FU、伊立替康、甲氨蝶呤等最为常见[2]。但是,这些化疗药物不仅能杀伤肿瘤细胞,也对机体细胞造成了极大损害[3]。据报道,50%~80%的癌症患者在化疗过程中患有肠道黏膜炎,其主要发生在小肠部位,临床表现为体重减轻,肠道隐窝细胞凋亡,肠道细胞炎性浸润,破坏肠道屏障,肠黏膜通透性增高而影响肠道微生态平衡,这大大限制了化疗药物在临床上的应用[4]。研究表明肠道黏膜炎的发展可能与促炎因子如肿瘤坏死因子-α,白细胞介素-6,白细胞介素-1β水平的上升有密切关系[5]。到目前为止,化疗性肠道黏膜炎的致病因素和发病机制尚未完全明确,医学上还没有可以完全治愈该疾病的方法。
目前,临床常用氢氧化铝、碱式碳酸铋、盐酸阿扎司琼、格拉司琼等药物改善或控制化疗药物引起的胃肠道毒性反应,这些药物虽然在临床实践中有一定的作用,但是可引起机体发生过敏、呼吸、心血管系统损伤等一系列不良反应,这使肿瘤患者不得不停止化疗进程[6]。因此,寻找一种天然药食两用的中药材治疗和预防化疗性肠道黏膜炎已经成为国内外研究的焦点。
三七为五加科人参属植物,主产于云南文山州,在广西、广东、福建等地也有分布[7]。三七叶具有抗炎[8]、抗氧化[9]、保肝利胆[10]、抗血栓[11]等作用,其主要生物活性成分为人参皂苷类、多糖、黄酮[12]等,此外,近年来国内外学者就三七叶的抗炎,免疫调节活性做了广泛的研究,研究发现三七皂苷在脂多糖(LPS)诱导的raw264.7巨噬细胞模型中,以浓度依赖的方式显著降低TNF-α、IL-6、iNOS的分泌,且无细胞毒性[8],三七多糖在小鼠足肿胀模型中,可以抑制血清TNF-α、IL-1β和IL-6的分泌,具有抗炎作用[13],三七黄酮具有抗炎镇痛的作用[14]。但目前国内还没有三七叶干预化疗药物诱导肠道黏膜炎的报道。因此,本实验将初步探究三七叶水提物对化疗药物所致肠道损伤的干预作用,采用5-FU建立动物模型。
1 材料与方法
1.1 动物、材料与试剂
SPF级雄性昆明鼠40只,6~8周龄,体重20~25 g,购自辽宁长生生物技术股份有限公司,动物质量合格证号:211002300046930,许可证号SCXK(辽)2015-0001。饲养环境:23~25 ℃,相对湿度60%~65%,光照12 h,自由进食、饮水。所有程序均严格按照中国实验动物使用和护理法规以及云南农业大学实验动物研究所制定的指南进行,并经云南农业大学动物保护和使用委员会批准。
三七叶,云南省普洱市澜沧县有机三七种植示范基地;5-FU(CAS:51-21-8),上海源叶生物科技有限公司;RNA提取试剂盒、逆转录试剂盒、SYBR染料,南京诺唯赞生物科技有限公司;抗体(proliferating cell nuclear antigen,PCNA),Abcam公司;引物IL-1β、IL-6、TNF-α、MUC-2、ZO-1、Occludin,上海捷瑞生物工程有限公司;免疫组化试剂盒,Vector公司。
1.2 仪器与设备
LGJ-1冷冻干燥机,北京亚泰科隆仪器技术有限公司;LightCycler480 II荧光定量PCR仪,德国Roche公司;光学生物显微镜,上海光学仪器厂;组织包埋机、脱水机与切片机,赛默飞世尔科技中国有限公司。
1.3 方法
1.3.1 三七叶水提物的制备
三七叶水提物的制备参考何小芳[15],在此基础进一步加以改进,将三七叶进行粉碎,过60目筛,取适量三七叶粉,加入20倍重量的蒸馏水,煮沸30 min,过滤,得到滤渣重复上面操作,合并滤液,冷却室温,于4000 r/min离心20 min,取上清液进行喷雾干燥,喷雾干燥条件为进口温度175 ℃,出口温度105 ℃,进样量500 mL,装袋于常温储存备用,称重测得提取率为 30.2%,测得三七叶水提物中总皂苷的含量为73.36 mg/g,总糖含量为302.24 mg/g,总黄酮含量为10.38 mg/g。
1.3.2 动物试验分组、给药与模型建立
昆明小鼠适应性喂养7 d后,将小鼠按体重随机分成对照组,模型组,三七叶水提物低、中、高剂量组。正常组灌胃相应体积的蒸馏水,每日1次,持续14 d,24 h后腹腔注射相应体积的生理盐水,每日1次,持续2 d;模型组灌胃相应体积的蒸馏水,每日1次,持续14 d,24 h后腹腔注射5-FU(130 mg/kg,溶于生理盐水),每日1次,持续2 d;根据前期预实验设定三七叶水提物剂量,三七叶水提物低、中、高组(50、100、200 mg/kg,溶于蒸馏水),每日1次,持续14 d,24 h后腹腔注射5-FU(130 mg/kg,溶于生理盐水),每日1次,持续2 d。并记录小鼠每日体重,各组小鼠于腹腔注射结束后48 h处死。
1.3.3 动物组织收集
颈椎脱臼处死小鼠,剖开腹腔进行组织收集,收集近盲端空肠段1 cm,用PBS冲洗干净液氮速冻后于-80 ℃保存。收集近胃端空肠段1 cm,用PBS冲洗干净放入4%多聚甲醛固定(4 ℃)固定。
1.3.4 小肠组织形态学检测
将放入4%多聚甲醛固定的空肠进行冲水3 h后使用浓度递增的酒精脱水,酒精浓度依次为45%、55%、65%、75%、85%、95%、无水酒精进行脱水,二甲苯透明,石蜡包埋。对石蜡包埋块切片,厚度为5 μm,切片后再使用浓度递减酒精水化,酒精浓度依次为无水酒精、95%、85%、75%、65%,洗后进行 H&E(hematoxylin andeosin)染色。电子显微镜下观察各组小鼠空肠组织形态学变化并在100倍下采集图片,在软件Image-pro plus 6.0下进行测量。
1.3.5 小肠增殖蛋白免疫组化染色
石蜡包埋,切片厚度5 μm,在烘箱65 ℃烤片60 min,浓度递减酒精水化,采用柠檬酸钠进行抗原修复,加入10%过氧化氢室温下孵育30 min,磷酸盐缓冲液(PBS)洗涤3次×5 min,5%牛血清蛋白进行封闭,滴加PCNA单克隆抗体4 ℃过夜。第二天回收一抗,PBS洗涤3次×5 min,加入HRP标记的PCNA蛋白二抗,37 ℃孵育60 min,PBS洗涤3次×3 min,加入DAB后,UP冲洗和苏木精复染1 min,脱水后进行封片,在烘箱65 ℃烤片60 min,在显微镜400倍下进行观察并采集图像。
1.3.6 荧光定量PCR法检测小肠屏障、炎症因子mRNA表达水平
将-80 ℃冻存的小肠组织进行总RNA提取,用分光光度计测定RNA的浓度。随后,使用逆转录试剂盒将RNA逆转录为cDNA。采用实时荧光定量PCR(RT-qPCR)法检测,采用SYBR Green Master (Rox)(Roche)按照表1进行上机操作,每组实验重复3次。实验中所用的引物序列见表2。
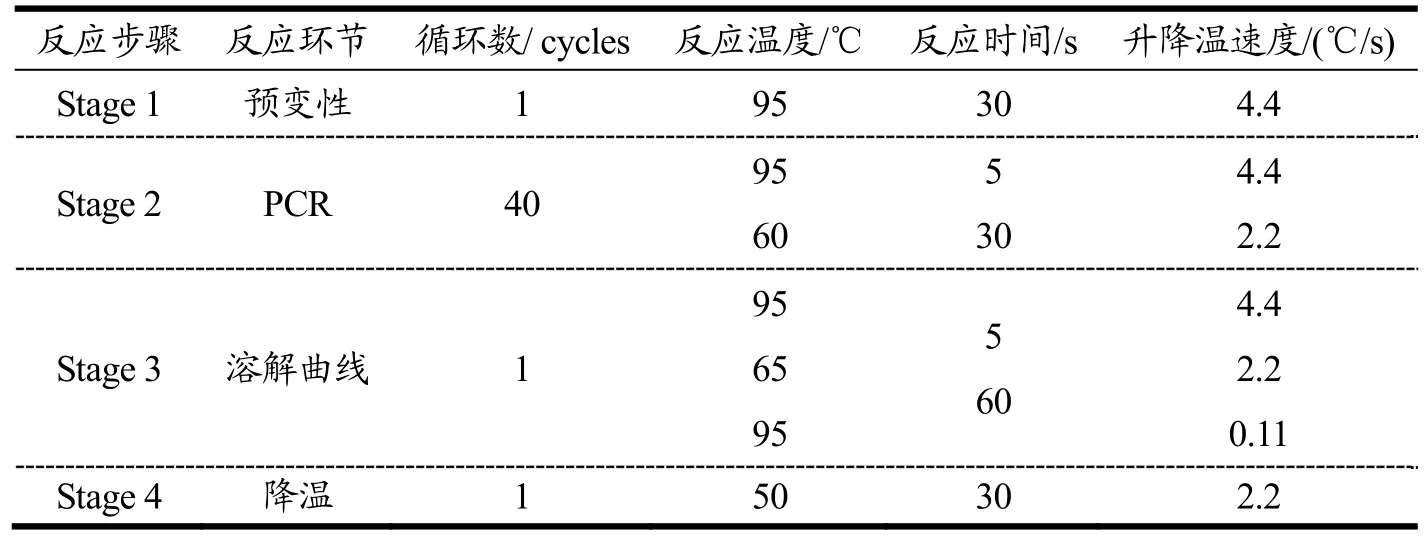
表1 RT-PCR扩增条件Table 1 RT-PCR Amplification conditions
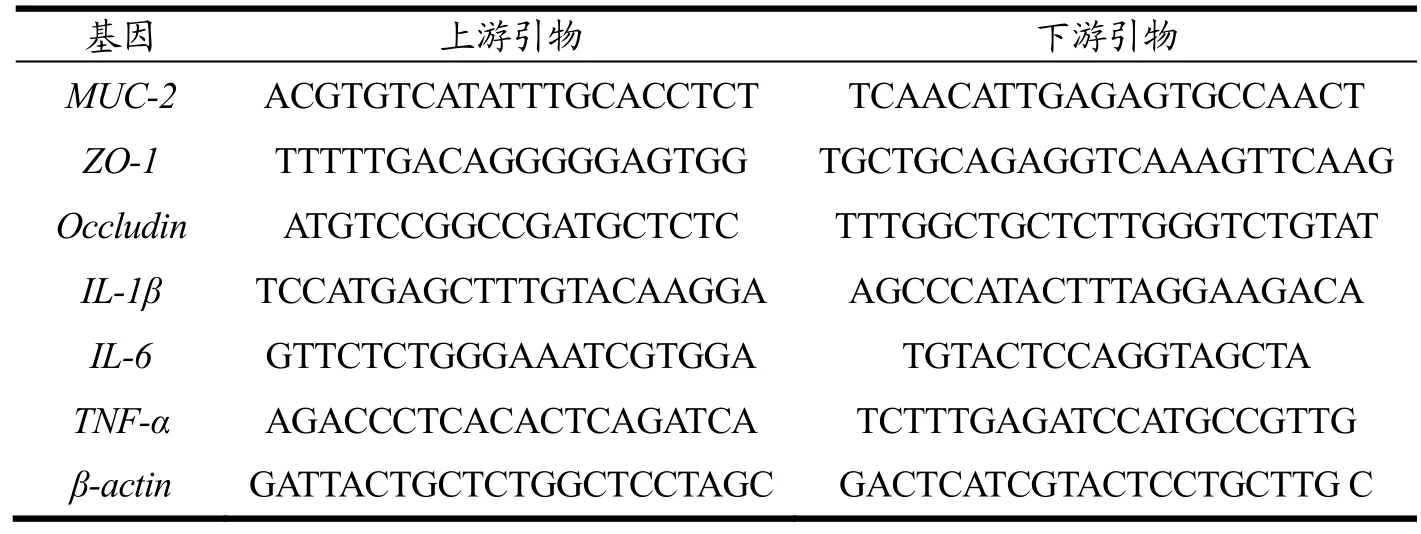
表2 RT-PCR引物序列Table 2 RT-PCR primer sequence
1.4 统计分析
实验数据采用GraphPad Prism 5.01统计作图软件进行处理,组间比较采用单因素方差分析和独立t检验,*表示p<0.05,差异显著,**表示p<0.01,差异更为显著,***表示p<0.001差异极显著。
2 结果与分析
2.1 三七叶水提物对肠道黏膜炎小鼠体重变化的影响
体重减轻是化疗性肠道炎一个重要的临床指标,严重影响化疗患者的生存质量[16]。如图1a所示,小鼠灌胃三七叶水提物14 d后,各组小鼠体重变化没有差异。从模型建立开始到实验结束,各组小鼠体重变化发生改变。如图1b所示,与对照组相比,模型组小鼠体重显著降低284.50%(p<0.001)。与模型组相比,三七叶水提物低、中、高剂量组体重分别增加26.89%、26.72%、49.24%(p<0.05),低、中剂量差异不显著。结果表明,5-FU诱导小鼠化疗性肠道黏膜炎后,小鼠体重显著降低,然而三七叶水提物可以逆转由 5-FU造成的小鼠体重的减轻。有研究表明,化疗引起的小鼠体重下降可能与肠道组织无法对食物进行吸收消化以及肠道微生态环境紊乱有关[17,18]。
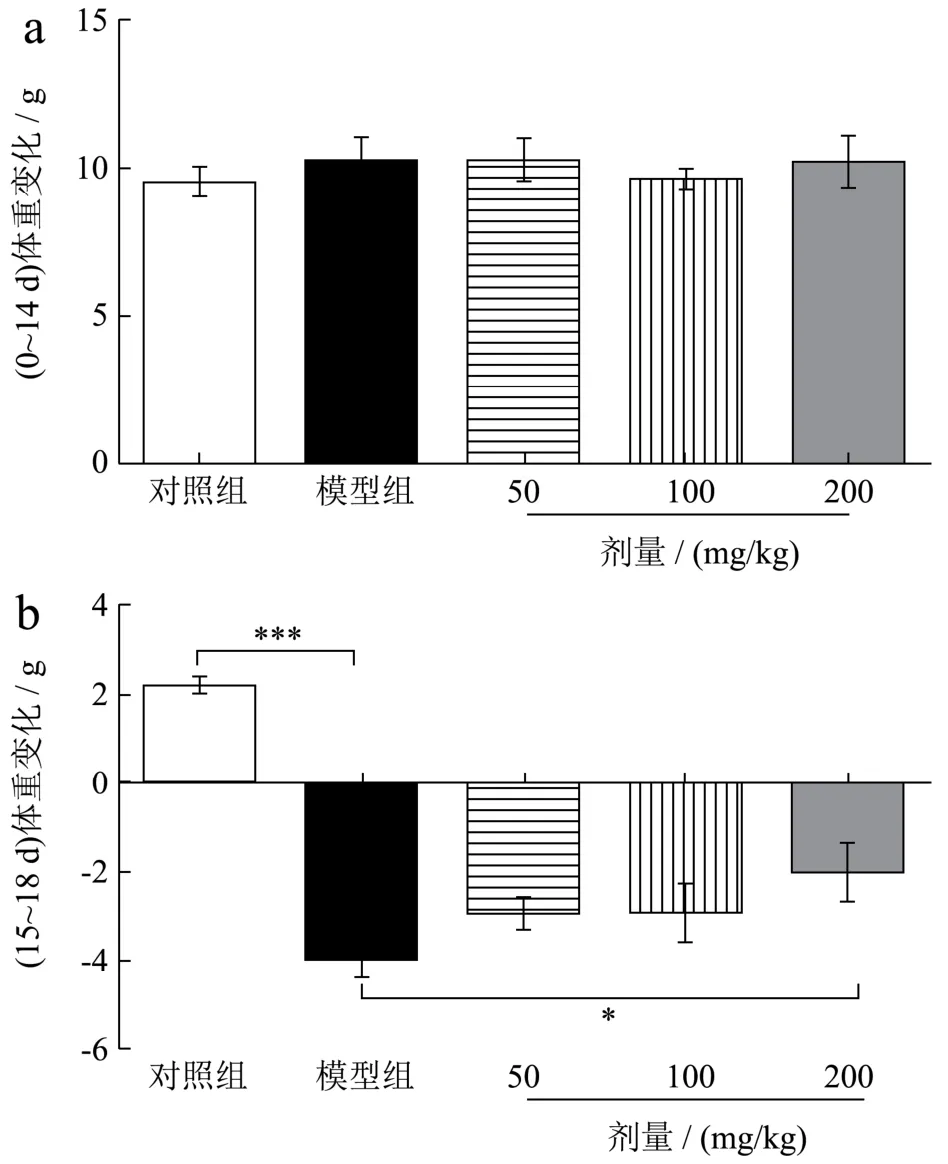
图1 三七叶水提物对化疗性肠道黏膜炎小鼠体重变化的影响Fig.1 Effect of Panax notoginseng leaf extract on weight change of mice with chemotherapy-induced intestinal mucositis
2.2 三七叶水提物对肠道黏膜炎小鼠小肠组织形态学的影响
小肠是消化和吸收的主要场所,也是最主要的吸收器官,这与小肠绒毛长度和隐窝深度有密切的关系。小肠绒毛上皮细胞将消化道中的氨基酸、葡萄糖、无机盐等吸收进血液,如果此部位受损,将影响上述营养物质的吸收,肠隐窝深度代表细胞的生成率,隐窝越浅细胞成熟度越好,分泌功能越好。绒毛缩短、隐窝深度增加、绒毛长度/隐窝深度比值下降都反映小肠黏膜损伤严重程度[19]。如图2所示,对照组小鼠小肠绒毛形态整齐规则,模型组绒毛形态萎缩、隐窝结构丧失,损伤较严重,三七叶水提物给药组绒毛萎缩、隐窝结构缺失情况减少,较模型组有所改善,高剂量组小肠组织结构与正常组小肠组织结构相接近。
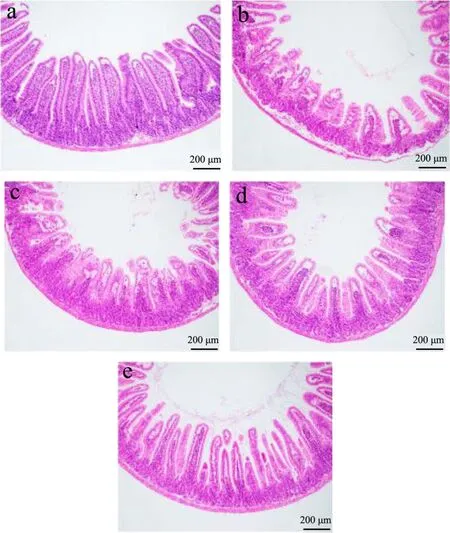
图2 各组小鼠小肠组织切片(HE染色,×100)Fig.2 Sections of small intestine in each group (HE staining,×100)
如图3a、b、c所示,与对照组比较,模型组小肠组织绒毛高度值显著降低38.26%(p<0.001)、隐窝深度显著增加56.96%(p<0.001)、小肠绒毛高度值与隐窝深度比值显著降低59.79%(p<0.001),这表明化疗性肠道黏膜炎动物模型建立成功[20]。与模型组比较,三七叶水提物低、中、高剂量组小肠绒毛高度值分别增加 12.25%(p<0.05)、18.57%(p<0.01)、22.92%(p<0.01)。隐窝深度值分别降低 5.71%、8.42%、16.27%(p<0.05),低剂量和中剂量差异不显著。小肠绒毛高度与隐窝深度的比值分别增加16.92%、24.8%(p<0.05)、42.32%(p<0.001),低剂量差异不显著,这可能与三七叶中生物活性成分多糖有关,有文献报道植物多糖可以明显改善 5-FU引起的组织形态学变化[5]。这就表明三七叶水提物能够有效缓解肠道黏膜炎小鼠肠道组织形态学的变化,并呈现剂量依赖性。
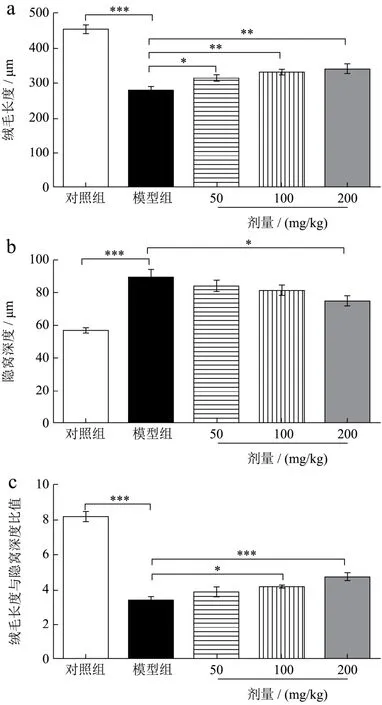
图3 三七叶水提物对化疗性肠道黏膜炎小鼠小肠组织形态学的影响Fig.3 Effect of Panax notoginseng leaves extract on intestinal histomorphology in mice with chemotherapy-induced intestinal mucositis
2.3 三七叶水提物对肠道黏膜炎小鼠小肠组织PCNA蛋白表达的影响
目前研究发现,化疗药物可直接损伤肠黏膜上皮细胞,引起肠上皮细胞损伤、凋亡;影响细胞增殖,阻碍肠黏膜修复[21],增殖细胞核抗原(PCNA)与细胞DNA合成关系密切,在细胞增殖的启动上起重要作用,PCNA是反映细胞增殖状态的良好指标[22]。本研究采用免疫组织化学法对小肠PCNA蛋白表达进行检测。如图4所示,与对照组相比,模型组PCNA蛋白表达量显著降低36.48%(p<0.001),说明模型组肠道隐窝细胞严重受损,细胞增殖能力大大减弱。与模型组相比,三七叶水提物低、中、高剂量组PCNA蛋白表达量分别增加3.08%、21.02%(p<0.05)、21.54%(p<0.05),但低剂量没有显著性差异,这与 DongWenqin等[23]研究结果一致。结果表明,三七叶水提物可以促进化疗性肠道黏膜炎小鼠小肠细胞增殖,从而缓解化疗引起的小鼠肠道黏膜炎。
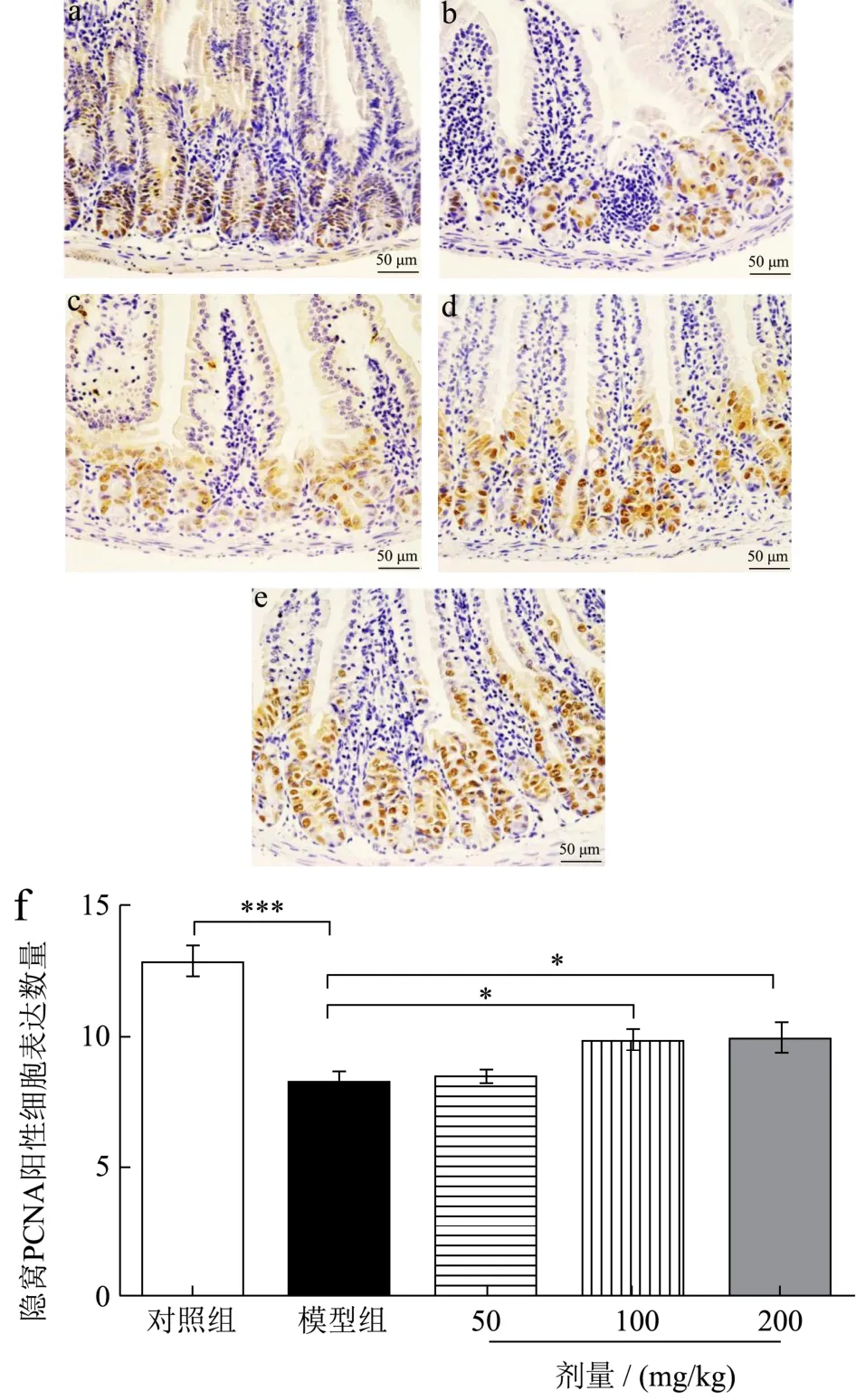
图4 三七叶水提物对化疗性肠道黏膜炎小鼠小肠PCNA蛋白表达的影响(IHC染色,×400)Fig.4 Effect of Panax notoginseng leaf extract on expression of PCNA protein in small intestine of mice with chemotherapy-induced intestinal mucositis (IHC staining,×400)
2.4 三七叶水提物对肠道黏膜炎小鼠小肠组织MUC-2、ZO-1、Occludin mRNA表达的影响
肠道黏膜屏障主要由上皮细胞和细胞间紧密连接构成,是阻碍大分子有害物质进入机体的重要屏障[24],化疗性肠道黏膜炎会破坏肠粘膜屏障,导致功能的丧失,肠道屏障标志物MUC-2、ZO-1、Occludin可反应肠道屏障功能的完整性[25]。如图5a~c所示,与对照组相比,模型组MUC-2、ZO-1、OccludinmRNA表达量分别显著降低65.52%(p<0.01)、70.07%(p<0.01)、76.05%(p<0.001),证明受化疗药物影响,肠道屏障严重受损。与模型组相比,三七叶低剂量组MUC-2、ZO-1、OccludinmRNA表达量分别增加 84.67%、115.17%(p<0.05)、91.73%,MUC-2与OccludinmRNA表达量差异不显著。三七叶中剂量组MUC-2、ZO-1、OccludinmRNA表达量分别增加 100.63%、170.61%(p<0.05)、115.24(p<0.05),MUC-2mRNA 表达量差异不显著。三七叶高剂量组MUC-2、ZO-1、OccludinmRNA 表达量分别增加 157.66%(p<0.05)、167.73%(p<0.01)、212.14(p<0.05)。这与de Barros P A V等[4]研究结果一致。研究表明,三七叶水提物对化疗性肠道黏膜炎小鼠小肠屏障具有一定的保护作用。
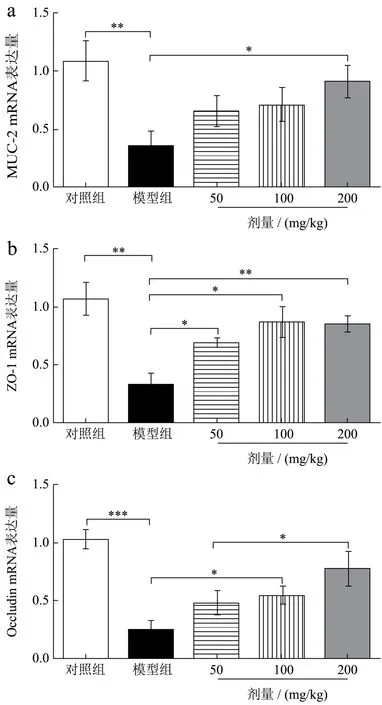
图5 三七叶水提物对肠道黏膜炎小鼠小肠组织MUC-2、ZO-1、Occludin mRNA表达的影响Fig.5 Effects of Panax notoginseng leaf extract on the expression of MUC-2, ZO-1 and Occludin mRNA in small intestine of mice with intestinal mucositis
2.5 三七叶水提物对肠道黏膜炎小鼠小肠组织IL-1β、IL-6、TNF-α mRNA表达的影响
研究发现,肠道细胞凋亡可促进肠细胞炎症因子的分泌,在肠道黏膜炎病变过程中炎症因子IL-1β、IL-6、TNF-α起着十分重要的作用,大量炎症因子的分泌会导致肠粘膜功能紊乱,炎症因子(如IL-1β、IL-6、TNF-α)是衡量肠道黏膜损伤的严重程度和修复重要指标[26]。如图6a、b、c所示,与对照组相比,模型组IL-1β、IL-6、TNF-αmRNA 表达分别增加 128.29%(p<0.001)、160.71%(p<0.05)、58.84%(p<0.01)。说明化疗药物可增加肠道炎症因子的表达,肠道严重损伤。与模型组相比,三七叶水提物低剂量IL-1β、IL-6、TNF-αmRNA表达分别下降15.72%、28.57%、25.52%,没有显著性差异。三七叶水提物中剂量IL-1β、IL-6、TNF-αmRNA 表达分别下降32.61%(p<0.05)、34.33%、45.05%(p<0.05),IL-6mRNA表达差异不显著。三七叶水提物高剂量IL-1β、IL-6、TNF-αmRNA表达分别下降 34.24%、35.18%、33.52%(p<0.05),IL-1β与IL-6mRNA表达差异不显著。研究表明,三七叶水提物可抑制肠道黏膜炎小鼠小肠炎症因子的表达。这与Bi Xiuli等[27]研究结果一致,三七叶水提物具有抗炎活性。

图6 三七叶水提物对肠道黏膜炎小鼠小肠组织IL-1β、IL-6、TNF-α mRNA表达的影响Fig.6 Effects of Panax notoginseng leaves extract on the expression of IL-1 β, IL-6 and TNF-α mRNA in small intestine of mice with intestinal mucositis
3 结论
综上所述,在5-FU诱导肠道黏膜炎模型中,三七叶水提物可以逆转小鼠体重下降、维持小肠组织形态学结构、促进小肠隐窝细胞增殖、保护肠道屏障、抑制肠道炎症因子表达,表明三七叶水提物可以有效地预防化疗性肠道黏膜炎。但是具体的作用机制还不清楚,有待于更进一步研究,也为三七的综合开发利用提供了实验依据。
