鹿茸血酶解肽对脂多糖诱导的H9c2大鼠心肌细胞损伤的保护作用
2021-09-02尹馨雪兰梦郅慧张辉李晶峰
尹馨雪,兰梦,郅慧,张辉,李晶峰
(1.长春中医药大学吉林省人参科学研究院,吉林长春 130117)(2.吉林省东北亚生物科技有限公司,吉林长春 130000)
心力衰竭(Heart Fialure,HF)是严重危害人类健康的一种病理综合征,与恶性肿瘤病人死亡率相仿,见于各种心血管疾病。近年来,随着心血管疾病患者的增多、社会医疗水平的提高以及全球老龄化,心力衰竭人数的不断增多已成为重要社会公众卫生问题[1]。心肌细胞损伤凋亡及过度分泌炎症因子是导致心力衰竭的重要因素。因此抑制心肌细胞损伤凋亡及其产生的炎症因子对于心力衰竭的防治具有积极的意义[2]。
鹿血是梅花鹿(Cervus nipportTemminck)或马鹿(Cervus elaphusLinnaeus)的膛血或茸血,系传统的名贵中药。近年来,鹿血产品的研发受到广泛关注,目前鹿血产品主要形式为鹿血酒、鹿血口服液、鹿血口嚼片、鹿血滋补胶囊[3],作为特色药食同源食品,市面上也出现了鹿血蛋羹、鹿血粥等产品[4]。鹿血中的主要成分是蛋白质,含量占13%以上,蛋白质是由肽组成的[5],鹿血肽是指鹿血中的蛋白质被蛋白酶水解产生的多肽,活性较好,具有特殊的生物学功能,比蛋白质更易被人体吸收[6]。现代临床研究表明,鹿血肽在补血、强心、抗氧化、提高免疫力、抗衰老等方面有显著疗效[7]。姜红等[8]通过体外实验研究发现鹿茸血水解肽能明显提高小鼠脾脏、胸腺指数,同时,能极显著地提高小鼠血清总抗氧化能力,证明了鹿茸血水解肽能有效的提高机体免疫力和抗氧化能力;付彩霞等[9]研究发现鹿血酶解液可提高模型小鼠的血清活力、降低肝脏中的丙二醛(MDA)含量和抑制单胺氧化酶B(MAO-B)的活力,从而证明鹿血酶解液具有抗衰老作用;王博[10]等人通过采用鹿血灌流离体心脏方法,观察鹿血对离体心脏的直接效应,发现鹿血可明显增强离体牛蛙心脏的心肌收缩力,证明了鹿血具有增强心肌收缩力的作用,进一步反映了鹿血对心脏的强心作用。
鹿血在治疗心力衰竭方面的相关文献较少,现有研究表明,鹿血的低胆固醇含量,以及其中的各种酶对心血管疾病具有一定的治疗作用[10]。本研究选用超滤技术将鹿茸血酶解肽分成不同的分子量,采用 LPS诱导H9c2细胞损伤,通过考察其对损伤后H9c2细胞增殖抑制活性的影响,筛选鹿茸血酶解肽对LPS诱导的H9c2细胞损伤具有保护作用的活性组分,以及最佳组分对H9c2细胞分泌炎症因子的影响,在细胞水平上探讨鹿茸血酶解肽对LPS诱导的H9c2细胞损伤的保护作用,对鹿血的开发及应用有显著意义。
1 材料与方法
1.1 材料与仪器
梅花鹿鹿茸血,通化承诚药业有限公司;碱性蛋白酶,上海宝曼生物科技有限公司;大鼠心肌细胞(H9c2),广州赛库生物技术有限公司;卡托普利,上海源叶生物科技有限公司;脂多糖LPS,索宝来公司;噻唑蓝(methyl thiazolyl tetrazolium,MTT),美国Amresco公司;胎牛血清,美国Gibco公司;DMEM高糖培养基,美国Hyclone公司;二甲基亚砜(dimethyl sulfoxide,DMSO),天津市光复精细化工研究所;TNF-α、IL-6、IL-1β试剂盒,长春百金生物科技有限公司;其他试剂均为国产分析纯。
GZLY-0.4药用真空冷冻干燥机,北京速原中天科技有限公司;DF-101S集热式恒温加热磁力搅拌器,郑州市英峪予华仪器有限公司;680型酶标仪,上海伯乐生命医学产品有限公司;L-8900型氨基酸自动分析仪,日本日立公司。
1.2 实验方法
1.2.1 鹿茸血酶解肽的制备
取一定量用纱布过滤好的新鲜鹿茸血,按底物浓度5%加入蒸馏水,调节pH为10.4,按4400 U/g加入一定量的碱性蛋白酶,52 ℃下酶解5 h,反应过程中不断加入1 mol/L NaOH或HCl维持pH恒定在10.4,水解反应结束后沸水浴灭酶30 min,迅速冷却,水解液3800 r/min离心30 min[8]收集上清液冷冻干燥,得到鹿茸血酶解肽冻干粉(DBP)备用。
1.2.2 超滤膜分级不同分子量
2.1 2012-2016年剖宫产率变化 2012-2016年本院分娩的孕产妇总数为8 729例,其中剖宫产3 000例,剖宫产率为34.37%。2012-2016年剖宫产率在28.03%~41.62%区间波动,呈下降趋势,差异有统计学意义(χ2=26.74,P<0.05)。见表1。
用10 ku、3 ku、1 ku超滤膜将提取液分为总提液、大于10 ku、3~10 ku、1~3 ku、小于1 ku五个分子质量段。分别命名为DBP-1、DBP-2、DBP-3、DBP-4、DBP-5冻干备用。以对受损伤的H9c2细胞的抑制活性影响筛选最佳活性组分。
1.2.3 鹿茸血酶解肽对大鼠心肌细胞增殖抑制活性及炎症因子分泌的影响
1.2.3.1 细胞培养H9c2细胞
细胞用含10%胎牛血清的DMEM(改良型)培养液,置于37 ℃、5% CO2培养箱中培养,选取对数生长期的细胞用于实验。
1.2.3.2 MTT法测定不同组分对细胞增殖抑制率的影响
取对数生长期的细胞,调密度为每孔4×103个细胞,将混悬细胞液接种至96孔培养板上,放入37 ℃、5% CO2培养箱中培养24 h,模型组、阳性组与样品组加入100 μL的1 μg/mL LPS造模,空白对照组加入100 μL含10%胎牛血清的DMEM培养液;培养24 h,样品组加入150 μL浓度为25 μg/mL、50 μg/mL、100 μg/mL、200 μg/mL、400 μg/mL的各个组分的鹿茸血酶解肽溶液,阳性对照组为150 μL的10 μg/mL卡托普利,每组5个复孔。在37 ℃、5% CO2条件下培养24 h,每孔加入10 μL的5 mg/mL MTT,4 h后弃去上清液,加入DMSO 150 μL,振荡5 min,于490 nm波长处测其OD值。计算细胞增殖抑制率。实验独立重复3次。
细胞增殖抑制率/%=[(A模型组-A给药组)/A模型组]×100%
1.2.3.3 鹿茸血酶解肽对H9c2细胞释放TNF-α、IL-6、IL-1β水平的影响
将对数生长期细胞接种于96孔培养板,调密度为每孔4×103个细胞,于37 ℃、5% CO2培养箱中培养24 h,模型组、阳性对照组、空白组设定方法同1.2.3.2,样品组加入150 μL的 25、50、100、200、400 μg/mL的DBP-5样品溶液,每组5个复孔。于37 ℃、5% CO2条件下培养 24 h后,取上清液 150 μL,按TNF-α、IL-6、IL-1β试剂盒说明书测定各炎症因子的分泌量。实验独立重复3次。
1.2.4 鹿茸血酶解肽氨基酸组成分析
取分子量小于 1 ku的鹿茸血酶解肽冻干粉(DBP-5)10 mg,加入10 mL 6 mol/L的盐酸,配成浓度为1 mg/mL的溶液,110 ℃水解24 h,氨基酸自动检测仪测定氨基酸组成[11]。
1.2.5 数据统计
每个样品重复试验 3次,结果取平均值,采用SPSS 21.0软件进行数据统计分析显著性,计量数据以±s表示,组间比较采用单因素方差分析和t检验;响应面试验结果应用Design Expert 10软件分析。
2 结果与讨论
2.1 鹿茸血酶解肽对受损伤的H9c2细胞增殖抑制的影响
由表1各组细胞增殖抑制率可以看出,与空白组相比,LPS模型组细胞显著增殖(p<0.01),增值率为36.38%,证明LPS模型造模成功;与LPS模型组相比,各给药组均不同程度地抑制受损伤的H9c2细胞增殖,其中DBP-5组分活性最强。在25~200 μg/mL质量浓度范围内,细胞增殖抑制率随着样品浓度的增高而增高,且在25~200 μg/mL范围内呈现浓度依赖性,当浓度超过 200 μg/mL时,细胞增殖抑制率开始下降。在 200 μg/mL质量浓度下,鹿茸血酶解肽对受损伤的H9c2细胞抑制作用最为显著(p<0.001)。综上所述鹿茸血酶解肽各组分对受损伤的H9c2细胞增值抑制活性结果为:组分DBP-5在200 μg/mL质量浓度下活性最佳,与阳性对照组最为接近,对细胞的抑制率达到35.12%。代天[12]等人研究发现黄花倒水莲能够降低受损伤的H9c2细胞的增殖抑制率,从而来保护LPS诱导的大鼠心肌细胞损伤,与本文结果相似。
表1 各组细胞增殖抑制率Table 1 Cell proliferation in-hibitory rate in each group (±s, n=3)
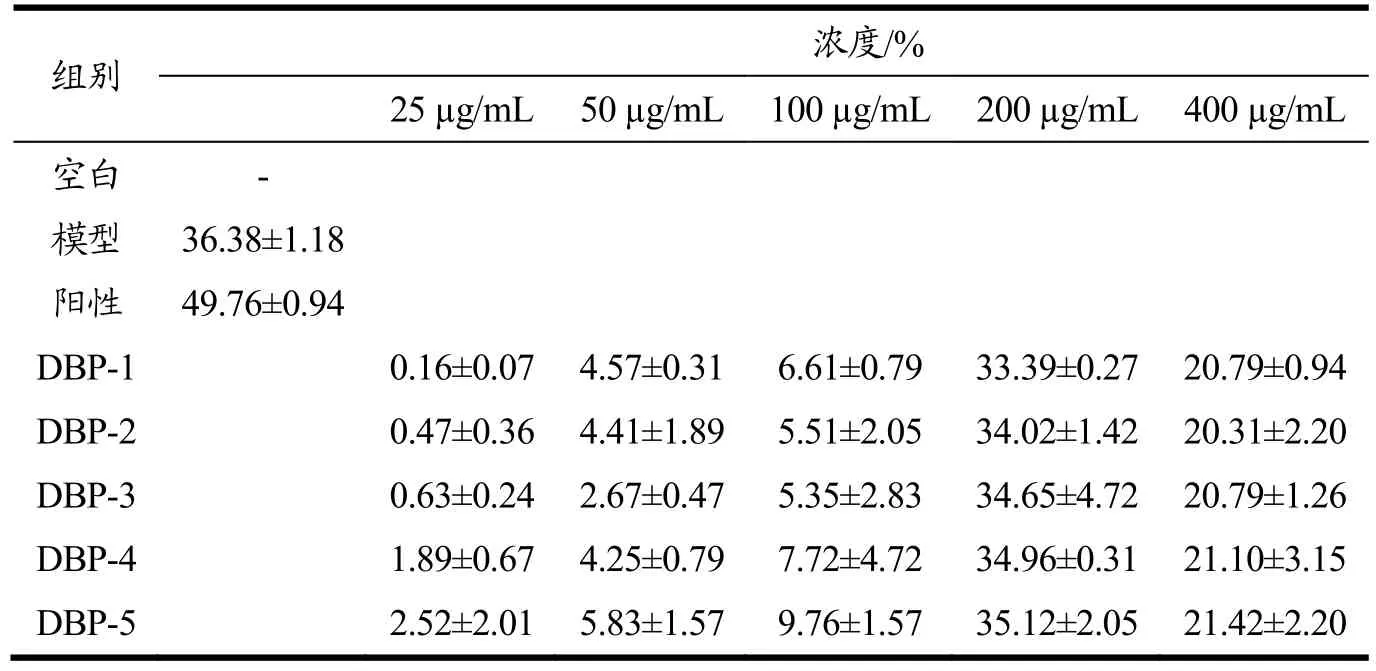
表1 各组细胞增殖抑制率Table 1 Cell proliferation in-hibitory rate in each group (±s, n=3)
组别 浓度/%25 µg/mL 50 µg/mL 100 µg/mL 200 µg/mL 400 µg/mL空白 -模型 36.38±1.18阳性 49.76±0.94 DBP-1 0.16±0.07 4.57±0.31 6.61±0.79 33.39±0.27 20.79±0.94 DBP-2 0.47±0.36 4.41±1.89 5.51±2.05 34.02±1.42 20.31±2.20 DBP-3 0.63±0.24 2.67±0.47 5.35±2.83 34.65±4.72 20.79±1.26 DBP-4 1.89±0.67 4.25±0.79 7.72±4.72 34.96±0.31 21.10±3.15 DBP-5 2.52±2.01 5.83±1.57 9.76±1.57 35.12±2.05 21.42±2.20
2.2 鹿茸血酶解肽对H9c2细胞释放TNF-α、IL-6、IL-1β水平的影响
2.2.1 鹿茸血酶解肽对H9c2细胞释放TNF-α水平的影响
TNF-α是一种细胞因子,具有多种生物学活性。与受体结合能产生多种生物学效应,如激活蛋白激酶 C、免疫刺激,以及涉及多种炎症、细胞生长的基因表达和激活等。目前研究表明,心肌是发生心衰时生物合成TNF-a的主要器官。终末期心衰患者血浆TNF-α水平升高,TNF-α对心脏的影响可能表现为抑制心肌收缩力、影响心肌重构、促发心肌细胞凋亡等3个方面[13]。由图1可知,给药后 H9c2细胞上清液中TNF-α含量均有不同程度的降低,模型组的TNF-α释放量为531.05 pg/mL。鹿茸血酶解肽质量浓度为200 μg/mL时,对受损伤的H9c2细胞释放TNF-α的量抑制作用最强(p<0.001),TNF-α释放量为357.93 pg/mL,抑制率提高了32.60%。质量浓度超过200 μg/mL时,TNF-α释放量开始升高。相似研究表明[14],黄芪多糖对大鼠心肌细胞肥大的保护作用与减少受损伤的H9c2细胞TNF-α的分泌量有关。本研究中的鹿茸血酶解肽同样能够通过减少受损伤的H9c2细胞TNF-α分泌量来达到对心肌细胞的保护。
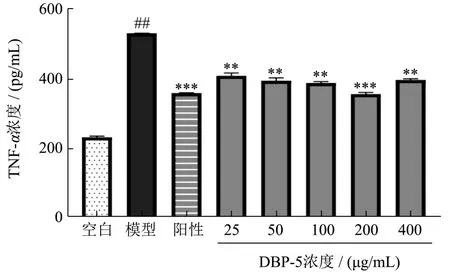
图1 各组细胞培养液中TNF-α含量测定结果Fig.1 Shows the determination results of TNF-α content in the cell culture medium of each group (±s, n=3)
2.2.2 鹿茸血酶解肽对H9c2细胞释放IL-6水平的影响
IL-6是一种小分子可溶性糖蛋白,参与免疫反应、细胞生长、增殖、迁移等多种病理生理反应。流行病学证据显示血浆IL-6水平与冠心病发病风险密切相关。临床研究亦显示血浆IL-6水平和冠心病发病率、非致死性心梗、冠心病死亡明显相关[15]。由图2可知,不同质量浓度的鹿茸血酶解肽对受损伤的H9c2细胞释放IL-6的量均有抑制作用。模型组的IL-6释放量为 185.41 pg/mL。在质量浓度达到 200 μg/mL时,IL-6释放量达到最低(p<0.01),为148.69 pg/mL,抑制率提高了 19.80%。质量浓度超过 200 μg/mL时,IL-6释放量开始升高。相似研究证实[16],IL-6参与心衰心肌细胞凋亡,进展期心衰患者心肌细胞IL-6 mRNA表达增加,心力衰竭患者血浆IL-6水平升高。
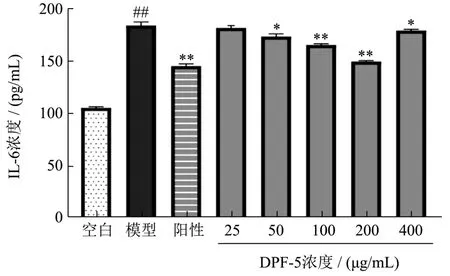
图2 各组细胞培养液中IL-6含量测定结果Fig.2 Shows the determination results of IL-6 content in the cell culture medium of each group (±s, n=3)
2.2.3 鹿茸血酶解肽对 H9c2细胞释放 IL-1β水平的影响
IL-1β是细胞凋亡过程中的重要炎症因子之一,NF-κB是核转录因子,通过调节炎症因子、趋化因子等,在免疫、炎症、凋亡中发挥重要作用[17],其既可调节其下游的促炎症因子肿瘤坏死因子 IL-1β的表达,又可被其反馈激活,进而放大炎症反应,上调NF-κB的表达,诱导细胞凋亡[18];由图3可知,随着则鹿茸血酶解肽质量浓度的升高,IL-1β的释放量逐渐降低。模型组的IL-1β释放量为70.03 pg/mL,在质量浓度达到200 μg/mL时,IL-1β的释放量达到最低(p<0.01),与阳性对照组最为接近,为 62.72 pg/mL,抑制率提高了10.44%。当质量浓度超过200 μg/mL时,IL-1β的释放量开始升高。表明鹿茸血酶解肽可能通过抑制 IL-1β的释放量来发挥其对 LPS诱导的 H9c2细胞的保护作用,且在质量浓度达到200 μg/mL时活性最佳。相似研究表明[17],黄芪多糖通过减少受 LPS诱导损伤的 H9c2细胞分泌TNF-α、IL-1β的量,进而减轻心肌细胞凋亡,从而保护心肌细胞。
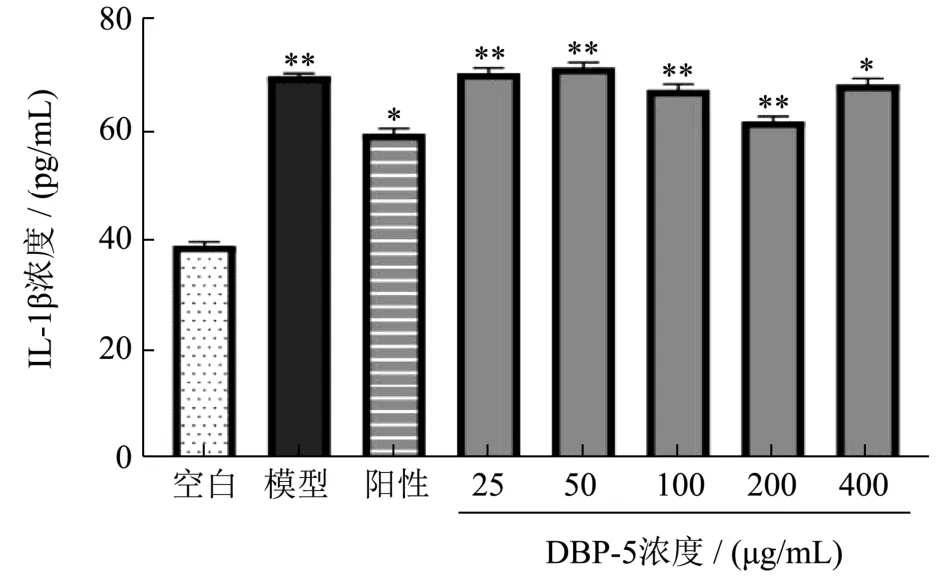
图3 各组细胞培养液中IL-1β含量测定结果Fig.3 Shows the determination results of IL-1β content in the cell culture medium of each group (±s, n=3)
2.3 鹿茸血酶解肽的氨基酸组成
鹿血酶解肽氨基酸组成分析结果及含量如表2所示。由表2可知,鹿血酶解肽中含有17种氨基酸,其中Lys含量在鹿血酶解肽氨基酸总含量中占比最高,占17.81%;刘君雯[19]等人研究发现Lys可使p53蛋表达显著降低,使bcl-2蛋白表达显著增高,并使bcl-2/bax比值增高,从而抑制细胞损伤凋亡。初步认为Lys可能是其保护机体、减少凋亡的机制之一。人体必需氨基酸(Lys、Phe、Val、Leu、Thr、Ile、Met)含量较高,占氨基酸总含量的 52.78%。Thr、Ile、Met低于人体必需氨基酸模式,其它几种必需氨基酸均高于或与人体模式相近。这表明鹿血具有较高的营养价值以及保健功能。黄开华等人用胰蛋白酶酶解鹿血制备抗氧化活性肽时Leu、Lys和Ala的质量分数较高,分别为17.2%、12.3%和12.1%,与碱性蛋白酶酶解结果有所差异,这可能与酶对氨基酸形成肽键的催化水解有较强的专一性有关[20]。
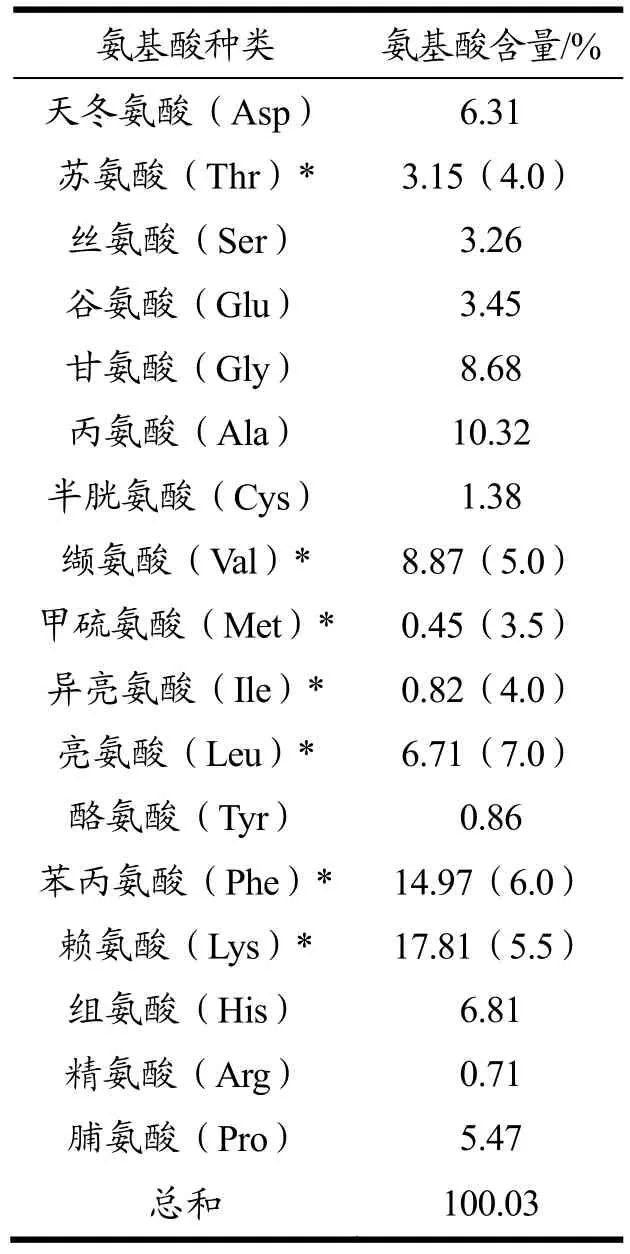
表2 鹿茸血酶解肽氨基酸组成及含量Table 2 Deer antler blood enzymatic peptide amino acid composition and content
3 结论
本实验结果表明不同组分及不同浓度的鹿茸血酶解肽均可抑制损伤的H9c2细胞的增殖,其中组分DBP-5、浓度为200 μg/mL的鹿茸血酶解肽对受损伤的H9c2细胞的抑制作用最强(p<0.001),抑制率为35.12%。组分DBP-5质量浓度达到200 μg/mL时,给药后 H9c2细胞上清液中炎症因子 TNF-α(p<0.001)、IL-6(p<0.01)、IL-1β(p<0.01)释放量与模型组相比达到最低,鹿茸血酶解肽中具有抑制细胞损伤凋亡的Lys含量最高,证明了鹿茸血酶解肽对LPS诱导的H9c2细胞具有一定的保护作用,且茸鹿血酶解肽对LPS诱导的H9c2细胞的保护作用与其抑制炎症因子的释放密切相关。但是中药在治疗疾病时具有多途径、多靶点的特点[21],所以鹿血肽在治疗心血管疾病方面的作用值得深入研究。
