黑曲霉N5-5产单宁酶的酶学性质与固定化
2021-09-02何泽琪刘果阚启鑫杨国航曹庸
何泽琪,刘果,阚启鑫,杨国航,曹庸
(华南农业大学食品学院,广东广州 510642)
单宁是仅次于木质素的第二大类植物多酚,被认为是难降解、难消化且对机体有毒害的物质[1]。单宁酶作为单宁酸分解技术相关的重要酶类,因其安全性较高而被广泛研究。单宁酶(EC,3.1.1.20)是一种广泛存在于微生物和植物中的诱导酶,尤其是在以单宁酸为原料的丝状真菌中可以大量生产[2]。单宁酶的主要特征是它对复杂的多酚具有活性,如可水解没食子酸单宁中的酯键和缩酚羧键,生成没食子酸和葡萄糖[3],还能够水解复合型单宁、没食子酸烷基酯以及绿原酸等物质[4]。因此单宁酶已被广泛应用于食品,饮料,酿造,医药,化工等行业[5]。
目前单宁酶生产的主要方法为微生物发酵法,对曲霉属、青霉属、根霉属的真菌及乳杆菌等细菌发酵生产单宁酶的报道较多。液体深层发酵和固态发酵是生产单宁酶的两种主要方式,它们各有利弊:固态发酵生产的单宁酶主要是胞外酶,具有易回收、酶活高、稳定性好等优点,但不利于均匀调控;液体发酵虽代谢参数易于调控,但发酵所得单宁酶酶活不高且回收成本较高[6]。故本研究以液体扩培形成菌丝体,结合常规固体发酵的方式,对黑曲霉进行培养。
游离单宁酶在使用过程中存在热稳定性差、使用寿命短、回收重复利用难等缺点,这极大地限制了单宁酶的工业运用[7]。常规的喷雾干燥、冷冻干燥等手段,能使酶延长存储时间。除此之外,采用有效的固定化技术制备固定化单宁酶,可以将单宁酶多次循环使用从而降低单宁酶使用成本,还可以提高单宁酶的理化性质及生物稳定性[8],人们将单宁酶固定到载体上来改善其使用性能,常使用的固定化载体有壳聚糖、玉米芯等[9,10]。树脂材料由于类型多、成本低且具有稳定的理化性质,也被用作为酶的固定化载体[10],且很多已实现了商业化生产。黑曲霉N5-5为本课题组自行筛选和诱变选育的一种单宁酶高产菌株,前期均以小规模进行实验,研究发现具有良好的水解没食子酸丙酯能力[11]。为了黑曲霉 N5-5发酵产单宁酶的进一步研究与推广,本研究对酶进行扩培,研究其酶学性质,并进行纯化、干燥、固定化等步骤的试验,以期为N5-5所产单宁酶的工业化应用提供参考。
1 材料与方法
1.1 材料
1.1.1 原料
黑曲霉N5-5(保藏号:CCTCC M 2014051):华南农业大学食品学院广东省天然活性物食品实验室-80 ℃冻存;树脂:购自杭州科创有限公司;麸皮:购自永和饲料厂。
1.1.2 主要仪器设备
UV-VIS紫外分光光度计,日本岛津;TUS-200型振荡型恒温金属浴,上海一恒科学有限公司;DHZ-C型恒温振荡器,太仓市强乐实验设备有限公司;FD-1PF型立式冷冻干燥机,北京德天佑科技发展有限公司;生化培养箱,上海一恒科学仪器有限公司;液相色谱、DHG-970电热恒温鼓风干燥箱,上海齐心科学仪器有限公司;LC-10Avp plus分析型高效液相色谱,日本岛津。
1.2 方法
1.2.1 培养基配制
斜面培养基:取2 g PDA成品培养基,自然pH,定容至50 mL,加热溶解分装于试管中,121 ℃灭菌20 min。
液体培养基:称取单宁酸20 g,蔗糖10 g,硝酸钠3 g,磷酸氢二钾1 g,硫酸铁0.01 g,硫酸镁0.5 g,定容至 1 L。50 mL每瓶分装于 200 mL培养瓶中,121 ℃灭菌20 min。
固体培养基:称取麸皮450 g,硝酸铵5 g,硫酸镁0.5 g,氯化钠0.5 g,磷酸二氢钾4 g,单宁酸460 g,加蒸馏水500 mL,121 ℃灭菌20 min。
柠檬酸-柠檬酸三钠缓冲液配制:称取柠檬酸2.10 g和柠檬酸三钠2.94 g,分别溶解并于100 mL容量瓶中定容,二者浓度均为0.1 mol/L。将柠檬酸与柠檬酸三钠溶液1:2体积比混合,得柠檬酸-柠檬酸三钠缓冲液(下简称柠檬酸缓冲液)。
1.2.2 黑曲霉N5-5发酵培养
1.2.2.1 液体扩培
参考Jana[12]等的方法,略有修改。将黑曲霉N5-5接种于PDA斜面,30 ℃培养54 h进行活化。用15 mL已灭菌的 0.9%生理盐水将孢子洗下,形成孢子悬浮液。每瓶液体培养基中加入 1 mL孢子悬浮液,置于30 ℃摇床中震荡培养72 h。
1.2.2.2 固体发酵
将液体培养所得菌丝体溶液,以100 mL/kg比例加入固体培养基中,翻拌均匀。30 ℃发酵6 d。
1.2.3 单宁酶酶液制备
1.2.3.1 粗酶液的制备
固体发酵结束后,参照张帅[13]等的方法进行提酶,略有修改。固体培养基中加入柠檬酸-柠檬酸钠缓冲液,培养基与缓冲液按质量比1:1混合,并充分搅拌浸提 1 h。得到的混合物先用四层纱布过滤去除大颗粒杂质,再用150目滤布过滤,所得滤液即为粗酶液。
1.2.3.2 酶液的纯化
将粗酶液用截留分子量为 60 ku的陶瓷膜进行过滤浓缩,得到陶瓷膜过滤液和截留液,并检测理化性质及酶活。
1.2.4 单宁酶理化性质的研究
1.2.4.1 固形物含量
取洁净的培养皿,置烘箱内105 ℃干燥后冷却至室温称重,重复此过程至连续两次干燥后称重差异在0.5 mg以下。取 1 mL搅拌均匀的酶液于培养皿中,105 ℃烘箱干燥5 h。5 h后迅速取出放入干燥器中,冷却至室温后称重。同样重复此干燥过程至样品连续两次干燥后称重差异在0.3 mg以下。
1.2.4.2 蛋白含量
采用考马斯亮蓝法[14]。以BSA为标准蛋白,与考马斯亮蓝G-250试剂作用后,在595 nm波长处测定吸光度。以标准蛋白质含量(μg)为横坐标,吸光度为纵坐标,建立标准曲线。1 mL样品溶液按上述步骤操作,蛋白质量浓度可由标准曲线求出。得到回归方程Y=0.0057X,R2=0.9859,可见该曲线拟合良好,可作为样品中蛋白质量浓度计算的方程模型。
1.2.5 酶活的测定
酶解反应体系:500 μL酶液+500 μL 10%单宁酸,45 ℃反应12或24 h。后以100 ℃,20 min灭活。(另做空白扣除单宁酸自身分解的影响:酶液先以100 ℃加热20 min灭活,然后迅速冰浴降温,再加入500 μL的10%单宁酸进行反应),反应一定时间后测定酶活。
1.2.5.1 薄层层析快速检测酶活
展开剂:甲苯:乙酸乙酯:甲酸=10:18:2;显色剂:0.1%的氯化铁溶液(无水乙醇定容);将硅胶板于105 ℃,活化0.5 h后冷却至室温。样品点样量为2 μL,于层析缸中展开。展开到3/4高度左右,取出硅胶板,晾干,喷显色剂或紫外下显色。
1.2.5.2 高效液相色谱定量检测
参照张迎杰[15]的检测方法,略有改动。样品统一稀释100倍,过膜后进液相检测;流动相为0.1%磷酸水与甲醇,检测波长为275 nm,进样量10 μL,流速1 mL/min;洗脱程序为0~10 min,甲醇浓度10%;10~20 min,甲醇浓度10%~90%;20~25 min,甲醇浓度90%。
1.2.5.3 没食子酸标曲的制作
选取5个浓度的没食子酸溶液,按2.3.2条件进行液相色谱分析。以进样浓度为横坐标,峰面积为纵坐标得到标准曲线,计算得到回归方程Y=3×107X-542909,R2=0.995,可见该曲线拟合良好,可作为样品中蛋白质量浓度计算的方程模型。
1.2.6 单宁酶活力的研究
1.2.6.1 酶解能力与底物浓度的探索
将纯化后酶液冻干,复溶后配置成冻干前蛋白浓度,分别与 10%、20%、30%、40%、50%浓度的单宁酸反应。检测方法同2.4。
1.2.6.2 干燥方式对酶活的影响
为考察不同干燥方式对酶活力的影响,本实验选用喷雾干燥及冷冻干燥两种方式进行试验。酶的喷雾干燥方法为,使用3 L陶瓷膜截留液,按固形物含量配比20%添加558 g麦芽糊精。使用高压均质机15~20 kPa均质后进行喷雾干燥。喷雾干燥条件为进风温度98 ℃,出风温度 50 ℃,雾化器 40 Hz,恒流泵50 r/min。酶的冷冻干燥则使用冻干机-40 ℃冷冻干燥,直至酶液完全冻干。将酶粉分别复溶至与粗酶液相同蛋白浓度,按方法2.4检测酶活
1.2.6.3 酶的固定化
将冻干酶粉复溶成0.1 g/mL,取10 mL加入10 g树脂,搅拌均匀放入 40 ℃鼓风干燥机,后每小时搅拌一次,确保树脂与酶液混合均匀。测定酶活时取0.5 g固定化酶加入500 μL 10%的单宁酸;另为了测试固定化的稳定性及重复利用率,在反应后过滤出树脂,重复使用1周测定其活力。
1.2.7 酶活力定义
单位体积粗酶液每分钟水解底物单宁酸产生 1 μmol没食子酸所需的酶量定义为一个酶活力单位(U/mL)。
1.2.8 数据处理
各试验均进行3次平行测定,结果用“均值±标准偏差”表示。用SPSS(IBM SPSS,Armonk,NY)软件进行数据拟合以及回归分析。
2 结果与讨论
2.1 单宁酶的纯化
2.1.1 酶液理化性质的检测
对纯化前后酶液进行研究,为了对其进行定量,测定固形物含量及蛋白质含量,结果如表1。陶瓷膜截留液固形物含量为 49.34 mg/mL、蛋白含量 1.35 mg/mL,与粗酶液相比两项指标皆增长;而陶瓷膜滤液两项指标较粗酶液均有下降,初步推测所需单宁酶大多于截留液中(表1)。后续实验均根据蛋白含量进行统一定量后,对比酶活。
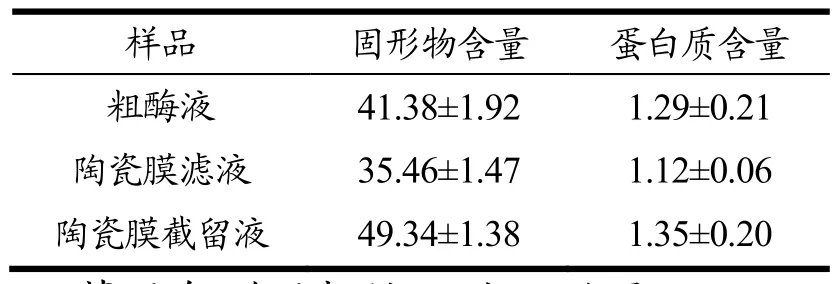
表1 纯化前后酶液固形物及蛋白质含量对比(mg/mL)Table 1 Comparison of solid content and protein content of enzyme solution before and after purification
2.1.2 薄层色谱层析检测纯化效果
为了测定单宁酶活力及纯化效果,将单宁酶粗酶液、单宁酶滤液、单宁酶截留液统一配制成蛋白浓度为0.7 mg/mL的酶液,分别与单宁酸反应12 h后,薄层层析检测结果图1。样品从左至右分别为:10%的单宁酸标品,1 mg/mL的没食子酸标品;灭活粗酶液反应体系(空白);陶瓷膜滤液反应体系;陶瓷膜截留液反应体系;粗酶液反应体系。由图1可看出,在相同反应条件下,过滤液与截留液都能分解单宁酸生成没食子酸,但截留液比过滤液没食子酸特征点颜色更深,酶活更高。另外截留液酶解效果比粗酶液更佳,说明用陶瓷膜对粗酶液进行纯化达到一定的效果。陶瓷膜截留液的没食子酸特征点颜色最深,也说明转化生成没食子酸最多,即单宁酶主要在 60 ku陶瓷膜截留液组分中。这与前期实验结果中,黑曲霉N5-5所产单宁酶为分子质量64.2 ku的单肽链蛋白相符合[16]。
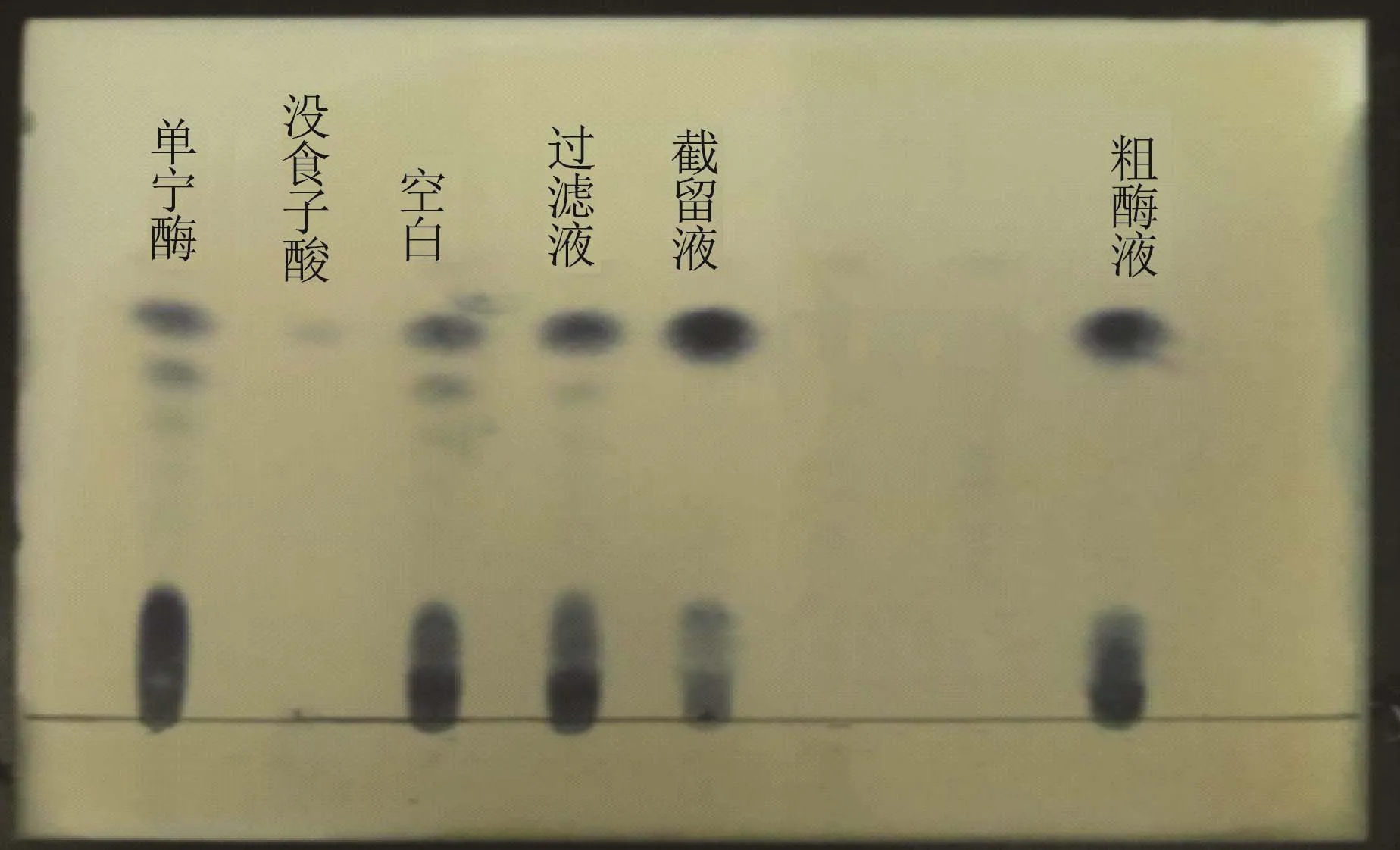
图1 单宁酶酶活初步检测薄层层析图Fig.1 TLC diagram of preliminary detection of tannase activity
单宁酶分子质量在 31~320 ku之间,由单个或多个亚基组成[17],不同来源的单宁酶分子质量差异较大。真菌单宁酶均为糖蛋白,存在同源或异源低聚体,有两个以上亚基[18],故真菌单宁酶分子质量较细菌单宁酶偏大,在45~320 ku之间[19]。实验所得结果与这些结论一致,故后续实验均选择含有大量单宁酶的陶瓷膜截留液,即纯化的酶液,作为研究对象。
2.1.3 HPLC测定纯化后酶液活性
金属浴45 ℃反应24 h后,通过HPLC准确测定酶活。
图2可看出,陶瓷膜截留液的组分没食子酸特征峰响应值高,通过计算峰面积发现,纯化后蛋白含量为0.7 mg/mL的酶液与10%的单宁酸反应24 h,单宁酸分解率可达到95%以上。
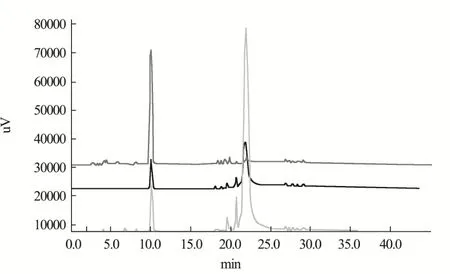
图2 纯化后酶液活性检测Fig.2 Activity detection of purified enzyme solution
2.2 单宁酶活力的探索
2.2.1 不同干燥方式对单宁酶活性的影响
酶作为生物催化剂,优点是具有针对性,效率高等。但缺点是处于游离状态的酶对环境很敏感,如在强酸、强碱、高温等情况中不稳定,酶蛋白变性导致活性降低甚至失活[7]。本研究分别用两种不同干燥方式干燥单宁酶截留液,使其易于保存。将干燥样品统一复溶成与粗酶截留液相同的蛋白浓度 1.35 mg/mL后分别与10%单宁酸反应,对其进行酶活检测,具体结果如图3。

图3 不同干燥方式的单宁酶活力对比图Fig.3 Comparison of tanninase activity of different drying methods
由图3可知,两种干燥方式干燥后的酶与单宁酸反应后,没食子酸生成量均较高,单宁酸含量变低,说明不同干燥方式的样品都具有较好的酶活。通过对比单宁酸减少量发现,冻干酶比喷干酶反应体系的单宁酸特征峰小;另外,冻干酶与未经干燥处理的纯化酶液都可将10%单宁酸基本反应完全,说明冻干对酶液活力影响较小。通过计算酶活,得喷干酶液酶活为174.02 U,而冻干酶液酶活为266.07 U,与纯化酶液的酶活相近。对每一处理步骤进行固形物、蛋白含量、酶活力等指标的测定,总结如表2。
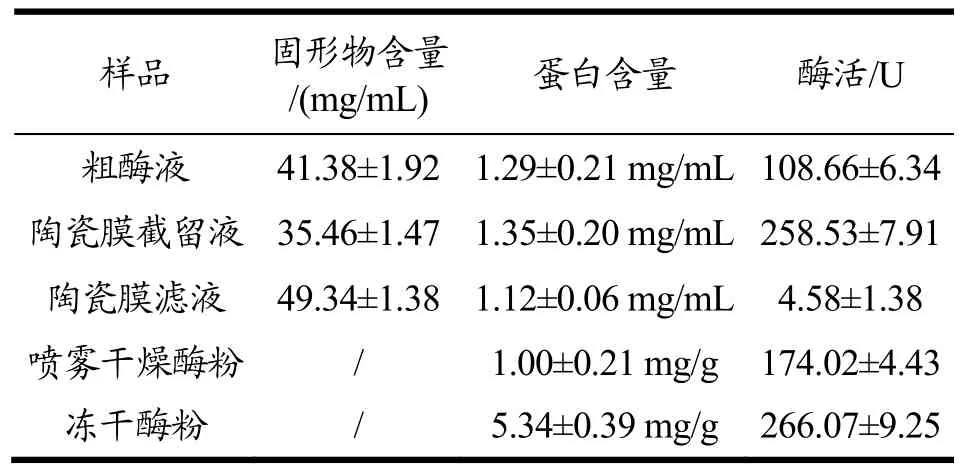
表2 各步骤蛋白含量及酶活总结Table 2 Summary of protein content and enzyme activity in each step
此次大批量发酵所测酶活与实验室前期小批量发酵所测酶活471.35 U/mL[13]有差距,分析原因主要有两个。一是前期使用没食子酸丙酯作为酶解底物标定酶活,而本次为了解决生产实际问题,使用构成更为复杂的单宁酸作为底物,故酶活力定义的标准不同,前期酶活只作为参考值;二是由于发酵量大,实际发酵过程中培养基有部分结团,故对浸提酶液这一步产生影响,酶未能提取完全,后期可采用先机械打散再浸提,或二次浸提的方式改善。
2.2.2 酶活与底物浓度
由上述结果可知,冻干对酶活影响小,故使用冻干酶探究单宁酸浓度对酶活的影响。将冻干后的纯化酶液配置成1.35 mg/mL蛋白浓度分别与10%、20%至50%的单宁酸反应(图4)。根据单宁酸的减少量可以看出,酶与底物1:1的条件下反应24 h,可催化10%、20%的单宁酸完全转化成没食子酸;对30%浓度的单宁酸,单宁酸几乎被完全酶解解,但中间产物并未完全转化成没食子酸;而对于40%、50%的单宁酸,单宁酶酶解大部分单宁酸,但依旧剩下少量单宁酸未被酶解。有研究表明,单宁酶的反应速度与底物呈线性关系,低浓度时表现为一级反应;当到达一定浓度时,速度增加缓慢并趋于最大值,呈零级反应[20]。结论与本次实验结果相似,从30%底物浓度开始,没食子酸生成量变化不明显,酶解过程的零级反应拐点应处于30%附近,即30%单宁酸为合适的底物浓度。
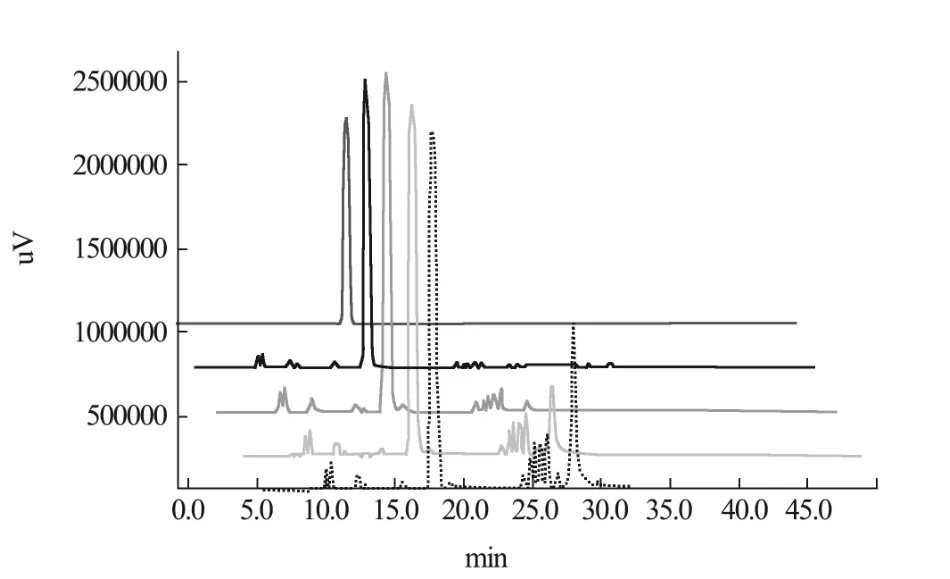
图4 酶与不同浓度单宁酸反应HPLC对比图Fig.4 HPLC comparison chart of the reaction between enzyme and different concentrations of tannic acid
2.3 固定化酶的循环使用
为了对固定化酶的效果进行更准确的定性,对其使用时间及重复使用次数进行探究。每次0.5 g固定化酶与10%单宁酸反应24 h,重复使用6次,使用时长7 d,酶活检测结果如图5。
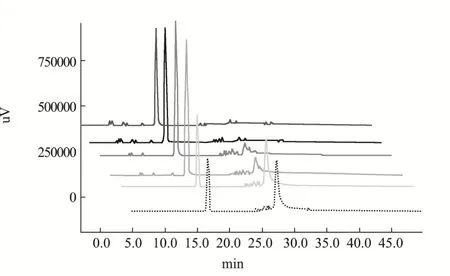
图5 固定化酶使用次数活性检测图Fig.5 Activity detection diagram of the number of times the immobilized enzyme is used
由图5可知,经过固定化后的酶,随时间延长,未被酶解的底物单宁酸含量逐渐增多。循环使用的前四次单宁酸基本反应完全,第5次检测结果中单宁酸剩余量明显增多,酶活降低70%左右。具体酶活变化总结见表3。固定化酶循环使用次数与底物浓度、作用时间和其他反应条件有很大关系,在实际应用过程中,根据生产情况减少底物浓度及作用时间,可增加固定化酶的循环使用次数。

表3 固定化酶活力循环使用次数与酶活Table 3 Number of cycles of immobilized enzyme activity and enzyme activity
3 结论
本研究对黑曲霉 N5-5固态发酵产单宁酶的条件进行优化,提酶后利用膜过滤技术纯化粗酶液,纯化后49.34 mg酶液干基含有1.35 mg单宁酶,酶活为258.53 U/mL,比活力为191.57 U/mg,所得单宁酶在1.35 mg/mL蛋白浓度下具有酶解10%至50%浓度单宁酸的能力;对比不同干燥方式对单宁酶活力的影响发现,冷冻干燥比喷雾干燥酶活损失少,从保证酶活的角度,可选择冻干的方式对单宁酶进行干燥保存;固定化后的单宁酶在实验条件下,可重复使用至少 4次,第5次酶活损失达70%。本文所提供的单宁酶提取等工艺,为单宁的绿色分解及没食子酸的绿色生产奠定基础,同时固体发酵所使用的材料利用了人类生产生活中的农林业废弃物,有利于环境和能源的可持续发展。为了更好地进行商业化应用,今后的研究可继续从发酵后酶的提取及固定化两方面入手,使单宁酶更高效更充分地发挥作用。
