电针心包经穴对急性脑缺血大鼠脑组织神经生长抑制信号通路关键分子基因表达的影响
2021-09-02肖豆谢峥嵘唐雅妮潘江曹越娄必丹章薇陈成
肖豆,谢峥嵘,唐雅妮,潘江,曹越,娄必丹,章薇,陈成
(1.湖南中医药大学,长沙 410208;2.湖南中医药大学第一附属医院,长沙 410007)
脑缺血后中枢神经系统(central nervous system,CNS)功能的修复是医学界的重大难题[1]。临床研究表明针灸在脑缺血及相关疾病的临床治疗中不仅能改善患者神经功能[2-3],还能调节疾病相关的神经细胞因子[4-5]。前期研究[6-8]表明电针心包经穴能有效抑制脑缺血损伤后心脑组织细胞凋亡、促进脑血管新生、增加大脑中动脉缺血模型大鼠血清、脑组织中神经生长因子(nerve growth factor, NGF)的表达、降低血清中神经生长抑制因子(nogo protein-A, Nogo-A)含量,但对缺血模型大鼠脑组织中 Nogo-A的表达研究尚不深入。现选取天泉、曲泽、内关、大陵4个不同神经节段分布的腧穴代表手厥阴心包经整条经络,基于Nogo-A抑制信号通路观察电针对局灶性脑缺血模型大鼠血清 Nogo-A、Ras同源基因家族成员 A(ras homolog gene family member A, RhoA)、Rho 激酶Ⅱ(rho-associated kinase Ⅱ, ROCKⅡ)及缺血侧脑组织中Nogo-A、NgR1、RhoA及ROCKⅡ mRNA表达的影响,探究心包经穴改善脑缺血后神经功能的作用机制。
1 材料与方法
1.1 实验动物与分组
由湖南斯莱克景达实验动物有限公司统一提供3~4月龄的无特定病原体(specific pathogen free,SPF)级健康成年雄性Sprague Dawley (SD)大鼠30只,体质量(220±30) g,动物合格证号为 SCXK(湘)2016-0002。大鼠饲养于室温 22 ℃,相对湿度为 55%~70%的安静环境下,其饲养笼具、垫料、饲料、饮水均按照SPF级实验动物的要求进行制备和消毒,造模前先禁食1 d。将大鼠编号后,采用随机数字表法分组,将30只SD大鼠随机分成正常组(6只)、假手术组(6只)、造模组(18只);造模成功后,二次随机将 18只造模组大鼠分为模型组、心包经组和肺经组,每组6只。每组大鼠除正常喂养及相同时间捆绑处理外,正常组不做任何处理,假手术组曝露并剥离出血管但不插线,模型组采用大脑中动脉缺血模型造模,心包经组造模后电针心包经穴,肺经组造模后电针肺经穴。
1.2 主要试剂与仪器
Nogo-A ELISA试剂盒(北京安迪华泰科技有限公司,AD1514Ra),RhoA ELISA试剂盒(上海酶联生物科技有限公司,ml038156),ROCKⅡELISA试剂盒(武汉华美生物工程有限公司),mRNA逆转录试剂盒(中国北京康为世纪生物科技有限公司,CW2569)。华佗牌毫针0.30 mm×15 mm(苏州医药用品厂有限公司),华佗电针治疗仪(苏州医疗用品厂有限公司,SDZ-Ⅱ),全自动酶标洗板机(深圳市汇松科技发展有限公司,PW-812),多功能酶标分析仪(深圳市汇松科技发展有限公司,MB-530),荧光定量 RCP仪(美国 Thermo,PIKOREAL96),电泳仪(中国北京六一公司,DYY-6C),切片机(浙江金华益迪实验器材,YD-315)。
1.3 模型制备
采用大鼠大脑中动脉持久性局灶性缺血模型,造模方法参照文献[9-10]报道的造模方式,即颈外动脉插入线栓法建立脑缺血模型。采用Zea Longa 5级4分制评分法评分[9],无神经功能缺损计 0分;缺血对侧伸直障碍、前爪内收计1分;行走往偏瘫侧转圈计2分;行走向偏瘫侧倾倒计3分;完全丧失意识、不能行走计4分。选取评分1~3分的大鼠纳入实验观察。假手术组曝露剥离出血管后,不做其他处理。实验过程尽量遵循无菌操作的原则,术后未予以抗感染及营养护理。所有操作均遵循中华人民共和国科学技术部 2006年颁布的《关于善待实验动物的指导性意见》[11]。
1.4 干预方法
参照拟人比照法及《实验针灸学》[12]动物穴位图谱定位取穴,并按照手三阴经脉“从胸走手”的循行方向,选取缺血对侧肢体不同神经节段的穴位代表心包经及肺经。即选取天泉、曲泽、大陵和内关四穴代表心包经;选取天府、尺泽、列缺和太渊四穴代表肺经。
造模后第 2天进行针刺干预,用自制固定器固定大鼠四肢及头部并使其面部朝上,用 0.30 mm×15 mm毫针刺入大鼠脑缺血对侧上肢穴位,深度 3~4 mm,接SDZ-Ⅱ型电针治疗仪,心包经组大陵与内关相接,曲泽与天泉相接,肺经组太渊与列缺相接,尺泽与天府相接,电针正极接近心端穴位,负极接远心端穴位,采用连续波、输出电压2~4 V,频率20 HZ,强度以大鼠局部肢体轻颤为度,干预时间持续30 min。每日1次,连续电针3 d,第4天进行取材。
1.5 观察指标及检测方法
1.5.1 组织形态学观察
大鼠断头后取脑组织,对脑梗死区进行取材,所取组织脱水、包埋、切片后,60 ℃烤片 1~2 h,后将切片置于二甲苯中10 min,2次。然后依次在100%,100%,95%,85%和 75%乙醇中每级放置 5 min,再用蒸馏水浸洗5 min;后苏木素染5~10 min,蒸馏水冲洗,PBS返蓝;伊红染 3~5 min,蒸馏水冲洗;梯度乙醇(95%~100%)脱水,每级 5 min(或者直接把片子烤干)。取出后置于二甲苯10 min,2次,中性树胶封片、显微镜观察。
1.5.2 血清Nogo-A、RhoA及ROCKⅡ蛋白含量检测
治疗结束后,大鼠腹腔注射10%水合氯醛(每100 g体质量注射 0.3 mL)麻醉,取4~5 mL腹主动脉血,常温下静置2 h然后离心(3000 r/min, 15 min),移液枪取上清液,遵照相关试剂盒的操作说明,应用ELISA法分别检测血清Nogo-A、RhoA及ROCKⅡ的浓度。横坐标为标准物的浓度,纵坐标为吸光度(OD)值,并采用“Curve Expert”曲线制作软件进行分析,并制作标准曲线。根据标准品的OD值与浓度计算出回归方程式,将样本的OD值代入方程式,计算出样本浓度[13]。(稀释样本需乘上稀释倍数,即得样本的实际浓度。)
1.5.3 脑梗死区Nogo-A、NgR1、RhoA及ROCKⅡ mRNA表达检测
取约0.02 g大鼠缺血侧脑组织,加入Trizol溶液,研磨匀浆后提取总RNA,并以组织总mRNA为模板,逆转录 cDNA(具体按逆转录试剂盒操作步骤进行),取部分cDNA,等比例混匀,稀释,作为实时荧光定量 PCR(RT-qPCR)的模板。参照目的基因的序列,运用primer5软件设计引物(具体见表1),按SYBR法完成实验操作(反应条件为 95 ℃,10 min;95 ℃,15 s;60 ℃,30 s;共40个循环)。计算方法为△Ct=目的基因 Ct-内参基因 Ct,-ΔΔCt=(对照组)ΔCt-各样品 ΔCt,2-ΔΔCt反映其他各组样品相对于对照组样品目的基因表达水平的比值。正常组、假手术组参考《大鼠脑立体定位图谱》[14],选取视交叉至脑桥属大脑中动脉供血区域取材。检测方法同上。

表1 各检测指标引物序列
1.6 统计学方法
采用SPSS22.0软件对数据进行数据分析。计量资料采用均数±标准差表示。符合正态分布者,组间比较采用单因素方差分析,方差齐者用LSD法,方差不齐者用Tambane’sT2或Games-Howell法。不符合正态分布者,采用多个独立样本的秩和检验。以P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠梗死区脑组织病理学观察
正常组、假手术组大鼠脑组织结构完整且致密,神经元细胞胞浆丰富,淡染,清晰可见较大核仁;模型组可见大片梗死灶,神经细胞大片消失或细胞皱缩,出现细胞核固缩,核边集严重,细胞间间距增大,间质染色稀疏;心包经组和肺经组脑梗死区结构较正常组和假手术组疏松,细胞排列更紊乱,但较模型组组织结构紧密,细胞排列更规则;而心包经组缺血坏死区结构较肺经组稍紧密、细胞排列稍规则。详见图1。
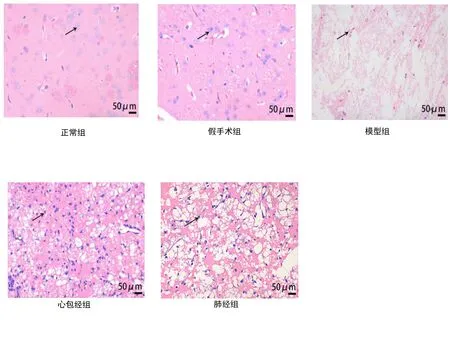
图1 各组大鼠脑组织病理学比较(×400)
2.2 各组大鼠血清中Nogo-A、RhoA和ROCKⅡ含量比较
与正常组和假手术组比较,模型组、心包经组、肺经组血清中 Nogo-A含量均增加(P<0.01,P<0.05);与模型组比较,心包经组血清中Nogo-A含量下降(P<0.01),而肺经组 Nogo-A含量差异无统计学意义(P>0.05);与肺经组比较,心包经组血清中Nogo-A含量显著降低(P<0.01)。与正常组和假手术组比较,模型组、肺经组血清中 RhoA含量增加(P<0.01,P<0.05),心包经组 RhoA含量差异无统计学意义(P>0.05);与模型组比较,心包经组血清中RhoA含量降低(P<0.05),肺经组 RhoA含量差异无统计学意义;与肺经组比较,心包经组血清中 RhoA含量差异无统计学意义(P>0.05)。与正常组和假手术组比较,模型组、心包经组、肺经组血清中 ROCKⅡ含量均增加(P>0.01),而模型组、心包经组、肺经组各组血清中ROCKⅡ含量无明显差异(P>0.05)。说明电针心包经穴能明显下调血清中Nogo-A和RhoA含量,但对血清中ROCKⅡ含量无明显调节作用,这可能与实验样本过小或(和)电针干预时间短刺激强度不够有关。详见表2。
表2 各组大鼠血清中Nogo-A、RhoA及ROCKⅡ含量的比较 (±s, pg/mL)
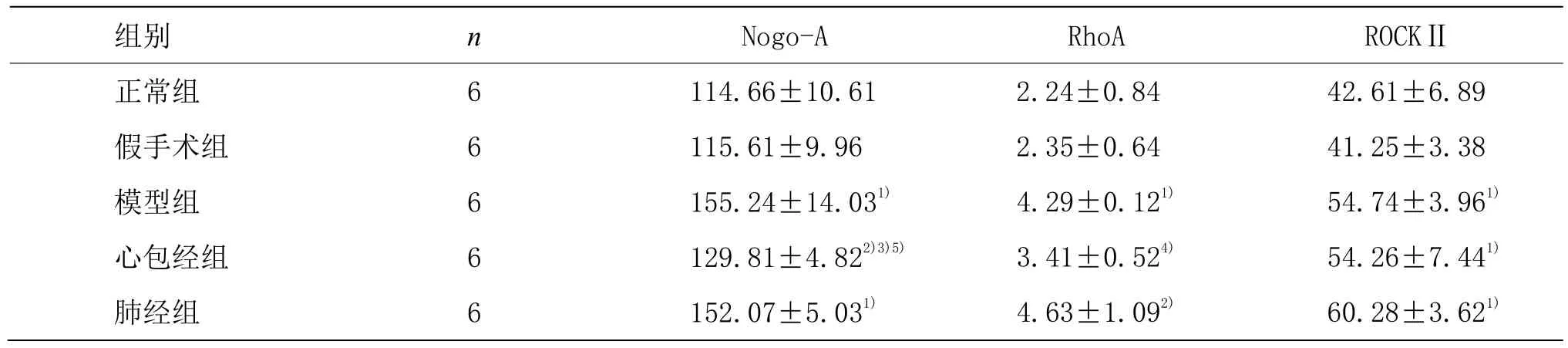
表2 各组大鼠血清中Nogo-A、RhoA及ROCKⅡ含量的比较 (±s, pg/mL)
注:与正常组、假手术组比较 1)P<0.01,2)P<0.05;与模型组比较 3)P<0.01,4)P<0.05;与肺经组比较 5)P<0.01
组别 n Nogo-A RhoA ROCKⅡ正常组 6 114.66±10.61 2.24±0.84 42.61±6.89假手术组 6 115.61±9.96 2.35±0.64 41.25±3.38模型组 6 155.24±14.031) 4.29±0.121) 54.74±3.961)心包经组 6 129.81±4.822)3)5) 3.41±0.524) 54.26±7.441)肺经组 6 152.07±5.031) 4.63±1.092) 60.28±3.621)
2.3 各组大鼠脑梗死区中 Nogo-A、NgR1、RhoA及ROCKⅡ mRNA表达的比较
与正常组和假手术组比较,模型组、心包经组和肺经组脑梗死区Nogo-A mRNA表达均显著增加(P<0.01,P<0.05);与模型组比较,心包经组脑梗死区 Nogo-A mRNA表达显著下降(P<0.05),而肺经组Nogo-A mRNA表达无统计学意义(P>0.05);与肺经组比较,心包经组脑梗死区Nogo-A mRNA表达变化无统计学意义(P>0.05)。与正常组和假手术组比较,模型组和肺经组脑梗死区 NgR1 mRNA表达均增加(P<0.01),心包经组NgR1 mRNA的表达差异无统计学意义;与模型组比较,心包经组和肺经组脑梗死区 NgR1 mRNA表达均下降(P<0.01);与肺经组比较,心包经组脑梗死区 NgR1 mRNA表达下降(P<0.01)。与正常组和假手术组比较,模型组、心包经组和肺经组脑梗死区RhoA mRNA表达均增加(P<0.01);与模型组比较,心包经组和肺经组脑梗死区RhoA mRNA表达均下降(P<0.01);与肺经组比较,心包经组脑梗死区 RhoA mRNA表达下降(P<0.01)。与正常组和假手术组比较,模型组、肺经组脑梗死区ROCKⅡ mRNA增加(P<0.05),心包经组ROCKⅡmRNA表达差异无统计学意义(P>0.05);模型组、心包经组和肺经组各组脑梗死区ROCKⅡ mRNA表达差异无统计学意义(P>0.05)。说明电针肺经穴能有效下调脑梗死区NgR1、RhoA mRNA表达,而电针心包经穴对脑梗死区 Nogo-A、NgR1、RhoA mRNA表达均能有效下调,但对脑梗死区ROCKⅡ mRNA表达无明显调节作用。详见表3。
表3 各组大鼠脑梗死区中Nogo-A、NgR1、RhoA及ROCKⅡ mRNA表达的比较 (±s)
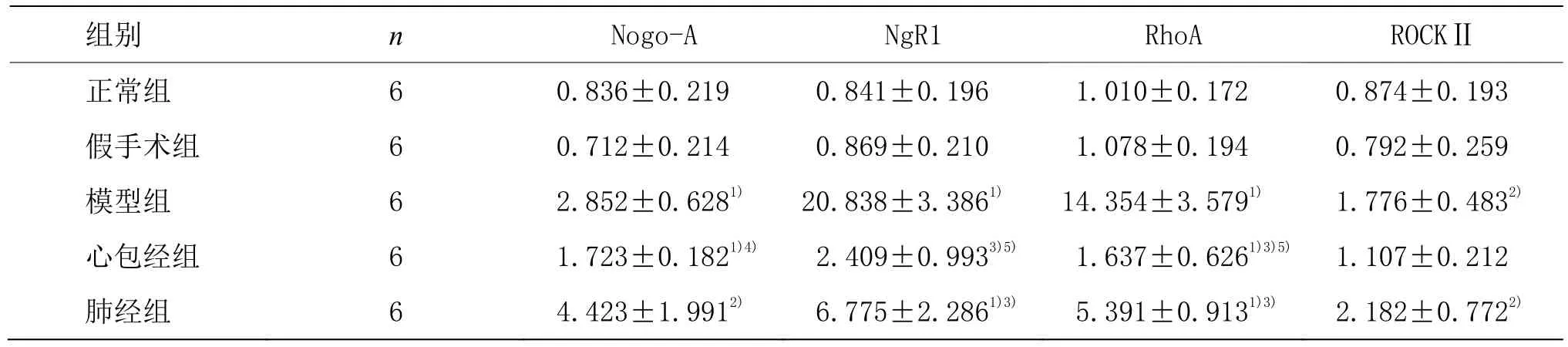
表3 各组大鼠脑梗死区中Nogo-A、NgR1、RhoA及ROCKⅡ mRNA表达的比较 (±s)
注:与正常组、假手术组比较 1)P<0.01,2)P<0.05;与模型组比较 3)P<0.01,4)P<0.05;与肺经组比较 5)P<0.01
组别 n Nogo-A NgR1 RhoA ROCKⅡ正常组 6 0.836±0.219 0.841±0.196 1.010±0.172 0.874±0.193假手术组 6 0.712±0.214 0.869±0.210 1.078±0.194 0.792±0.259模型组 6 2.852±0.6281) 20.838±3.3861) 14.354±3.5791) 1.776±0.4832)心包经组 6 1.723±0.1821)4) 2.409±0.9933)5) 1.637±0.6261)3)5) 1.107±0.212肺经组 6 4.423±1.9912) 6.775±2.2861)3) 5.391±0.9131)3) 2.182±0.7722)
3 讨论
目前不少研究认为CNS损伤后神经细胞轴突大多可以再生和修复,但其修复好坏的关键可能涉及多种炎性介质及神经功能因子[15-16]。Nogo-A是一种较早报导且被证实参与抑制神经细胞迁移和扩散并阻碍轴突再生的重要因子[17-18],其介导的抑制信号通路Nogo-A/NgR1/-RhoA/RockⅡ在CNS损伤后抑制轴突出芽和生长的过程中扮演着重要的角色。除 Nogo-A因子外,NgR1、RhoA、RockⅡ因子同样可以限制轴突生长和修复[19-20]。NgR1作为Nogo-A最亲密的受体,通常与其一起发挥抑制神经生长的作用[21]。研究证实运用 NgR1拮抗剂在抑制NgR1表达的同时,可保护缺血后大脑并促进神经修复及轴突再生[22],而抑制RhoA能促进小鼠神经细胞生长与分化[23],抑制 ROCKⅡ具有神经保护方面的作用[24]。同时研究发现[25]通过负反馈调节 RhoA/RockⅡ信号通路抑制RhoA及RockⅡ因子的表达,能促进神经轴突生长及脑缺血后神经功能恢复。
缺血性中风发生后,Nogo-A、NgR1、RhoA、RockⅡ因子活动往往增加,研究表明[26-27]Nogo-A通过与NgR1特异性结合形成相应复合体激活RhoA及Rho相关激酶(ROCKⅡ),ROCKⅡ能磷酸化下游的效应分子导致神经突起回缩及生长锥塌陷,产生抑制轴突再生的作用。陆跃等[28]提出候氏黑散中风药、补虚药促进脑缺血后CNS功能恢复可能是通过抑制 Nogo-A/NgR 1-RhoA/RockⅡ信号通路实现的。以上研究结果表明Nogo-A、NgR1、RhoA、RockⅡ因子无论是单独还是联合作用均有抑制轴突生长及阻碍CNS功能恢复的作用。
针灸疗法作为中医学重要的治疗手段,能有效促进脑梗死偏瘫患者的神经功能恢复,并提高其生活质量[29]。实验研究证明[30-31]针灸可通过调节神经生长因子、神经抑制因子及多种凋亡相关蛋白抑制缺血半暗带神经细胞的凋亡,达到保护缺血灶周围的神经组织,促进CNS修复与重塑的作用。同时这也是针灸治疗缺血性中风的重要机制。吴锋等[32]发现电针曲池和合谷穴能下调脑梗死区Nogo-A和NgR的表达并促进脑缺血后大鼠神经功能的恢复。谭峰等[33]也发现通过电针百会和大椎穴可下调Nogo-A及RhoA的蛋白表达并降低缺血再灌注大鼠神经功能缺损评分。Huang S等[34]还提出电针足三里和曲池穴促进神经轴突再生正是通过抑制Nogo-A/NgR1-RhoA/RockⅡ信号通路实现的。
手厥阴心包经络与心、脑密切相关,既可通过相表里的阳经和自身经别间接入脑,同时也可借助任督二脉与脑相关[35]。临床研究[36-37]也证明电针手厥阴心包经能有效改善缺血中风患者脑梗死区血流量,促进患者神经功能恢复,对中风后的情感障碍也有着独特的疗效[38]。而手太阴肺经与手厥阴心包经属上肢同神经节段阴经,其经脉循行与脑无直接联系。故本研究将电针心包经穴作为一种外源性干预手段,以上肢同节段阴经的手太阴肺经作为对照,观察大鼠梗死区脑组织HE染色后组织结构和细胞形态以及大鼠脑缺血后血清中 Nogo-A、RhoA、RockⅡ含量和缺血侧脑组织中Nogo-A、NgR1、RhoA及RockⅡ mRNA表达的变化。实验结果表明,造模后,模型组大鼠脑组织中出现大片梗死灶,神经细胞大片消失或细胞皱缩,电针心包经和肺经能有效改善脑组织结构和细胞形态,且心包经组略优于肺经组。模型组大鼠血清中Nogo-A、RhoA、RockⅡ含量及缺血侧脑组织中Nogo-A、NgR1、RhoA及RockⅡmRNA相对表达均明显上升,提示脑缺血后激活了相关因子的表达,而相比于模型组,心包经组血清中Nogo-A及RhoA含量明显下降,而血清中RockⅡ含量无明显变化。相比于模型组,电针心包经穴能明显下调缺血侧脑组织中 Nogo-A、NgR1、RhoA mRNA的表达,对RockⅡ mRNA的表达则无明显调节作用,电针肺经穴同样能下调缺血侧脑组织中 NgR1、RhoA mRNA的表达,但心包经组优于肺经组。说明电针能有效调节缺血侧脑组织中NgR1、RhoA mRNA的表达,且具有经脉特异性,即心包经组优于肺经组。同时实验组同期发现电针心包经能下调模型大鼠缺血侧脑组织中第7日和21日Nogo-A、NgR1 mRNA 的表达[39]。
从中医学基础理论分析,手太阴肺经与脑的联系虽不如心包经紧密,但《素问》中提到“肺”具有“朝百脉,主治节”的生理功能,同时“主气、司呼吸”,能将流经肺脏的全身血液进行浊气与清气交换,再通过宣发肃降作用将富含清气的血液输布全身各处[40],而大脑自然也需要富含清气的血液来濡养。同时也有研究证实[41]针刺肺经穴腧穴可改变大脑皮层的固有活动,并对其治疗心神疾病提供了客观依据。以上综合考虑,针刺心包经、肺经穴应都有利于促进脑缺血后的神经功能恢复,对 Nogo-A/NgR1-RhoA/RockⅡ信号通路或其关键分子的表达应有一定的抑制作用。而电针肺经穴对血清中Nogo-A、RhoA、RockⅡ含量及脑组织中RhoA、RockⅡ mRNA的表达均无明显调节作用,目前暂无其他相关实验结果可以参照,暂考虑电针干预时间短刺激强度不够和(或)实验样本量小相关,具体原因需进一步扩大样本量、增加干预时间继续观察研究。
本次实验中观察到电针心包经穴能明显下调脑缺血模型大鼠血清中Nogo-A及RhoA含量及缺血侧脑组织中 Nogo-A、NgR1、RhoA mRNA的表达,但对血清中RockⅡ含量及脑组织中RockⅡ mRNA的表达无明显作用。这可能与RockⅡ因子能通过多种渠道影响细胞信号转导系统相关[42],其在参与抑制脑缺血后神经修复与再生的同时,也参与了急性脑缺血后细胞凋亡、氧自由基生成、激活炎症等多种生物反应,将造成Rock Ⅱ因子在脑缺血急性期不能稳定表达[43],对实验结果造成影响,但具体是否相关,还有待进一步研究证实。
本实验结果显示电针心包经穴能改善缺血侧脑组织结构和神经细胞形态,并通过调节神经生长抑制信号通路 Nogo-A/NgR1-RhoA/RockⅡ中关键分子基因的表达促进脑缺血后神经功能修复,为心包经在脑缺血后的神功修复的治疗中提供实验支持。但电针心包经穴是否能通过该通路对脑缺血后神经修复造成影响还有待添加阻滞剂或(和)激动剂进一步研究。
