原发性肝癌超声造影血流灌注参数与肿瘤分化程度及微血管生成的关系
2021-09-01袁建军朱好辉邵黎阳
何 垚,杨 龙,袁建军,朱好辉,邵黎阳
(河南省人民医院 郑州大学人民医院超声科,河南 郑州 450003)
原发性肝癌(primary hepatic carcinoma, PHC)是我国常见恶性肿瘤之一,具有高患病率及病死率,且预后差[1]。既往研究证实其生长、转移与瘤体内新生血管有一定相关性[2-3],肿瘤微血管密度(microvessel density, MVD)作为独立指标可有效评价血管生成和癌细胞转移、复发[4]。既往研究多利用对手术标本进行免疫组织化学染色获取MVD定量信息,操作复杂且存在滞后性,且仅约20%确诊PHC患者可接受手术[5]。超声造影(contrast-enhanced ultrasonography, CEUS)可观察肝内病灶灌注情况,利用时间-强度曲线(time-intensity curve, TIC)定量评估肝脏血流灌注。本研究旨在探讨CEUS血流灌注参数与PHC分化程度及微血管生成的关系,为临床诊疗PHC提供依据。
1 资料与方法
1.1 一般资料 选取2016年1月—2018年10月于河南省人民医院经手术病理确诊的120例PHC患者,男78例,女42例,年龄35~78岁,平均(58.7±10.2)岁;共149个病灶,单发101例、多发19例;其中29个病灶因标本量较少、免疫组织化学染色效果差而予排除,最终纳入120个病灶(每例1个病灶),直径1.5~9.5 cm,平均(4.7±1.2)cm。纳入标准:临床、影像学及病理资料完整;PHC与腹前壁皮肤垂直距离<8.0 cm,远离心脏、膈肌或大血管;术前接受CEUS检查,此前未接受介入治疗或其他抗肿瘤治疗。排除标准:心、肺、肾器质性功能障碍及其他恶性肿瘤。
1.2 仪器与方法 采用GE Logic E9彩色多普勒超声诊断仪,C1-5造影探头,频率2.0~4.0 MHz,具备反向脉冲谐波显像(pulse inversion harmonic imaging, PIH)模式,以声诺维为造影剂。嘱患者仰卧,常规扫查肝脏,标记可疑病灶位置、内部回声及血流情况;切换至CEUS模式,经肘静脉团注造影剂2.4 ml,存储连续6 min实时动态图像。造影结束后,打开自动追踪增强定量分析软件,将取样框置于病灶中心或回声增强最显著区域获取TIC,于动脉相记录以下参数:始增时间(病灶内出现造影剂时间)、达峰时间(TIC顶峰对应时间)、始退时间(回声强度低于周围肝组织时间)、增强时间(达峰时间与始增时间的时间差)、廓清时间(始退时间与达峰时间的时间差)、始增强度(病灶内开始出现造影剂时增强强度)及峰值强度(TIC峰值对应增强强度)[6],根据以往文献[7]计算方法得到平均血流密度(mean flow density, MFD):MFD=增强面积/肿瘤有效面积;并按照动脉相早期PHC肿瘤血管形态、分布及强化情况等特点将灌注显像模式进行分型[8]:蛛网样,多个分支自中央或周边侵入病灶内,大部分血管扭曲变形、呈网状快速弥散;放射样,造影剂自病灶中心呈环状迅速向周边填充,未见血管扭曲;混合样,二者同时存在。
1.3 病理检查 对手术切除PHC标本蜡块行免疫组织化学SP染色,采用鼠抗人CD34单克隆抗体标记血管。于光镜下观察染色情况,测定MVD:于40倍光镜下取3个血管浓聚区,于400倍光镜下计算染色阳性血管数,以3次测定均值为MVD。根据Edmondson-Steiner分级法[9]行病理分级。
1.4 统计学分析 采用SPSS 22.0统计分析软件。符合正态分布的计量资料用±s表示,多组间比较采用单因素方差分析,两两比较采用LSD-t检验;计数资料比较行χ2检验;PHC动脉相血流灌注参数与MVD的相关性采用Pearson相关分析。P<0.05为差异有统计学意义。
2 结果
病理检查结果显示,120个PHC 病灶中,高分化病灶39个,中分化44个,低分化37个(图1、2)。
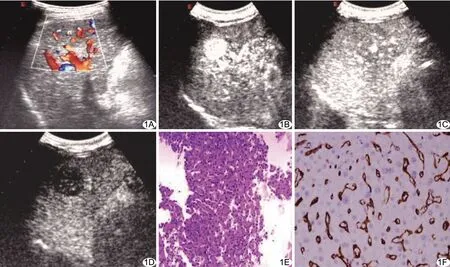
图1 患者男,58岁,高分化PHC A.肝右前叶低回声团,CDFI示周边、内部丰富血流信号;B.病灶CEUS动脉相呈整体快速增强;C.门静脉相呈等增强;D.延迟期低强化;E.病理图(HE,×200);F.免疫组织化学染色,微血管呈棕黄色染色(SP,×400)
2.1 CEUS灌注特点 120个病灶动脉相呈均匀或不均匀高强化,其中86个(86/120,71.67%)呈均匀高强化,7个(7/120,5.83%)周围高强化,27个(27/120,22.50%)不均匀高强化;门静脉相111个病灶(111/120,92.50%)呈低强化,9个病灶(9/120,7.50%)等增强;延迟相120个病灶均呈低增强。
2.2 动脉相CEUS血流灌注参数 不同分化程度PHC动脉相达峰时间、增强时间、始退时间、清除时间、MFD差异均有统计学意义(P均<0.01);依低、中、高分化顺序,达峰时间、增强时间、始退时间、清除时间逐渐增加(P均<0.05),MFD逐渐降低(P均<0.05)。见表1。
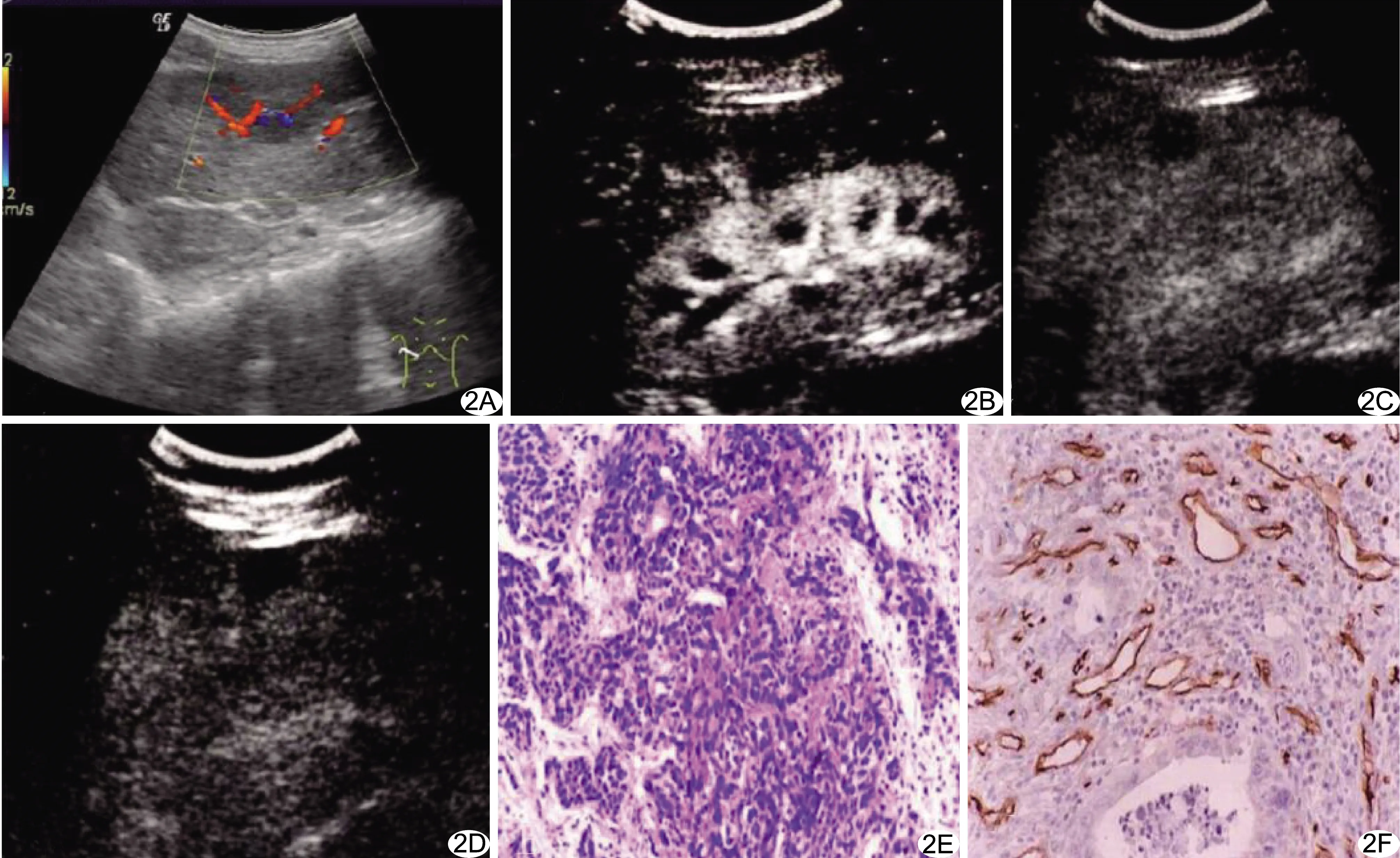
图2 患者男,65岁,低分化PHC A.肝右前叶低回声团,CDFI示其内血流信号丰富;B.病灶动脉相呈不均匀高增强;C.门静脉相呈低增强;D.延迟期低强化;E.病理图(HE,×100);F.免疫组织化学染色,微血管呈明显棕褐色染色(SP,×200)
表1 不同分化程度PHC动脉相CEUS定量血流灌注参数比较(±s)

表1 不同分化程度PHC动脉相CEUS定量血流灌注参数比较(±s)
PHC分化程度始增时间(s)达峰时间(s)增强时间(s)始退时间(s)清除时间(s)始增强度(dB)峰值强度(dB)MFD高分化(n=39)13.82±2.0542.79±7.52 31.16±7.26 125.86±29.52 83.07±2200 -65.42±1.78-40.97±3.430.36±0.08 中分化(n=44)14.46±3.1728.63±+5.21*17.35±2.76*81.71±14.23*53.08±9.02*-65.38±1.57-41.12±3.380.53±0.11*低分化(n=37)13.06±1.9823.86±2.77*#12.06±3.71*#53.24±10.17*#29.38±7.40*#-65.83±1.51-40.87±3.310.76±0.13*#F值3.14121.89155.13131.38135.190.910.06130.27P值0.05<0.01<0.01<0.01<0.010.410.95<0.01
注:*:与高分化比较,P<0.05;#:与中分化比较,P<0.05
2.3 动脉相造影剂灌注显像分型 高分化PHC血流灌注模式以放射样为主,占比高于中、低分化PHC(P均<0.05);中分化PHC以混合样为主,占比高于高、低分化PHC(P均<0.05);低分化PHC以蛛网样为主,占比高于高、中分化PHC(P均<0.05)。见表2。
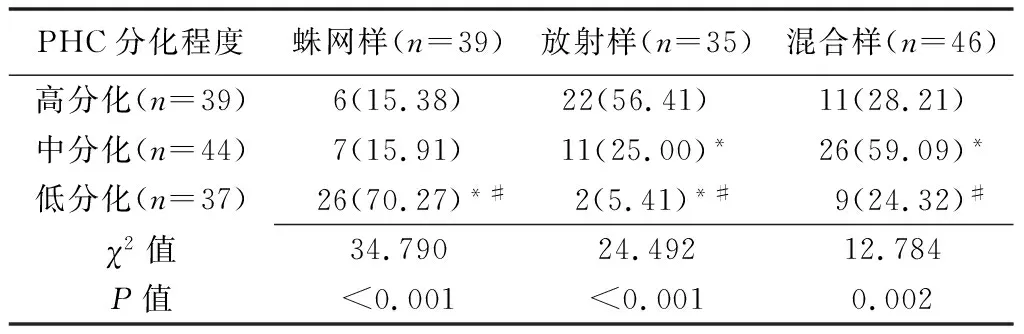
表2 不同分化程度PHC动脉相造影剂灌注显像分型比较[个(%)]
2.4 不同灌注模式PHC的MVD比较 蛛网样、混合样、放射样PHC的MVD分别为65.41±12.36、51.03±8.65、42.15±7.97,总体差异有统计学意义(F=53.19,P<0.001);蛛网样、混合样、放射样PHC的MVD逐渐降低(P均<0.05)。
2.5 PHC动脉相血流灌注参数与MVD的相关性 MVD与PHC动脉相MFD呈正相关(r=0.534,P<0.001),与增强时间(r=-0.320,P<0.001)、达峰时间(r=-0.308,P<0.001)及清除时间(r=-0.389,P<0.001)均呈负相关;与始退时间无明显相关(r=-0.045,P=0.622)。
3 讨论
PHC细胞增殖及转移有赖于肿瘤新生血管生成。肿瘤新生血管以血管基底膜不完整、血管通透性增加及外周间隙大为特点,伴血管分支紊乱、数量增多[3],均是肿瘤血流灌注增加的重要原因,也为CEUS检出病变的病理基础。
声诺维为血池示踪剂,微泡直径小,可进入各类血管,成像清晰且精度高[10]。肿瘤新生血管越多,CEUS显示血流信号越丰富[11]。目前CEUS对肝脏肿瘤的定性诊断已相对成熟[12],但关于PHC的CEUS血流灌注定量参数与病理特点关系的报道较少。本研究采用CEUS的PIH技术及TIC软件分析PHC血流灌注。TIC系示踪剂稀释后形成的造影剂浓度随时间变化的曲线,反映肿瘤血管中微泡流速及流量随时间变化的特征[13]。PHC血供主要源于肝动脉,门静脉较少参,其内非坏死性低密度区由膈下动脉和肠系膜上动脉侧支循环供血,由于该侧支血管稀疏且细小,示踪剂难以进入[14]。本研究中86个PHC病灶在动脉相呈均匀高强化,7个病灶呈周围高强化,而在门静脉相及延迟相,大部分病灶呈低强化。
本组不同分化程度PHC之间达峰时间、增强时间、始退时间及廓清时间均有明显差异,低、中分化PHC主要表现为“快进快出”特点,而高分化PHC则以“快进慢出”为特点,与尹珊珊等[15]研究结果相符。可能是因为分化程度差、增殖速度较快的PHC血供主要来源于肝动脉,肿瘤易侵犯血管壁形成动静脉瘘,导致血液流速增加、廓清速度加快,呈现“快进快出”特点;而高分化PHC多为肝动脉、门静脉双重供血,造影剂微泡自门静脉持续进入肿瘤,同时瘤内库普弗细胞可吞噬微泡,导致微泡在肿瘤内停留时间延长,两者均可造成示踪剂显影时间延长[16]。MFD作为CEUS监测微血管的指标,可反映癌灶对血供的需求,一般恶性程度越高,单位体积内血管数量即MFD越高,CEUS增强越明显。本研究发现低、中、高分化PHC的MFD依次降低,原因可能在于分化程度越低,癌细胞增殖越活跃、侵袭性越强,单位面积瘤体内微血管数量越多,MFD越高。
此外,本研究还发现不同分化程度PHC的CEUS血流灌注模式也各具特点,说明PHC血管构型与病理分化密切相关,随分化程度降低,肿瘤微血管构型改变、侵袭性增加,血管通透性提升,流速加快;蛛网样灌注模式PHC的MVD较高,其次为混合样及放射样。相关性分析结果显示,PHC的CEUS参数MFD与MVD呈正相关,增强时间、达峰时间、廓清时间均与MVD呈负相关,提示PHC血流灌注参数与肿瘤微血管生成具有高度相关性,有望为临床提供一种新的评估PHC血管生成的方法。
综上,CEUS血流灌注参数与PHC分化程度及微血管生成均密切相关。但本研究病例数相对较少,结果可能存在偏差,有待加大样本进一步观察。
