Logistic回归分析乳腺癌常规超声征象与腋窝淋巴结转移的关系
2021-09-01张海俊曹玉文康燕飞葛肖艳曹春莉
桑 田,张海俊,曹玉文,马 婷,李 军*,成 静,康燕飞,葛肖艳,吴 芳,陈 铭,曹春莉
(1.石河子大学医学院第一附属医院超声科,新疆 石河子 832008;2.石河子大学医学院病理学教研室,新疆 石河子 832008)
我国乳腺癌发病率位居女性恶性肿瘤第一位,并呈持续上升趋势[1];一旦发生腋窝淋巴结转移时,需行腋窝淋巴结清扫术,术后并发症影响患者生存质量[2]。超声已广泛用于检查乳腺癌,但对可否仅以超声判断腋窝淋巴结转移仍存在争议[3-6]。本研究以单因素及多因素二元Logistic回归分析建立预测模型,观察乳腺癌原发灶超声特征与腋窝淋巴结转移的关系,分析其预测乳腺癌腋窝淋巴结转移的价值。
1 资料与方法
1.1 研究对象 回顾性分析2014年1月—2020年5月于石河子大学医学院第一附属医院接受乳腺切除+腋窝淋巴结清扫术的820例女性乳腺癌患者共874个原发病灶;年龄26~73岁,平均(51.0±10.5)岁;病灶最大径0.40~13.50 cm,中位最大径1.90 cm。根据有无腋窝淋巴结转移分为转移组和未转移组。转移组307例共334个原发病灶,患者年龄26~73岁,平均(54.5±11.6)岁,病灶最大径0.61~13.50 cm,中位最大径1.95 cm;未转移组513例共540个原发病灶,年龄27~71岁,平均(52.9±9.8)岁,病灶最大径0.40~12.53 cm,中位最大径1.84 cm。
1.2 仪器与方法 采用Philips IU 22型超声诊断仪,L12-5高频线阵探头,频率5~12 MHz;或Hitachi VISION Ascendus超声诊断仪,9L4实时线阵高频探头,频率4~10 MHz。嘱患者仰卧,充分暴露双乳,由2名具有5年以上工作经验的超声科医师行常规扫查,并重点观察病灶区域;之后嘱患者侧卧,扫查双侧腋窝。记录乳腺癌原发病灶位置(内上、外上、内下、外下象限或乳晕区)、形态(规则或不规则)、边界(清晰或不清晰)、边缘(光整或不光整)、有无钙化、最大径(>2 cm或≤2 cm)、纵横比(>1或≤1)、内部回声(均匀或不均匀)、后方回声(未衰减、衰减或消失)及Alder血流分级(0~Ⅰ级或Ⅱ~Ⅲ级)[7],见图1、2。
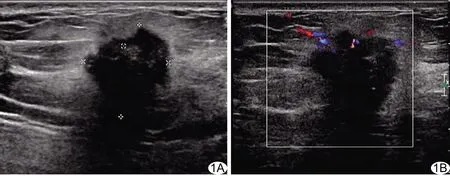
图1 患者女,53岁,左侧乳腺浸润性导管癌伴左侧腋窝淋巴结转移 A.超声声像图示左侧乳腺外上象限2.8 cm×2.3 cm分叶状肿块,边界不清,内部回声不均匀,见多个簇状强回声,后方伴声衰减,纵横比<1;B.CDFI示肿块Alder血流分级为Ⅱ级

图2 患者女,50岁,右侧乳腺浸润性导管癌 A.超声声像图示右侧乳腺内下象限1.0 cm×0.8 cm不规则肿块,边界清晰,内部回声欠均匀,见少许点状强回声,后方回声未见衰减,纵横比>1;B.CDFI示肿块Alder血流分级为0级
1.3 统计学分析 采用SPSS 22.0和MedCalc 15.2.0统计分析软件。以±s表示符合正态分布的计量资料、以中位数(上下四分位数)表示不符合正态分布者,以百分率表示计数资料;采用χ2检验行组间单因素分析,以差异有统计学意义的因素为自变量,以是否发生腋窝淋巴结转移为因变量,行二元Logisitic回归分析;绘制受试者工作特征(receiver operating characteristic, ROC)曲线,计算曲线下面积(area under the curve, AUC)。以Kappa检验分析Logisitic模型预测结果与病理结果的相关性,Kappa值≥0.75为一致性较好,0.40≤Kappa值<0.75为一致性一般,Kappa值<0.40为一致性较差。P<0.05为差异有统计学意义。
2 结果
转移组与未转移组乳腺癌病理类型及原发病灶最大径、纵横比、内部回声、边界和Adler血流分级差异均有统计学意义(P均<0.05),而原发病灶位置、后方回声、形状、边缘及钙化差异均无统计学意义(P均>0.05),见表1、2。
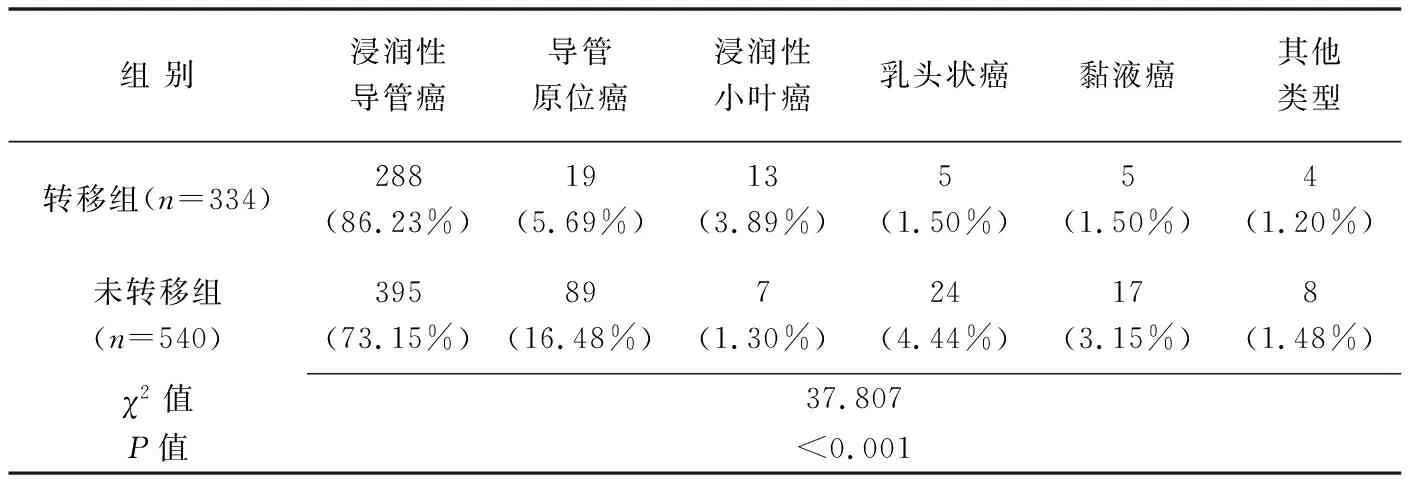
表1 转移组与未转移组乳腺癌病理学类型比较

表2 乳腺癌超声特征与腋窝淋巴结转移的单因素分析结果[例(%)]
原发病灶最大径>2 cm、纵横比≤1、内部回声不均、边界不清和Adler血流Ⅱ~Ⅲ级是乳腺癌腋窝淋巴结转移的独立危险因素(P<0.05,表3),据此建立回归方程Logit(P)=-1.706+0.406×肿块最大径>2 cm+1.415×肿块纵横比≤1+1.329×内部回声不均+0.851×边界不清+1.120×Adler血流Ⅱ~Ⅲ级。根据上述各单一参数预测乳腺癌腋窝淋巴结转移的AUC依次为0.571(95%CI0.538~0.604)、0.571(95%CI0.537~0.604)、0.512(95%CI0.478~0.545)、0.588(95%CI0.537~0.604)及0.579(95%CI0.545~0.612)(图3);而联合上述5个超声特征,模型以0.407为截断值预测乳腺癌腋窝淋巴结转移的AUC为0.696(95%CI0.664~0.726),大于所有单一特征(P均<0.05,表3),且与病理学结果的一致性尚可(Kappa=0.702,表4)。
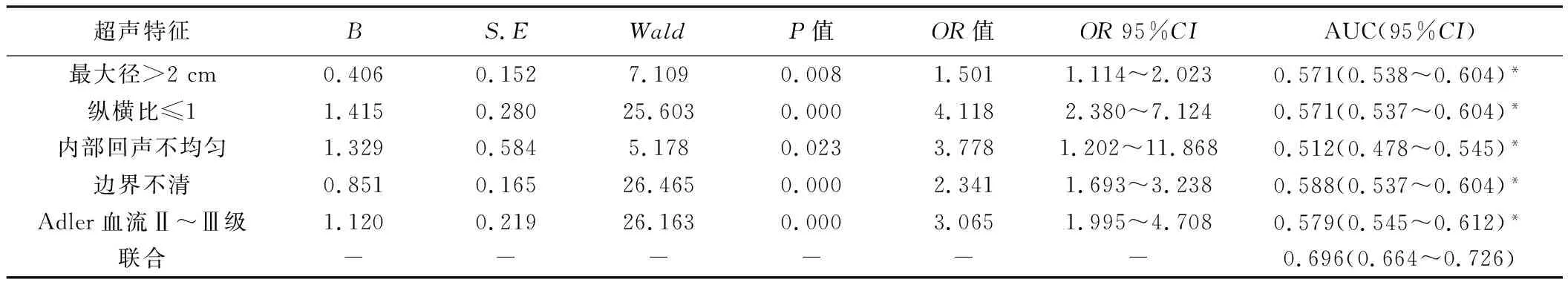
表3 多因素Logistic回归分析乳腺癌超声特征预测腋窝淋巴结转移

图3 乳腺癌原发病灶最大径>2 cm、纵横比≤1、内部回声不均、边界不清及Adler血流Ⅱ~Ⅲ级预测腋窝淋巴结转移的ROC曲线

表4 联合模型预测乳腺癌腋窝淋巴结转移与病理学结果对比
3 讨论
乳腺癌是否已发生腋窝淋巴结转移对于选择治疗方案及评估预后具有重要价值[8]。《中国抗癌协会乳腺癌诊治指南与规范(2019年版)》[9]指出,对于前哨淋巴结活检阳性或无法接受前哨淋巴结病理学活检的乳腺癌患者必须施行腋窝淋巴结清扫术,但腋窝淋巴结清扫术后并发症严重影响患者生存质量。术前准确评估腋窝淋巴结转移与否有助于避免不必要的腋窝淋巴结清扫术及其所致并发症。
腋窝淋巴结转移超声表现与淋巴结反应性增生存在部分重叠,故仅凭超声声像图所见难以准确判断乳腺癌腋窝淋巴结转移[6];且淋巴结髓质回声与脂肪相近,定性诊断较困难[10-11]。本研究筛选可用于预测腋窝淋巴结转移的乳腺癌原发病灶超声表现,建立Logistic回归预测模型,并观察其诊断效能。
既往研究[10]发现,乳腺原发病灶直径可预估乳腺癌腋窝淋巴结转移情况,原发病灶体积越大,累及乳腺范围越广,肿瘤细胞侵袭能力越强,沿淋巴导管转移的可能性越高。原发病灶边界不清或出现毛刺征亦可提示肿瘤转移,因其系肿瘤细胞浸润周围正常组织所致,表现越明显,反映癌细胞浸润性越强,可为术前预测乳腺癌腋窝淋巴结转移提供重要参考[12]。超声发现乳腺癌原发病灶及其周围异常分布血流信号提示肿瘤发生转移,这是由于肿瘤细胞呈高代谢,释放血管生长因子刺激滋养血管形成广泛、紊乱的吻合支,利于肿瘤生长及转移[13]。一般认为乳腺癌原发病灶部分坏死后形成钙盐沉积,存在钙化、特别是微小钙化常提示乳腺组织严重受侵[14];但本研究转移组与未转移组间乳腺癌原发病灶内钙化差异无统计学意义,有待进一步观察。
原发病灶纵横比是超声鉴别良、恶性病变的有效指标,但对于能否以之预测乳腺癌腋窝淋巴结转移尚无统一认识。李燕等[15]认为乳腺原发病灶纵横比>1可预测乳腺癌腋窝淋巴结转移;也有学者[16]认为原发病灶的纵横比并非腋窝淋巴结转移的危险因素。本研究结果显示,根据乳腺原发病灶纵横比≤1可预测乳腺癌腋窝淋巴结转移。
本研究联合应用乳腺癌原发病灶超声特征构建模型预测乳腺癌腋窝淋巴结转移,结果显示原发病灶最大径>2 cm、纵横比≤1、内部回声不均、边界不清和Adler血流Ⅱ~Ⅲ级是乳腺癌腋窝淋巴结转移的独立危险因素;联合模型预测乳腺癌腋窝淋巴结转移的效能高于单一特征,且与病理学结果的一致性尚可(Kappa=0.702),可为术前评估乳腺癌及制定手术方案提供重要参考。
本研究的主要局限性:①未能统一采用相同型号超声仪进行扫查;②仅观察乳腺癌常规超声特征,未涉及弹性成像及超声造影等,有待完善。
综上,根据乳腺癌常规超声征象构建的Logistic联合模型可预测乳腺癌腋窝淋巴结转移;原发病灶最大径>2 cm、纵横比≤1、内部回声不均匀、边界不清晰及Adler血流Ⅱ~Ⅲ级提示转移风险较高。
