脂蛋白a水平及心脏超声心动图钙化评分与冠心病的相关性
2021-09-01董红志李曦铭丛洪良朱延波王庆彤
董红志,李曦铭*,丛洪良,朱延波,王庆彤
(1.天津市胸科医院心内科,2.超声科,3.检验科,天津 300222)
心血管疾病(cardiovascular disease,CVD)是危及人类生命健康的主要疾病之一,冠心病(coronary heart disease,CHD)则是CVD中最主要的致死疾病。早期准确筛查CHD高危人群并积极预防至关重要,但部分低密度脂蛋白(low density lipoprotein,LDL)控制良好患者仍可能发生心血管不良事件,即存在CVD残余风险,而脂蛋白a[lipoproteina,Lp(a)]增高是CVD残余风险的高危因素[1]。近年来,心脏超声心动图钙化评分(echocardiographic calcium score,eCS)与CHD的相关性逐渐受到重视[2]。本研究观察Lp(a)、eCS与CHD的相关性,以寻找更简便、敏感、安全和经济的早期筛查CHD方法。
1 资料与方法
1.1 研究对象 纳入2019年6月—2020年5月229例于天津市胸科医院接受治疗、且冠状动脉造影结果显示至少1支冠状动脉主要分支狭窄≥50%的CHD患者(CHD组),男128例,女101例,年龄46~87岁,平均(65.8±7.7)岁;根据病变累及范围分为单支亚组(n=87)、双支亚组(n=47)及三支亚组(n=95);以同期113名于本院体检中心经冠状动脉CT血管造影(CT angiography, CTA)排除CHD的志愿者作为对照组,男48名,女65名,年龄50~88岁,平均(63.7±8.0)岁。排除罹患主动脉瓣先天性畸形、风湿性心脏瓣膜病、感染性心内膜炎、系统性红斑狼疮、严重肾衰竭或甲状旁腺功能亢进等可能影响钙磷代谢的全身性疾病者。本研究通过院伦理委员会审查(编号:2019LW-008)。检查前受试者均签署知情同意书。
1.2 仪器与方法 采用Philips IE Elite/EPIC 7C彩色多普勒超声诊断仪,S5-1探头,频率1.0~5.0 MHz。由2名具有5年以上工作经验的超声科医师独立评估主动脉根部、主动脉瓣、二尖瓣环、乳头肌及室间隔钙化情况。判断标准:主动脉根部以发现主动脉窦以上2 cm钙化为阳性,主动脉瓣以回声增强、且瓣膜厚度≥1 mm为阳性,二尖瓣环、乳头肌及室间隔以其回声高于周围相邻组织为阳性;据此行eCS(0~5分),即每检出一处上述部位钙化记为1分(图1~4)。意见分歧时,由另1名具有15年以上工作经验的超声科医师再行独立判断并得出结果。
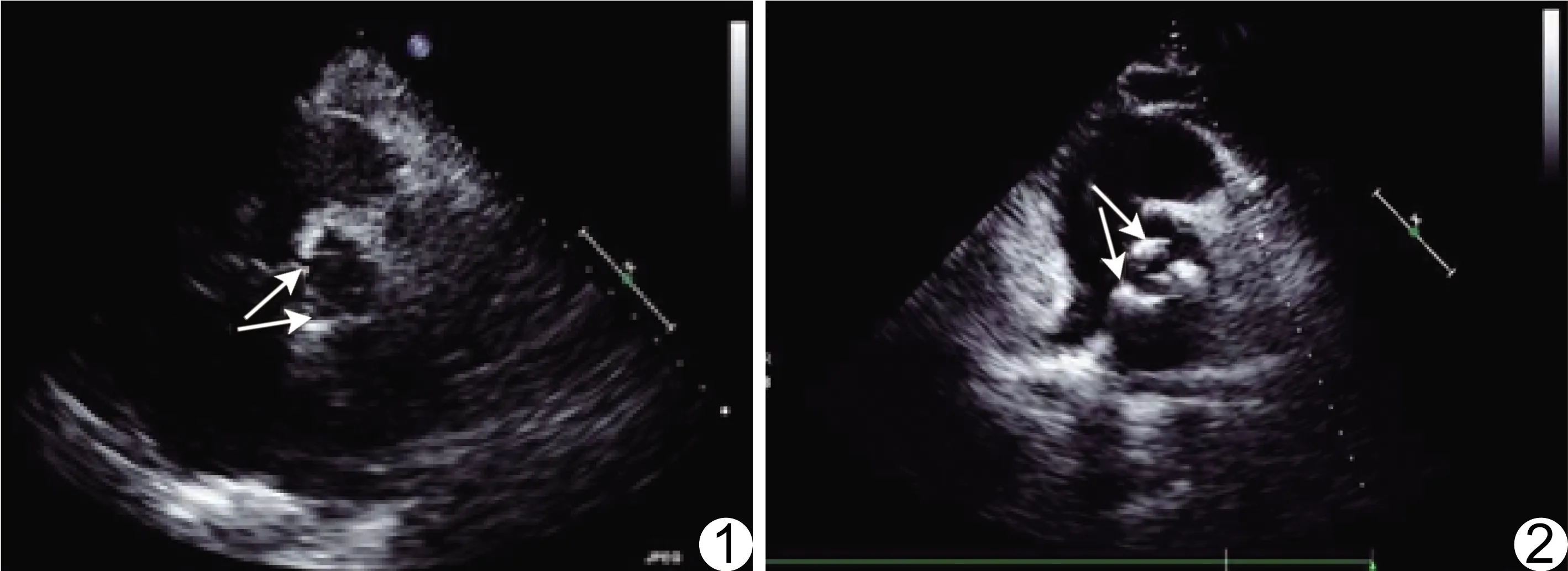
图1 志愿者男,61岁 超声心动图未见主动脉瓣(箭)钙化 图2 患者女,64岁,CHD 超声心动图示主动脉瓣(箭)钙化

图3 患者男,78岁,CHD 超声心动图示主动脉瓣(黄箭)和二尖瓣(红箭)钙化 图4 患者男,76岁,CHD 超声心动图示主动脉瓣(黄箭)、二尖瓣(红箭)及室间隔(白箭)钙化
1.3 基本资料 记录受试者体质量指数(body mass index,BMI)、血压及病史和空腹血糖(fasting blood glucose,FBG)、Lp(a)、总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、高密度脂蛋白(high density lipoprotein,HDL)、LDL、载脂蛋白A(apolipoprotein A,ApoA)、载脂蛋白B(apolipoprotein B,ApoB)及肌酐(creatinine,Cr)检测结果。
1.4 风险分层 以eCS为0分且Lp(a)<75 nmol/L为CHD低危,eCS≥1分或Lp(a)≥75 nmol/L为中危,eCS≥1分且Lp(a)≥75 nmol/L为高危。
1.5 统计学分析 采用SPSS 22.0统计分析软件。以±s表示符合正态分布的计量资料,行t检验;以中位数(上下四分位数)表示不符合正态分布的计量资料,行秩和检验;以频率表示计数资料,行χ2检验。采用Kendall秩相关分析评价eCS与冠状动脉病变支数的相关性。以Logistic多因素回归分析评价各指标与CHD的相关性。P<0.05为差异有统计学意义。
2 结果
2.1 基本资料 CHD组与对照组BMI、饮酒史、TC、TG、LDL及ApoB水平差异均无统计学意义(P均>0.05);性别、年龄、吸烟史、糖尿病史及高血压史差异均有统计学意义(P均<0.05)。CHD组FBG、Lp(a)及Cr水平明显高于对照组,ApoA及HDL水平明显低于对照组(P均<0.05),见表1。

表1 CHD组与对照组基本资料比较
2.2 eCS与Lp(a)水平 CHD组76.86%(176/229)患者eCS≥1分,23.14%(53/229)为0分;对照组20.35%(23/113)受检者eCS≥1分,79.65%(90/113)为0分;组间eCS差异具有统计学意义(χ2=96.391,P<0.001)。CHD各亚组与对照组eCS差异均有统计学意义(P均<0.05),见表2;eCS与冠状动脉病变支数呈正相关(r=0.377,P<0.001)。CHD各亚组Lp(a)水平均明显高于对照组(P均<0.05),双支及三支亚组Lp(a)水平均明显高于单支亚组(P均<0.05)。

表2 CHD各亚组与对照组eCS比较
2.3 风险分层 CHD组17.03%(39/229)患者风险分层为低危,51.53%(118/229)为中危,31.44%(72/229)为高危;对照组69.03%(78/113)受检者为低危,27.43%(31/113)为中危,3.54%(4/113)为高危;组间风险分层差异有统计学意义(χ2=96.384,P<0.001)。CHD组中危、高危患者占比明显高于低危(χ2=56.993、71.090,P均<0.001),中危占比明显高于高危(χ2=9.255,P=0.002)。
2.4 回归分析 糖尿病史、eCS及Lp(a)水平均为CHD的独立危险因素,糖尿病使患者CHD发病风险增加约2.018倍;存在eCS≥1分或Lp(a)≥75 nmol/L其中之一时,CHD风险增加约7.658倍;2个危险因素均存在时,CHD风险增加达36.970倍,见表3。

表3 CHD的多因素Logistic回归分析
3 讨论
心脏钙化与动脉粥样硬化的病理生理启动阶段机制相似,并共有多项相关生理轴而致纤维化、钙化[3]。既往已有多项研究[4-5]探讨心脏钙化与CHD的相关性。心脏CT可直接诊断心脏钙化,是目前的诊断标准,但费用高、存在辐射且无法进行床旁检查等原因使其临床应用受限。超声心动图操作简便、易行且无创,各级医院及机构均可开展,但目前采用的超声心动图评估心脏钙化的标准不完全一致。本研究采用的eCS简便易行,易于标准化并进行统一分析。GAIBAZZI等[6]指出,eCS评估CHD风险与心脏CT钙化评分相似,可独立预测发生CHD的风险,且预测价值高于其他临床参数;本研究发现CHD组eCS≥1患者占比明显高于对照组,支持上述观点。
Lp(a)由脂蛋白及单分子ApoA组成,其水平主要与基因相关,几乎不受饮食、运动、生活方式或药物的影响,检测结果的稳定性强。既往研究[7]证实,Lp(a)水平>75 nmol/L为CVD发生、发展的危险因素。编码ApoA的LPA基因决定了环状结构域IV2(kringle IV2,KIV2)在ApoA中出现相同的重复拷贝的数目不等[8],KIV2拷贝数越少则ApoA分子越小,越易于合成、分泌,使相应Lp(a)水平越高,导致CVD发病风险增高[9];但目前不同指南针对何种水平Lp(a)需给予干预或是否需要控制特定人群的Lp(a)水平尚未达成共识[10-11]。本研究基于Lp(a)和eCS进行风险分层,发现CHD组中危和高危患者占比明显高于低危者,而eCS≥1分和(或)Lp(a)≥75 nmol/L均为CHD的危险因素,有助于实现早发现、早诊断及早治疗CHD。
高危患者CHD发生率增高可能与心脏钙化和动脉粥样硬化启动阶段的病理生理机制相似以及脂质浸润沉积于瓣膜及动脉内膜下有关。Lp(a)不易与LDL受体相结合,难以正常代谢;聚集于血管内的Lp(a)进入动脉壁或内皮下后更易被结合,并被巨噬细胞吞噬、降解而致胆固醇堆积[12],且Lp(a)与纤维蛋白和纤溶酶原相互作用,可抑制活化的纤溶酶降解纤维蛋白而促进血栓形成[13];另一方面,Lp(a)可与进入血管壁的氧化脂质结合,并造成氧化脂质蓄积,导致细胞代谢异常[14]。因此,患者同时出现Lp(a)升高与心脏钙化提示Lp(a)已参与动脉粥样硬化形成及炎症钙化,使其发生CHD的风险明显升高。
综上,eCS及Lp(a)水平是CHD的独立危险因素,可作为筛查CHD的良好指标,且操作简便,利于大规模筛查。但本研究样本量较少,有待进一步从分子机制和基因角度评价CHD与Lp(a)及心脏瓣膜心肌组织钙化之间的相关性,并深入探索其分子生物学机制。
