海洋无脊椎动物大防御素的研究进展
2021-08-31许艳红周洪磊胡晓珂
许艳红,闵 军,周洪磊,张 怡,刘 卫,胡晓珂,*
(1.福建农林大学食品科学学院,福建 福州 350002;2.中国科学院烟台海岸带研究所, 海岸带生物学与生物资源利用重点实验室,山东 烟台 264003;3.福建省洋泽海洋生物科技有限公司,福建 福州 350600)
抗菌肽是动物、植物、真菌、细菌等生物产生的一类具有生物学活性的物质总称,包括阳离子抗菌肽、阴离子抗菌肽和其他类型抗菌肽。抗菌肽不仅具有抗菌、抗病毒、抗真菌等多种生物活性,还具有广泛的免疫和非免疫功能[1],是抗生素的天然替代品之一。在临床、医药、禽畜养殖、水产养殖和食品等行业都有良好的应用前景。
防御素是一类富含半胱氨酸的阳离子抗菌肽,广泛存在于植物、动物、真菌等多细胞真核生物中[2]。大防御素作为防御素的超家族成员,目前主要发现于海洋无脊椎动物中[3]。大防御素最早从节肢动物鲎(Tachypleus tridentatus)的颗粒血细胞中分离出来[4],随后在双壳贝类、头索动物文昌鱼中相继被鉴定[5-8]。大防御素成熟肽含有两个串联的结构域,分别为高度疏水性N端结构域和阳离子类β-防御素C端结构域[3-4]。其中,N端结构域与其他防御素没有任何同源性,被认为是大防御素的标志[9], 而C端结构域与脊椎动物β-防御素在结构和功能上相似,因此普遍认为β-防御素是大防御素进化而来的[3,10]。大防御素的两个功能域抗菌活性不同,N端结构域主要抗革兰氏阳性菌,C端结构域主要抗革兰氏阴性菌[4],在菌存在的条件下,牡蛎(Crassostrea gigas)大防御素Cg-BigDef1的N端结构域驱动大防御素组装纳米网络结构诱捕病原菌的能力可为新型药物的开发提供参考[3]。目前,大防御素在生物体内合成量少,化学合成成本高,导致大防御素的应用开发缓慢。本文将从来源与分布、分子结构与遗传进化、组织表达与调控、作用机理等方面对大防御素的研究进展进行阐述,并展望大防御素在水产养殖和育种、水产源食品安全、基因工程和抗菌药物研发等方面的应用潜力,以期为大防御素的应用提供参考。
1 大防御素的来源与分布
目前大防御素蛋白主要发现于软体动物、节肢动物鲎、头索动物文昌鱼中,都属于两侧对称动物。根据两侧对称动物的分类,对大防御素的分布进行了动物门、纲上的定位(图1)。根据18S rRNA序列比对结果将两侧对称动物进行遗传学分类,分为原口动物和后口动物,原口动物按照“蜕皮假说”包括冠轮动物总门和蜕皮动物总门[11-12],由图1可知,大防御素在蜕皮动物总门中的分布十分狭窄,仅在节肢动物鲎中发现有大防御素。 尽管节肢动物昆虫纲、蛛形纲、甲壳纲中动物数量庞大,但仍未发现有大防御素的踪迹。
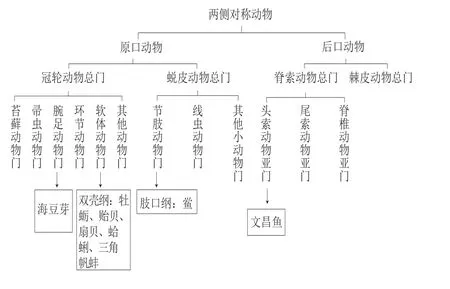
图1 大防御素在动物类群中的分布[9]Fig.1 Distribution of big defensins in animal groups[9]
大防御素在冠轮动物中分布广泛,软体动物中几乎所有的双壳纲贝类均发现有大防御素,包括牡蛎[6]、贻贝[5]、 扇贝[7,13-15]、蛤[16]、魁蚶[17]等海洋无脊椎动物,特别地,还包括淡水生物三角帆蚌(Hyriopsis cumingii)[18]。目前,尽管大防御素主要在软体动物门的双壳纲中被报道,但Gerdol等[9]从后生动物的进化过程出发,根据目前大防御素的物种分布,发现大防御素在软体动物中的分布并不局限于双壳纲类,预测在腹足纲(Gastropoda)、头足纲(Cephalopoda)动物,以及冠轮动物总门中的环节动物门(Annelida)、帚虫动物门(Phoronida)、苔藓动物门(Bryozoa)动物中也含有大防御素基因。目前,在头足纲动物章鱼、鱿鱼以及腕足动物门舌形贝(Lingula unguis)的基因组中识别出了大防御素蛋白的基因序列,但基因是否能表达还有待进一步的鉴定。此外,大防御素在后口动物中也存在,但是其分布非常狭窄,仅限于头索动物亚门文昌鱼属(Branchiostoma)[8]。 综上,大防御素在物种中的分布是分散的,可能是由于某些物种中存在大防御素基因的丢失,而在另外一些物种中得以选择性地保留。
2 大防御素的分子结构、基本性质与进化关系
根据脊椎动物防御素的结构和6 个保守的半胱氨酸的配对模式可将其分为α-防御素、β-防御素、θ-防御素。α-防御素是最早被报道的防御素,最先分离于兔巨噬细胞[19],目前在人、马、兔、鼠等少数哺乳动物的中性粒细胞和肠壁细胞中发现[2]。α-防御素通常由29~35 个氨基酸残基组成,6 个保守的半胱氨酸的配对方式为Cys1-Cys6、Cys2-Cys4、Cys3-Cys5。研究发现α-防御素的基因起源于β-防御素基因[20]。β-防御素是最古老的脊椎动物防御素类型,分布极其广泛,从鱼类这种低等脊椎动物到鸟类再到哺乳类动物中均有大量的β-防御素发现。β-防御素通常由36~45 个氨基酸组成,6 个保守的半胱氨酸的配对方式为Cys1-Cys5、Cys2-Cys4、Cys3-Cys6[10]。β-防御素的功能广泛,除具有广谱抗菌活性外,在动物体内还可作为先天免疫和获得性免疫的沟通桥梁,作为免疫调节剂提高机体的免疫能力[21]。θ-防御素存在于恒河猴、狒狒等非人灵长类动物中,分布极其窄[22]。θ-防御素是由两个截短的α-防御素组成的环状二聚体多肽,含有18 个氨基酸残基[23-24],6 个保守的半胱氨酸的配对方式为Cys1-Cys6、Cys2-Cys5、Cys3-Cys4[2]。θ-防御素基因是由α-防御素基因进化而来的[25]。虽然无脊椎动物大防御素分子中也同样含有3 个保守的二硫键,而且其二硫键的连接方式与脊椎动物β-防御素相同,然而,大防御素从防御素中独立分支出来,其结构特点有别于脊椎动物防御素。动物防御素的分布、大小、结构特点以及进化关系见表1。

表1 动物防御素的分布、氨基酸序列、结构特点以及进化关系Table 1 Distribution, amino acid sequences, structural characteristics and evolutionary relationships of animal defensins
2.1 大防御素的基因结构
根据序列和物种的不同,大防御素基因结构也有所区别,但是大多数贝类和文昌鱼的大防御素基因都含有3 个外显子[9]。牡蛎大防御素是一个多序列家族,包含Cg-BigDef1、Cg-BigDef2、Cg-BigDef3基因簇。Cg-BigDef3具有一个典型大防御素基因结构,含有3 个外显子和2 个内含子,第一个外显子转录部分5′非编码区序列,第2个外显子编码部分5′非编码区序列、信号肽、前肽序列以及成熟肽的N端结构域,第3个外显子编码富含半胱氨酸的C端类β-防御素结构域和部分3′非编码区序列(图2)。大防御素基因结构也有一些特殊性,如Cg-BigDef1和Cg-BigDef2的基因组结构相似,只含有两个外显子和一个内含子,这与三者的表达类型相一致,即Cg-BigDef3为组成型表达,Cg-BigDef1和Cg-BigDef2为诱导型表达,说明Cg-BigDef3仅编码部分5′非编码区序列的外显子对于蛋白的表达具有重要作用[6],同时也说明含有3 个外显子的大防御素基因结构更原始。虾夷扇贝My-BigDef基因是由4 个外显子和3 个内含子组成,也含有一个仅编码5′非编码区的外显子[13],并且其成熟肽N端的编码在第2个和第3个外显子之间隔开。显示出大防御素基因结构具有多样性,暗示了大防御素在不同物种中的遗传机制不同[9]。然而,从图2中可以看出这些大防御素基因结构虽然存在差异,但是C端结构域均是由单一的外显子编码,显示出保守区域的保守表达。

图2 几种大防御素基因结构示意图[6,13,29]Fig.2 Gene architecture of big defensins[6,13,29]
2.2 大防御素的蛋白结构
大防御素在生物体内首先是以前体的形式存在,包括信号肽、前域、成熟肽3 个部分[13,18](图3)。在抗菌肽中,前域普遍存在,例如鲎素[32]、贻贝肽[33]、地中海贻贝类防御素肽[34]和贻贝素[35]等。前域的作用可能是将分子导向储存在它们的特定颗粒中,阻断对宿主细胞的毒性,亦或是稳定蛋白水解过程中前体的构象[36]。但前域与大防御素的储存、成熟的相关性还不明确。大防御素是一种分泌肽,信号肽的存在有利于肽的分泌。大防御素成熟肽的获得首先是信号肽酶切除信号肽,然后类KeΧ-2的蛋白酶识别Arg-Χ(n)-Arg/Lys-Ary位点并进行切割,酶切后,得到含有79~94 个氨基酸残基的成熟肽[10]。这种情况在脊椎动物β-防御素中也有发现[21]。
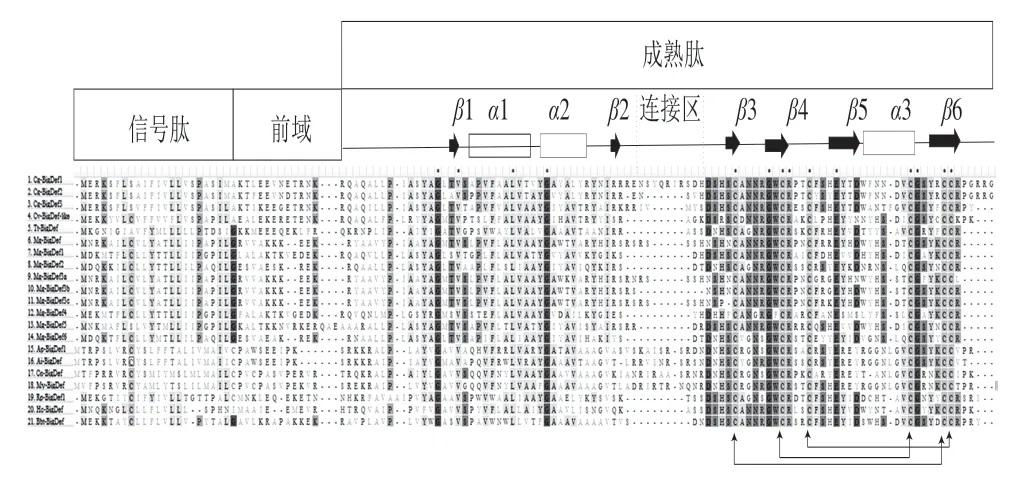
图3 大防御素氨基酸序列的多重比对[3,5]Fig.3 Multiple sequence alignment of big defensin peptides[3,5]
2.2.1 大防御素的初级结构
大防御素的初级结构分为结构残基和功能残基。结构残基与高级结构的稳定性以及生物利用度紧密相关,这类氨基酸残基高度保守。功能残基则主要是指一些电荷性、疏水性氨基酸残基[30]。大防御素的最典型结构残基是6 个保守的半胱氨酸残基,参与形成3 个分子内二硫键(图3)。二硫键的存在使大防御的结构更加紧密,保证高级结构的稳定,有利于更好地发挥抗菌活性。大防御素成熟肽N端含有大量的疏水性氨基酸残基,使N端结构域高度疏水,与大防御素盐离子稳定性 相关[3,37]。大防御素的C端含有阳离子氨基酸残基,使C端具有功能性,对革兰氏阴性菌有更强的抗性[4]。研究发现,功能域中所带的电荷与生物活性有很强的相关性,电荷的增加与活性的提高有关。且通常有一个最佳的活性电荷数,超过或低于这个值越多,活性越低[38]。鲎大防御素Tt-BigDef由于既有亲水性又有疏水性的特点,是一种两亲性分子[39]。目前,研究已证明两亲性特征是多种抗菌肽杀菌活性所必需的结构特征之一[38]。说明大防御素发挥抗菌作用时,2 个结构域均有参与,Loth等[3]证明二者具有协同作用。然而,牡蛎大防御素Cg-BigDef1与鲎大防御素Tt-BigDef不同,其具有疏水性。Cg-BigDef1、Tt-BigDef中连接两个结构域的连接区大小不同(图3),进而导致两结构域在空间构象中的方向不同,致使两者存在理化性质和生物学活性的差异,而具体的原因有待进一步研究。
2.2.2 大防御素的高级结构大防御素的高级结构的研究包括二级结构和三级结构, 而三级结构仅限于鲎大防御素Tt-BigDef和牡蛎大防御素Cg-BigDef1(图4),鲎大防御素Tt-BigDef的二级结构以及高级结构为N端含有平行的两股β-折叠片,与两个α-1,2-螺旋连接形成β1-α1-α2-β2模式(图3),形成核心具有疏水性的球形结构(高度疏水性N端结构域); C-端含有4 条反向平行的β-折叠片,形成β3-β4-β5-α3-β6模式,3 个二硫键分别连接β3-β6、β4-α3、β4-β5环与β6,得到由二硫键稳定的C端结构(阳离子类β-防御素C端结构域)(图3)[37]。Loth等[3]采用自然化学连接法合成了牡蛎大防御素Cg-BigDef1以及两个分离的功能域,完整的Cg-BigDef1具有与鲎大防御素相似的二级结构,含有6 个β-折叠结构和3 个α-螺旋结构。如图4所示的鲎大防御素和牡蛎大防御素的空间结构,二者二级结构相同,但空间构象中两功能域的方向不同,可能是连接区的柔性不同导致的。
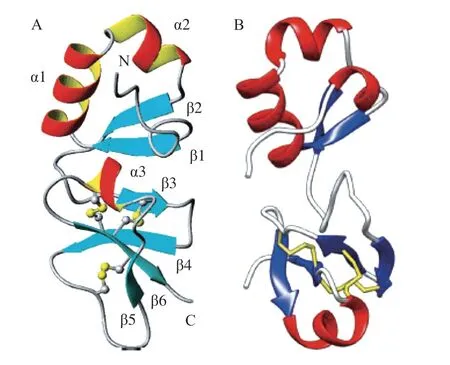
图4 鲎大防御素Tt- BigDef(A)和牡蛎大防御素Cg-BigDef1(B)的空间结构[9,37]Fig.4 3D structures of Tt-BigDef (A) and Cg-BigDef1 (B)[9,37]
2.3 大防御素的基本性质
大防御素作为防御素的超家族成员,具有保守的半胱氨酸序列,有良好的pH值和热稳定性[40],且水溶性较好,能耐受饲料加工过程中的高温高压等剧烈条件[41]。哺乳动物β-防御素抗菌活性严重受到盐离子浓度影响[42-43], 大防御素由于具有两种功能域,而具有盐离子稳定性。Loth等[3]比较大防御素与β-防御素时,发现大防御素较β-防御素多一个N端疏水性结构域,N端结构域对大防御素的盐离子稳定性具有重要作用。牡蛎大防御素Cg-BigDef1在300 mmol/L和400 mmol/L NaCl的高盐浓度下仍能保持较强的抗菌活性,主要在于大防御素的两个结构域的共价结合[3]。
2.4 大防御素的进化分析
大防御素的系统进化树(图5)显示大防御素在同一物种如贻贝(Mytilus galloprovincialis)中发生了变异,且这些变异都是单源的(氨基酸序列相似性为49.59%~81.03%),可能是串联重复基因和同源基因置换后快速分子多样化的结果[9]。贻贝大防御素与牡蛎大防御素(相似性为48.18%~59.95%)被归为同一单源分支,二者的亲缘关系较其他物种高,与扇贝属的大防御素亲缘关系(相似性为34.19%~38.05%)最远。贻贝和扇贝属大防御素种内多样性要大于种间多样性。目前,大防御素的系统进化树只能解释部分大防御素的进化问题,更加详细的信息还需要结合更多大防御素的 基因组结构、基因变异以及物种分布鉴定知识才能了解。Gerdol等[9]将大防御素基因在物种中的分布与后生动物的物种进化树结合进行分析,预测出大防御素基因出现在两侧对称动物的祖先中,但是目前还并未在两侧对称动物进化祖先中发现大防御素的同源物,对大防御素的鉴定仍需进一步展开。

图5 大防御素的系统进化树[5-6,9]Fig.5 Phylogenetic tree of big defensins[5-6,9]
大防御素C端结构域与β-防御素在拓扑结构和功能上具有相似性。一般认为在系统发育上进化关系较远的物种之间分子具有结构相似性,分为两种:一种是分子结构和功能的趋同进化;另一种是两种结构和功能相近的分子具有遗传进化的关系。目前,关于大防御素与哺乳动物β-防御素的关系,学者更倾向于后一种。大防御素在原口动物和后口动物(文昌鱼)中均有存在(图1),而后口动物中头索动物、尾索动物和脊椎动物都是由古老的脊索动物进化而来的,头索动物文昌鱼是无脊椎动物进化为脊椎动物过程中的过渡生物,文昌鱼中大防御素的发现让学者更容易相信无脊椎动物大防御素与脊椎动物防御素之间在进化上具有一定的相关性。Zhu Shunyi等[10]基于基因水平上的分析,发现这两种防御素基因高度保守区域均含有一个保守的相位1内含子(处于密码子内的第一和第二核苷酸之间),均在C端结构域的5′端,猜想脊椎动物β-防御素基因是由大防御素基因经过外显子重排或外显子内含子化进化而来的。进化关系较远的基因在结构和内含子相位上的保守,可以认为这些基因具有共同的起源[44]。Gerdol等[9]认为大防御与脊椎动物β-防御素具有共同的起源,并且大防御素在不同物种中是采用不同的遗传机制进行进化的。
而对无脊椎动物大防御素和脊椎动物的α-防御素、β-防御素、θ-防御素(图6)的系统发育分析并没有表现出脊椎动物防御素是由大防御素进化的关系,其中的原因可能是大防御素在无脊椎动物物种的分布少且分散,导致数据不够全面,亦或是这种方法的可靠程度不足以说明问题。

图6 动物防御素和大防御素的系统进化树[5-6,29]Fig.6 Phylogenetic tree of big defensins and defensins[5-6,29]
3 大防御素的组织表达与调控
3.1 大防御素的组织表达多态性
大防御素作为无脊椎动物先天免疫系统中的重要效应因子,在不同物种中的组织表达模式不同,呈现出多态性的特点(表2)。首先,大防御素在组织中的表达具有多样性。在同一属的物种中,大防御素在不同组织中的表达情况不同,如虾夷扇贝(Mizuhopecten yessoensis)大防御素基因My-BigDef在血液中的相对表达量最低,在外套膜中的相对表达量最高,消化腺肝胰脏和闭壳肌中相对表达量较高,外套膜可能是My-BigDef的重要合成器官[13]。海湾扇贝(Argopecten irradians)大防御素基因Ai-BigDef主要在血细胞中表达,在鳃中也有微量表达,但是在其他检测组中几乎不表达[14]。而同一物种中大防御素基因的变异型在组织中的表达情况也不相同,如贻贝中现已报道了6 种大防御素基因簇,其中My-BigDef1和My-BigDef3分别在消化腺和鳃中的相对表达量最高,在其余组织中均无法检出,而My-BigDef2/6主要在外套膜中表达,但在消化腺和肌肉中也有少量表达[5]。另外,大防御素在不同物种中具有组织表达特异性,如牡蛎大防御素基因Cg-BigDef家族对血细胞具有特异性[6],贻贝、魁蚶大防御素基因的主要表达组织为消化腺[5,17],栉孔扇贝(Mimachlamys nobili)、紫扇贝(Argopecten_purpuratus)大防御素基因Cn-BigDef、Ap-BigDef1主要 在外套膜中表达[7,15]。某些大防御素基因不在血细胞中表达而特异性地在组织中表达,说明该大防御素可能是在组织上皮细胞的免疫应答中发挥作用,也可能是与维持局部组织表面的菌群稳态有关[45]。

表2 大防御素基因在软体动物不同组织中的组成型表达Table 2 Constitutive expression profiles of big defensin genes in different tissues of bivalve mollusks
3.2 大防御素的表达调控
3.2.1 大防御素在菌刺激下的组织表达响应多样性
在同一物种中,根据菌刺激下做出的响应不同,大防御素基因分为组成型和诱导型表达类型。如弧菌(Vibrio)刺激前,牡蛎的3 个大防御素基因簇中Cg-BigDef1、Cg-BigDef2表达量很低,而在弧菌刺激后,Cg-BigDef1、Cg-BigDef2的表达量显著上调,其表达受到弧菌刺激的强烈诱导,属于诱导型表达类型。而Cg-BigDef3在感染前后表达量无明显变化,表达不受菌感染的影响,属于组成型表达类型[6]。这说明牡蛎中存在一个基本的免疫因子储存过程以及应激反应机制,机体受到菌感染时,免疫系统能及时发挥作用,抵制病原体的侵害。虾夷扇贝大防御素基因My-BigDef在血细胞中组成型表达量最低,而鳗弧菌(Vibrio anguillarum)刺激24 h后,血液中大防御素的表达量急剧升高,达到组成型表达量的十几倍,菌刺激强烈诱导了虾夷扇贝血细胞中大防御素基因的表达[13]。然而,对于紫扇贝来说,血细胞中大防御素基因Ap-BigDef1不受菌刺激调控[7]。
在软体动物中,菌刺激下,大防御素基因的表达量会有一个动态变化过程,菲律宾蛤蜊(Venerupis philippinarum)大防御素基因Vp-BigDef、紫扇贝大防御素基因Ap-BigDef1、魁蚶大防御素基因Sb-BigDef1、海湾扇贝大防御素基因Ai-BigDef表达量开始会随着菌刺激时间的延长而逐渐上调,一定时间表达量达到峰值[7,14,16-17],而栉孔扇贝大防御素基因Cn-BigDef、三角帆蚌大防御素基因Hc-BigDef随着菌刺激表达的时序变化而不同,在达到峰值之前,会有表达量显著降低的情况,之后再显著上调[15,18],可能的解释是:1)表达大防御素的细胞会向感染部位聚集,导致其他组织中细胞减少致使大防御素的表达量下降,而细胞减少诱导了细胞的增殖,进而引起后续大防御素表达量的增加;2)表达大防御素的细胞被激活后会先分泌出已合成的大防御素成熟肽,因此导致了大防御素基因转录的减少[46]。目前,关于环境刺激对大防御素的影响仅限于菌刺激,而其他环境刺激的影响也需要进行研究,以便有利于更好地理解大防御素在宿主中的功能。
3.2.2 大防御素的表达受NF-κB/Rel信号通路调控
大防御素表达不仅要受到外界环境因子的调控,而在宿主中的表达还受到宿主内因子的影响。越来越多的研究发现,大防御素等抗菌肽基因的表达要受到核因子(nuclear facter,NF)-κB/Rel信号通路调控。NF-κB/Rel家族是由NF-κB1(p50和它的前体p105)、NF-κB2(p52和它的前体p100)、RelA(p65)、c-Rel和RelB组成。NF-κB抑制剂是与NF-κB/Rel家族相互作用的重要物质之一,在很大程度上,NF-κB/Rel信号通路的激活依赖于NF-κB抑制剂蛋白的大量降解,因此,NF-κB抑制剂被作为NF-κB/Rel信号通路的主要控制成分,在脊椎动物和无脊椎动物抗菌肽基因表达调控中起到了关键作用[47]。Oyanedel等[48]在扇贝中发现了编码NF-κB抑制剂的基因,采用RNA干扰技术抑制NF-κB的抑制剂表达,发现扇贝大防御素的表达显著上调,且对照组中编码NF-κB抑制剂基因在扇贝的所有组织中均能表达,而扇贝大防御素基因Ap-BigDef1在所有组织中也均有表达,说明大防御的表达受到NF-κB/Rel信号通路的调控。牡蛎中Rel基因的发现为大防御素受NF-κB/Rel信号通路调控提供了新的证据。Li Yinan等[49]对牡蛎进行菌刺激发现Rel基因的表达会增加,而通过干扰Rel基因的表达发现大防御素基因CgBigDef1的表达会减少。因此,通过对大防御素等抗菌肽基因表达调控的研究有利于更好地理解菌刺激下机体产生的不同免疫响应的分子机制。
4 大防御素的作用机理
目前,大多数抗菌肽主要是与细菌细胞膜发生相互作用在膜上成孔或形成离子通道等来增加膜的渗透性,引起细胞内物质的泄漏以及跨膜电势的瓦解,进而导致细胞死亡[50-51]。而双功能域的大防御素表现出不同于一般抗菌肽的抗菌机制。研究显示,大防御素可能有两种不同的抗菌过程:一种是鲎大防御素Tt-BigDef类型的抗菌作用,即大防御素在发挥抗菌作用时,N端结构域插入到细菌细胞膜中引起膜穿孔导致细胞死亡[37],强调了N端结构域的直接抗菌作用;另一种是牡蛎大防御素Cg-BigDef1类型的抗菌作用,其抗菌作用是在菌的刺激下,N端结构域驱动大防御素自组装成的纳米网络结构诱捕细菌进而将其杀死[3]。大防御素形成纳米网络结构的能力也被称为肽聚合能力,N端结构域被认为是这类大防御素发生肽聚合的重要驱动力,肽聚合使大防御素与细菌充分接触,而真正发挥杀菌活性的是C端结构域[9],强调了N端结构域的辅助作用。通过对上述牡蛎大防御素Cg-BigDef1和鲎大防御素Tt-BigDef结构和表面性质的比较概述,猜想可能是连接区长度的不同、空间结构中方向的不同共同导致了两者表面性质的差异,进而影响了抗菌作用。紫扇贝大防御素Ap-BigDef N端同样具有肽聚合能力[52],而Ap-BigDef两结构域间的连接区的长度与鲎大防御素接近,表明连接区的长度不是大防御素抗菌机制不同的直接原因,而空间构象对抗菌机制的影响有待进一步探讨和研究。此外,研究发现大防御素自组装成纳米网络结构还必须要有细菌的参与[3],可能是细菌中的某种物质或结构触发其构象的改变进而导致网络结构的形成,鲎大防御素Tt-BigDef在胶束溶液中N端空间构象会发生改变[37],但其是否能形成纳米网络结构还有待研究。因此,大防御素抗菌机理还有待进一步深入研究。
5 大防御素的应用潜力
5.1 抗菌耐药性的应用
由于抗生素的长期使用与滥用对耐药基因型细菌产生了选择压力,加速了耐药型细菌的进化,导致细菌耐药性的广泛传播与扩散,对于动物和人细菌性疾病的预防和治疗是一种巨大的隐患。相较于传统抗生素,抗菌肽药效学和抗菌机制在预防耐药性进化方面显示出巨大优势。目前,已有超过3 100 种天然抗菌肽在大量的植物和动物中发现[53],具有巨大的应用前景。牡蛎大防御素Cg-BigDef1对临床、环境分离的菌株以及对抗生素具有多重耐药性的菌株均有抗性,其通过形成纳米网络结构诱捕病原菌来达到杀菌的目的,不会加速细菌耐药性的进化,且对哺乳动物细胞无免疫源性、无抗性[9],有望应用于哺乳动物中多重耐药菌的感染治疗,有作为抗生素替代品的巨大潜力。近年来的研究发现不同抗菌肽之间具有抗菌协同作用[54],抗菌肽的协同作用可以减少耐药性基因进化的机率[55],特别是那些可以感染多种动物的病原菌,宿主会大量表达多种抗菌肽,在这些抗菌肽的协同作用下通过杀死病原菌来保障宿主的健康。因此,应进行大防御素与传统的抗生素结合使用研究,利用不同抗菌物质的协同抗菌作用来应对细菌耐药性的问题。梁正敏等[56]研究发现牛中性粒细胞β-防御素5可协助利福平发挥更强的牛分支杆菌抗性,说明防御素与抗生素的联合使用具有巨大的应用潜力。
5.2 水产养殖和育种、水产源食品安全中的应用
5.2.1 抗菌剂和疾病诊断
2008年,有研究发现β-防御素有对创伤感染和肺部感染疾病诊断的潜力[57]。而大防御素是无脊椎海洋动物先天免疫中的重要效应因子,当机体受到病原菌感染时,不同组织中的大防御素基因的表达显著上调,因此大防御素可作为海洋养殖软体动物疾病诊断的依据。大防御素具有广谱抗菌活性,对水产养殖动物抵抗病原菌感染具有重要作用,可作为抗菌剂应用于水产养殖中以防止病原菌的感染。目前研究显示,大防御素对革兰氏阳性菌具有较强的抗性,特别地,大防御素Cg-BigDef1是少数对水产致病性弧菌表现出显著抗性的抗菌肽[3]。近年来的研究发现,抗菌肽的抗菌活性不仅具有广度,而且对于某些特定菌株还具有特异性[58]。因此,从基因、蛋白等水平上研究大防御素的抗菌特异性对于水产养殖具有重要意义,能够防止杀害养殖动物中的有益菌群,且能从解决外患和防止内忧入手更好地达到防止动物病原感染的目的。
5.2.2 作为评估宿主免疫能力标志物的潜力
研究发现,物种特异性的抗菌肽能反映宿主的病原抗菌能力[59]。大防御素为海洋无脊椎动物所特有的抗菌肽,可通过作为评估宿主免疫系统能力强弱的标志物来筛选含有大防御素的牡蛎、扇贝等优良养殖物种亲本,以促进养殖动物的遗传改良。吴彪等[60]通过测定魁蚶不同发育时期大防御素的mRNA和蛋白质的动态变化,发现母源性大防御素能够通过卵细胞传递给子代,并在卵子受精后被逐渐消耗。此外,牡蛎和贻贝中大防御素基因表现出很高的序列多态性和表达多态性,Schmitt等[61]研究发现通过免疫相关基因的表达多态性和序列多态性可以区分夏季死亡率高时的高生存率个体和低生存率个体,因此可以通过测定养殖物种在菌刺激时大防御素的表达情况来进行优良品种的筛选。并且研究显示大防御素基因在牡蛎中会发生存在缺失变异[62],这是同一物种在基因水平上的个体差异,因此,大防御素可应用于更易适应环境、生物与非生物压力的品种筛选。这些研究提示,可以通过了解先天免疫因子大防御素在子代中的表达规律,并结合母源免疫开发提高宿主体内自身免疫因子含量的方法,来有效增强子代的免疫抵抗力,为科学制定提高养殖动物早期成活率的策略提供理论依据,进而促进魁蚶、牡蛎、扇贝等苗种繁育产业发展。
5.2.3 水产品安全
大防御素来源于水产源生物的先天免疫系统,研究显示化学合成和重组表达的大防御素对食品常见致病菌金黄色葡萄球菌(Staphylococcus aureus)甚至是耐多重药物的金黄色葡萄球菌具有很强的抗性[3,52],蛤蜊大防御素对鱼类腐败致病菌恶臭假单胞菌(Pseudomonas putida)具有很强的抗性[16],将其应用于水产生物中,有利于保证水产食品源的卫生安全性和进行水产食品的防腐。
5.3 新型药物开发——纳米网的形成
大防御素的N端结构域对Cg-BigDef1、Ap-BigDef1形成纳米网络结构,对盐离子稳定以及抗菌活性至关重要[3,52]。一方面,可利用这一特性设计一种类似于大防御素N端结构的药物载体将细菌诱引至不同接触靶点,使具有协同作用的抗菌肽与之充分接触,保证杀菌的高效性,同时更好地规避耐药性的风险;另一方面,在一些需要采用耐盐的抗菌肽治疗的疾病(如囊状纤维症)药物开发方面,大防御素的N端结构域在保证盐离子稳定抗菌活性上显示出巨大优势。研究发现Cg-BigDef1不会引起哺乳动物细胞毒性[3],说明大防御素的纳米结构对哺乳动物是安全的。综上所述,通过从大防御素的结构和抗菌特点逐步深入,可为新型药物的开发提供新的设计思路。
6 大防御素的重组表达与分析检测
鉴于大防御素的应用前景广泛,大防御素的高效获得方法成为研究热点。大防御素的重组表达是重要获得途径。Zhao Jianmin等[14]通过构建鳗弧菌感染的海湾扇贝的cDNA文库找到并克隆出海湾扇贝大防御素基因,根据酿酒酵母密码子使用偏好优化基因Ai-BigDef,亚克隆到重组表达载体pPIC9K中,由毕赤酵母GS115诱导表达了重组海湾扇贝大防御素,重组海湾扇贝大防御素对革兰氏阳性菌和阴性菌具有抑制活性。此外,采用聚丙烯酰胺凝胶电泳分离发酵液上清蛋白时有较多杂蛋白条带,而毕赤酵母分泌的内源蛋白极少[63],杂蛋白条带的出现可能是大防御素对宿主菌有溶菌作用,导致胞内蛋白的溶出,这一现象需要进一步的解释。毕赤酵母分泌表达外源蛋白的影响因素主要有密码子偏爱性、基因中腺嘌呤核苷酸和胸腺嘧啶核苷酸(A、T)含量、启动子、分泌信号、分子伴侣、基因拷贝数、糖基化修饰以及发酵条件等,近年来,针对这些影响因素开发了许多优化毕赤酵母表达系统的策略,有望实现目的蛋白的高效表达[64]。 而鉴于大防御素对大肠杆菌(Escherichia coli)的抑菌作用较弱,2010年,Zhao Jianmin等[16]构建了重组表达载体pET-21a-Vp-BigDef,以大肠杆菌BL21(DE3)-plysS为宿主菌成功表达了重组菲律宾蛤蜊大防御素,50 mL发酵液中可纯化得到0.9 mg重组蛋白。同样,Teng Lei[8]和González[7]等利用pET系列载体在大肠杆菌DE3中分别实现了头索动物文昌鱼大防御素Bj-Bigdef、紫扇贝大防御素Ap-Bigdef的重组表达,且均具有抗菌活性。为了提高大防御素的表达量,董姝君[18]进行了将谷胱甘肽转移酶与三角帆蚌大防御素在大肠杆菌中融合表达的尝试,实现了融合蛋白表达,并且随着时间的延长表达量逐渐增加。因此,通过毕赤酵母表达系统和大肠杆菌表达系统的不断完善以及大防御素表达条件的不断优化可实现大防御素的高效表达。
目前,防御素的测定方法有竞争性化学发光酶免疫分析法、狭缝印记测定法、半定量Western分析、酶联免疫吸附法、非标记液晶生物传感器法、基于选择性反应监测的蛋白质组学法、高效液相色谱-电喷雾电离-串联质谱法[65]。而大防御素的检测方法主要是生产对应的抗体,采用酶联免疫吸附法进行检测[7],酶解法裂解大防御素后,利用高效液相色谱-电喷雾电离-串联质谱法分析肽段进而对大防御素氨基酸进行分析[3]。针对大防御素的功能检测主要是通过微量肉汤稀释法测定大防御素对革兰氏阳性菌(如金黄色葡萄球菌、恶臭假单胞菌、溶壁微球菌(Micrococcus lysodikicus)等)和革兰氏阴性菌(大肠杆菌、弧菌等)的最小抑菌浓度[14,16]来评判其抗菌效果。
7 结 语
大防御素具有广泛应用潜力,但其实际应用首先要基于足够的生产量。但目前生物体合成量少,直接从生物体中提取困难,化学合成成本比较高且技术还不够成熟,无法达到应用的需求。因此,基因工程菌体外重组表达成为获取大防御素的重要途径。目前,对于大防御素的重组表达进行了大肠杆菌和毕赤酵母表达系统的初步尝试[7-8,14,16],但有关表达量、产物纯化以及纯化产物生物学活性的研究资料还十分缺乏,仅处于生产阶段,还未进入表达质量评估阶段。因此,今后研究的一个重点就是优化大防御素体外重组表达,以获得高表达、高质量的大防御素。另外,为了更好地挖掘大防御素的抗生素替代潜力以及设计开发更多的新型药物,需要加大大防御素相关基础问题的研究,例如大防御素的分离鉴定、大防御素的N端结构域和C端结构域的抗菌作用机理、大防御素与其他物质如抗生素等的互作等。
